Académique Documents
Professionnel Documents
Culture Documents
Connaissance Des Matériaux
Transféré par
Majda SerbatTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Connaissance Des Matériaux
Transféré par
Majda SerbatDroits d'auteur :
Formats disponibles
Année universitaire 2020/2021
Filière SMC, S4
Département de Chimie Module : Thermodynamique Chimique
Solution TD Série N°4 Pr ABDALLAOUI A.
Exercice N°1
1. La molalité est le nombre de moles d’un corps dissous dans 1000 g =1kg de solvant.
Unité : mol/g ou mol/kg (SI)
2. Nous raisonnons pour 1000g d’eau :
nH 1000
La molalité : m H 2 O
2O
n H 2O M H 2O .10 3 MHO
2
1000
mH 2O 55,55mol / kg
18
nH mH
La concentration : c H 2O 2O
2O
VH M H O .V H
2O 2 2O
1000
c H 2O 55,55mol / L
18 1
n2 n .1000
3.1. m2 3
2
n1M 1.10 n1M 1
3.2. D’après la formule précédente :
n2 n2 m2 M 1
x2
1000n2 n1 n2 1000n2
n2 1000 m2 M 1
n1
m2 M 1 m2 M 1
La densité ρ est donnée par la relation :
m'1 m'2 n M n2 M 2
1 1
V V avec m’ : masse et m : molalité
n2 n2
c2 V
V .103 103.C2 (On multiplie par 10-3 puisque c2 en mol.l-1)
c2 .103 n1M1 n2 M 2 c2 .103.n1M1 c2 .103.M 2
n2 n2 .
n2
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 4 – Page 1
c2 .103.n1M 1
n2
c2 .103.M 2 c2 .103.n1M 1 c2 .10 3.M 2
n2 1 1
c2 .103.n1M1 c2n1M1
n2
n2
c2 .103.M 2
103. c2 M 2
n2 c2 M1 n1 103. c2 M 2
n1
103. c2 M 2 2
n c2 M1
n1 103. c2 M 2 n1 n2 1 103. c2 M 2
1 1 1
n2 c2 M1 n2 x2 c2 M1
1
x2
103. c2 M 2 c2 M 1
1 x2 3
c2 M1 10 . c2 M 2 c2 M1
c2 M 1
x2
1000. c2 M1 M 2
Exercice N°2
1) En utilisant la loi de Raoult, nous calculons les pressions partielles et la pression totale au-
dessus de la solution :
Ptoluène xtoluène P*toluène 0,6 139 83,4mmHg
Pbenzène xbenzèneP*benzène 0,4 385 154mmHg
Ptotal Pbenzène Ptoluène 154 83,4 237 ,4mmHg
2) En utilisant la loi de Henry P2 Kx 2 , et en supposant qu’un litre contient 1000 g d’eau,
on en déduit :
nCO 2 nCO 2 K nCO 2
x2 P2
nH 2O nCO 2 mH 2O mH 2O
nCO 2 nCO 2
M H 2O M H 2O
mH 2 O mH 2 O 1000
nCO 2 55,55mol
M H 2O M H 2O 18
Puisque
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 4 – Page 2
K nCO 2 mH 2O .P2 1000 760
P2
mH 2O n CO 2
M H 2O .K
18 1,25.106
3,38.10 2 mol
M H 2O
La solubilité du CO2 dans l’eau à 25°C est 3,38 .10 2 mol / l
Exercice 3
A) Calcul des nombres de moles :
mH 2O 175
nH 2O 9,72mol
M H 2O 18
mNa 2 SO4 35
nNa 2 SO4 0,246mol
M Na 2 SO4 142
Il faut par ailleurs essentiel de savoir que, lorsqu’on dissout une mole de Na2SO4 solide, il y a
formation de deux moles d’ions Na+ et d’une mole d’ions SO42-, ainsi le nombre de moles de
particules en solution est égal à trois fois le nombre de moles de soluté dissous :
nsoluté 3 nNa2 SO4 3 0,246 0,738mol
nH 2O 9,72
H 0,929
2O
nH 2O nsoluté 9,72 0,738
On peut à présent utilisé la loi de Raoult pour caluler la pression de vapeur.
Psolution H 2O PH 2O 0,929 3,168 Psolution 2,94 kPa
B) Mélange équimolaire => χbenzène = χtoluène = 0,500
Pbenzène = benzène Pobenzène Ptoluène = toluène Potoluène
1: Pbenzène = benzène Pobenzène = 0,500 x 12,7 kPa = 6,35 kPa
Ptoluène = toluène Potoluène = 0,500 x 3,79 kPa = 1,90 kPa
Ptotale = Pbenzène + Ptoluène = 6,35 kPa + 1,90 kPa = 8,25 kPa
2: D’après la loi de Dalton : PA ' A PT 'A
PA
PT
6,35 1,90
Donc, 'benz vap 0,77 et 'tolu vap 0,23
8,25 8,25
- On remarque ici que la fraction molaire du liquide le plus volatil (benzène) est plus grande
dans la phase vapeur (0,770) que dans la phase liquide (0,500).
- Le mélange s’enrichit donc en composant le plus volatil lors d’une évaporation.
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 4 – Page 3
Exercice N°4
a. Voir courbe.
Température = f(temps)
P=1 bar P=0,5 bar P=0, bar
130
110
Temps en min
90
70
50
30
10
0 20 40 60 80 100
Température en °C
b. 1ère phase : la chaleur reçue par l’eau liquide provoque l’élévation de sa température.
2ème phase : la chaleur reçue par l’eau provoque son évaporation, à température constante.
3ème phase : la chaleur reçue par la vapeur d’eau provoque l’élévation de sa température.
c. L’évaporation d’un corps pur se fait à température constante.
d.
à P = 1 bar à P = 0,5 bar à P = 0,1 bar
100 °C 84 °C 56 °C
e. La température d’ébullition dépend de la pression.
Lorsque la pression diminue, la température d’ébullition diminue aussi.
Exercice N°5 - Diagramme binaire Eau – Chlorure de Sodium
1. cf. diagramme ci-dessous
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 4 – Page 4
2. Il s’agit du liquidus ; Cette courbe correspond à la solidification de l’eau pure à partir de la
saumure; corrélativement, la saumure s’enrichit en ions Na+ et Cl-
3. Le point E correspond à la composition de l’eutectique. Le salage routier en le plus efficace
correspond à cette proportion : 23% en masse de NaCl dans le mélange eau-sel.
En ce point, la saumure se transforme simultanément en 2 solides distincts : H2O(s) et
NaCl,2H2O(s).
Le calcul de la variance a pour but de déterminer le nombre de variables intensives, qui peuvent
varier pour un système donné.
v = (n-r) + 2 - φ
Attention : P est Constante, donc : v = (n-r) + 1 - φ
Ici n= 4 [H2O(liq) ; NaCl (dissous) ; H2O(s) et NaCl(s)],
r=2 (deux équilibres)
En ce point E :
φ=3 une phase liquide (saumure) + 2 phases solides H2O(s) et NaCl,2H2O(s).
Donc v =0
L’évolution du système est à pression constante fixée, donc en E la température est fixée
(TE = -22°C). Les variables intensives (P, T, xi, wi) sont toutes fixées.
4.1. Si nous ramenons le problème à une mole de mélange, il y aura x mol de NaCl et (1-x) mol
d'eau. Les masses correspondantes seront :
mNaCl xNaCl M NaCl
mH 2O xH 2O M H 2O 1 xNaCl M H 2O
mNaCl
Si w est le pourcentage massique : w 100
mNaCl mH 2O
une mole de mélange pèse :
mH2O mNaCl 1 xNaCl M H2O xNaCl M NaCl xNaCl M NaCl M H2O M H2O
xNaCl M NaCl
w 100
xNaCl
M NaCl M H 2O M H 2O
(1)
w
100
xNaCl M NaCl M H 2 O M H 2 O xNaCl M NaCl
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 4 – Page 5
w M NaCl
1 xNaCl M NaCl
M H 2O x
NaCl 1
En divisant tout par :
100
M H 2O M H 2O
w M NaCl w w M
xNaCl xNaCl xNaCl NaCl
100 M H 2O 100 100 M H 2O
w M NaCl w M NaCl w
xNaCl
100 M H 2 O 100 M H 2 O 100
M w M NaCl w
xNaCl NaCl 1
M H 2O 100 M H 2O 100
w
D'où la relation demandée : xNaCl 100
M NaCl w M NaCl
1
M H 2O 100 M H 2 O
xNaCl M NaCl
w 100
xNaCl M NaCl xH2O M H2O
4.2.
0,085 58 ,5
w 100 w 23,19% Il s’agit de l’eutectique !
0,085 58 ,5 1 0,085 18
4.3. Sous l’effet des déperditions de chaleur, la température du système s’abaisse progressivement de l’ambiante à -22°C.
Arrivé à la température de la solution ayant la
composition eutectique (- 22°C), le système
change d’état à température constante.
La durée de la transformation est la durée
nécessaire à l’évacuation de la chaleur libérée
par la solidification.
Puis la température s’abaisse à nouveau jusqu’à
-40°C.
4.4. Si on dissout une mole de NaCl dans un litre d’eau, calculer la température finale de la
solution (nommée saumure) obtenue.
Eau + NaCl(s) Eau + Na+ + Cl-
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 4 – Page 6
H nNaCl H D ( NaCl ) 1 H D ( NaCl ) H D ( NaCl )
1000
Dans un litre d’eau : nH 2O 55,5mol.L1
18
La variation d'enthalpie étant positive, cela signifie que la réaction est endothermique. En effet,
la rupture des liaisons dans le cristal nécessite de l'énergie, qui est absorbée par le "système NaCl"
aux dépends du système "'eau".
Prenons comme système le cas d'un litre d'eau et les ions correspondants.
C'est un système isenthalpique : H
i
i 0
Plus précisément H niC p i T 0
i
H D ( NaCl ) nH2OCP ( H2O)l T 0 Puisque CP( Na ) CP(Cl ) 0
H D ( NaCl ) 4500
T 1,08K
nH 2O C P ( H 2O ) l 55,5 75
Donc si l'eau était initialement à 0°C, la température finale T = - 1,08°C; mais elle ne gèle pas à
cause du sel !
4.5. On considère l'équilibre de solidification : H2O(l) (Saumure) H2O(s) (pure)
( H O) Saumure ( H O) Pure
Les potentiels chimiques des deux phases sont égaux : 2 2
( H O)l RTLnx( H O) ( H O) s
2 2
Il y a donc égalité des potentiels chimiques : 2
( H O)l ( H O) s RTLnx( H O)
2 2 2
( H O ) l ( H O ) s G0fus ( H O )
RLn x( H 2O ) 2
T
2
T
2
G H
Relation de Gibbs Helmholtz : 2 ; en supposant ΔS indépendant de T.
T T T
H fus ( H O ) 0
Dans notre cas :
T
RLn x( H 2O ) T 2
2
H 0fus ( H O ) H 0fus ( H
T
Ln x( H 2O )
RT 2
2
d Lnx( H O) 2
R
2O )
.
dT
T2
H 0fus ( H O ) T f ( mél )
d Lnx
Ln ( xe )
dT
En intégrant :
Ln (1)
( H 2O)
R
2
.
T f ( H 2O )
T2
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 4 – Page 7
H 0fus ( H H 0fus ( H O ) 1 1
Ln1 x( NaCl )
1 1
Ln x( H 2O ) 2O )
. et
2
.
R T f ( H 2O ) T f ( mél) R Tf ( H 2O ) T f ( mél)
C'est l'équation mathématique du liquidus de gauche. C'est en fonction de x( NaCl ) au lieu de
w(NaCl ) .
Remarque : Température de fusion = Température de solidification :
H 0fus ( H
Ln1 x( NaCl )
1 1
2O )
.
R TSolidif ( H 2O ) TSolidif ( mél)
4.6. Attention, NaCl se dissocie en 2 ions ; mathématiquement, tout se passera comme s'il y
avait 2 fois plus de NaCl,
C’est-à-dire : x NaCl 2 0,085 0,170 Par ailleurs : H 0fus ( H O) 6,00kJmol1
2
H 0fus ( H
Ln1 x( NaCl )
1 1
2O )
.
R Solidif ( H 2O )
T T
Solidif ( mél)
Ln1 x( NaCl )
1 1 R
TSolidif ( mél) TSolidif ( H 2O ) H 0fus ( H
2O )
Ln1 0,17
1 1 8,31
0,00392
TSolidif ( mél) 273 6000
TSolidif ( mél) 255K 18C
(Proche de la valeur expérimentale obtenue sur le diagramme)
Il faut préciser les approximations effectuées :
* Système idéale * H 0fus et S 0fus indépendants de T
Cela peut expliquer un écart de 4°C.
Exercice N°6 – Volume molaire partiel
A.a) Le préparateur n’arrivera pas à un mélange de 100 mL car le volume total n’équivaut pas à la
somme des volumes des composants du mélange.
A.b) En effet le volume total est donné par :
V nEtOH V EtOH nH 2O V H 2O
Nous avons au départ : 70 mL d’eau et H2O = 1 g/mL
30 mL d’éthanol et EtOH = 0,785 g/mL
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 4 – Page 8
mi ni .M i Vi
i ni i .
Vi Vi Mi
VH 2 O VEtOH
nH 2 o H 2 O . 3,88mol nEtOH EtOH . 0,51mol
M H 2O M EtOH
V nEtOH V EtOH nH 2O V H 2O 0,551 53,6 3,88 18 97,18cm3
V 97 ,18 cm 3 donc nous constatons que le préparateur ne peut pas constituer une solution de
100 cm3 en mélangeant 30 cm3 d’éthanol avec 70 m3 d’eau.
A.c) Pour constituer une solution de 100 cm3 il faut un mélange comportant les fractions molaires
suivantes :
nH O nEtOH
2
0,88 xH 2 O 0,12 xEtOH
ntotal ntotal
Mais avec un nombre total de mole calculé avec la relation suivante :
V 100cm3 ntotal xEtOH V EtOH ntotal xH 2O V H 2O ni ntotal xi
100cm 3 100
ntotal ntotal 4,49 mol
x EtOH V EtOH x H 2O V H 2O 0,12 53,6 0,88 18
Le mélange aurait dû contenir :
n EtOH ntotal x EtOH 4,49 0,12 0,54 mol
nH 2O ntotal xH 2O 4,49 0,88 3,95mol
ni .M i
Vi
Or
i
0,54 46 3,95 18
VEtOH 31,6cm3 VH 2 O 71,1cm3
0,785 1
VEtOH 31,6ml et VH 2O 71,1ml
Le préparateur devrait donc mélanger 71,1 ml d’eau et 31,6 ml d’éthanol pour arriver à un mélange
de 100 ml.
B) Les fractions molaires du mélange sont :
n A 1mol nB 3mol
A : NH3 et B : H2
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 4 – Page 9
nA 1 1 nB 3 3
xA xB
n A nB 3 1 4 n A nB 3 1 4
Gmél n A RTLn ( x A ) nB RTLn ( xB ) RT n A Ln ( x A ) nB Ln ( xB )
1 3
Gmél 8,31 2981Ln 3Ln Gmél 5,58 kJ
4 4
Gmél
est négative implique que le processus (c-à-d le mélange) est possible (spontanément) :
mélange totalement miscible.
Exercice N°7 – Calcul de volume molaire partiel
1. La molalité du chlorure de sodium m est sa quantité de matière par kilogramme de solvant.
n2
En notant mS = 1,00 kg la masse d’eau, nous avons : m
ms
Par définition du volume molaire partiel :
En dérivant l’expression empirique proposée, on a ainsi :
1
V 2 16,62 2,655m 0,24m 2
Où V2 est exprimé en mL.mol−1 et m en mol.kg−1.
2. A.N. : V 2 (0,1) 17,48 mL.mol−1 ;
V 2 (1,0) 19,52 mL.mol−1 ;
V 2 (0) 16,62 mL.mol−1. (Infiniment diluée : m 0 )
3. Il s’agit ici de déterminer une grandeur partielle du constituant 1 connaissant celle du
constituant 2. Il faut donc utiliser la relation de GIBBS-DUHEM à P et T, on a :
n2
n1dV 1 n2dV 2 0 et dV 1 dV 2
n1
or n2 m ms et ms n1 M 1 n2 m n1 M 1
En déduit donc : dV 1 mM1dV 2
molalité Volume molaire partiel H2O volume molaire partiel NaCl
0 V m ,l V 2( 0)
m V1 V2
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 4 – Page 10
V1 V2
On a ainsi :
V m ,l
dV
1 V 2(0)
mM1dV 2
V2
V 1 V m,l M1 m.d (V 2 ) (1)
V 2(0)
4. Compte tenu de la première question, on a la différentielle :
1
1
dV 2 ( .2,655 m 2 0,24 ) dm (2)
2
1
1
V2
(2) dans (1) : V 1 V m, l M1 m.( .2,655m 2 0,24)dm
V 2(0) 2
1
m 1
V 1 V m , l M1 ( .2,655m 2 0,24m)dm
0 2
m
2,655 32 0,24 2
V 1 V m, l M1 m m
3 2 0
3
V 1 V m,l M 1 0,885m 2 0,12m 2
M1
Or H 2O à 25 °C 𝜌𝐻2𝑂 = 0,997𝑔. 𝑚𝑙 −1
V m ,l
M1 18,015
V m,l 18,07ml.mol 1
H 2O 0,997
3
V 1 V m ,l M 1 0,885m 2 0,12m 2
3
V 1 18,07 18,015 0,885m 2 0,12m 2
3
V 1 18,07 0,0159m 0,00216m2 AN :
2
V 1(0,1) 18,069ml.mol 1
V 1(1,0) 18,052ml.mol 1 V 1(0) 18,070ml.mol 1
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 4 – Page 11
Exercice N°8 – Étude du mélange binaire liquide-solide LiCl-KCl
1. Nous allons transformer la fraction massique w1 = wKCl en fraction molaire xKCl.
mKCl nKCl M KCl
w1
mKCl mLiCl nKCl M KCl nLiCl M LiCl
nKCl 74,6
w1 0,55 nLiCl 1,44 nKCl
nKCl 74,6 nLiCl 42,4
nKCl nKCl 1
xKCl 0,41
nKCl nLiCl nKCl 1,44 nKCl 2,44
xKCl du mélange eutectique est donc de 41 %.
2. Le mélange correspondant à l’eutectique est le mélange possédant la température de
solidification la plus faible.
C’est également le seul mélange qui se comporte comme un corps pur.
De plus, la composition de l’eutectique ainsi que sa température de cristallisation sont
parfaitement définies.
3. Le diagramme a l’allure classique
d’un binaire de deux solides non
miscibles en équilibre avec une phase
liquide.
La courbe supérieure est la courbe de
liquidus, c’est-à-dire la courbe qui
indique la composition de la phase
liquide.
4. Les deux droites verticales à gauche
et à droite correspondent aux droites
de solidus et s’arrêtent aux
températures de fusion des deux
solides (respectivement LiCl à
gauche et KCl à droite).
La composition des différents
domaines ainsi que leur nature
physique sont données sur le
diagramme ci-dessous :
5. Pour déterminer les diagrammes binaires, on étudie les courbes de refroidissement de
différents mélanges. Ces courbes de refroidissement changent de pente lors du passage de
liquide à solide, puis présentent un palier à la température de l’eutectique, pour continuer
à refroidir ensuite.
Chaque courbe permet donc de déterminer le diagramme point par point.
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 4 – Page 12
Année universitaire 2020/2021
Filière SMC, S4
Département de Chimie Module : Thermodynamique Chimique
Solution TD Série N°5 Pr ABDALLAOUI A.
Exercice N°1 – Chaleur du mélange
Lorsque nous observons un volume d’excès négatif, nous avons une réaction exothermique.
Cela s’explique par le fait que dans un mélange exothermique des attractions entre les deux
composés se forment.
Ces attractions attractives sont plus fortes que les attractions inter-composées.
Par exemple, dans un mélange binaire eau-méthanol, qui est exothermique, il y a formation
de liaisons hydrogènes qui font que les molécules des deux liquides s’approchent
d’avantage les unes des autres et créent donc une diminution du volume total, un volume
d’excès négatif.
Exercice 2. Détermination d'une quantité d'eau évaporée.
Partie A
A.1.
A.2. Voir figure A.1.
A.3. Le point triple est le point du diagramme de phase où les trois limites de phase se
coupent.
Il correspond à la coexistence de trois états (liquide, solide et gazeux) d'un corps pur.
Il est unique et s'observe seulement à une T et P données ; dans cet état la variance est
nulle.
Le point triple de l'eau est à : T = 0°C = 273,15 K (la valeur réelle est 0,01 °C=273,16K)
et P = 6,15 mbar =615 Pa (soit 0,006 atm).
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 5 – Page 1
Partie B
1. Non, car cela dépend du taux d’humidité de
la buanderie.
L’eau s’évapore tant que le taux d’humidité
reste inférieure à 100%, c.à.d. tant que la
pression de vapeur d’eau est inférieure à la
pression de vapeur saturante (23 mbar à
20°C).
2. Nous cherchons à partir du diagramme, la
pression de vapeur pour T = 20°C = 293 K.
Nous trouvons P=23 mbar
3. L’évaporation cesse lorsqu’il y aura 100% d’humidité, c.-à-d. lorsqu’il y aura ns moles de vapeur
d’eau à la pression saturante présente dans la buanderie.
PsV
ns
RT
Avec V le volume de la buanderie qui correspond au volume de la vapeur d’eau (le volume d’eau
liquide étant négligeable devant le volume de la buanderie).
Ps 23mbar 23.103 bar 23.102 Pa
23.102 30
ns 28,3mol
8,31 293
Or, il y a initialement un taux d’humidité de 60%, donc ni moles de vapeur d’eau déjà présente dans
la buanderie.
60
ni ns . 17mol
100
Le nombre de mole d’eau qui pourrait s’évaporer de la flaque est ne :
ne ns ni 28 ,34 17 11,34 mol
ns .M me n .M
Soit un volume V : V puisque e
V V
11,34 18
V 204mL 0,2 L
1g / mL 1
Il reste donc 0,8L d’eau liquide (1 – 0,2) et l’on est en présence d’un équilibre liquide-vapeur.
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 5 – Page 2
Exercice N°3 – Principe de la cocotte – minute (ou "auto-cuiseur").
1) La température d’ébullition est donnée par la relation de Duperray :
4 1/ 4
t P
1/ 4
1
PS P0 t 100 sat 100 100C :
100 P0 1
2) La soupape s’ouvre lorsque la pression totale à l’intérieur est 1 bar plus élevée qu’à l’extérieur,
c.-à-d. : Ptot = 2 bars
Ce surplus de pression est dû à la pression de vapeur d’eau qui s’ajoute à la pression de l’air :
Ptot = somme des pressions partielles de chaque gaz = Pvap + Pair
3) Pour une pression de déclenchement plus élevée, la température des aliments serait pus
importante : les aliments cuiraient plus vite mais perdraient leurs qualités gustatives
(bouillie!).
1/ 4
P
1/ 4
2
t 100 sat 100 120C
P0 1
4) Initialement (T=20°C et P= 1bar) : Volume d’air enfermé dans la cocotte qui est de 8-1=7 L
(volume de la cocotte moins le volume occupé par l’eau).
On a donc nair moles d’air enfermées dans la cocotte:
PV 10 7.10
5 3
nair 0,29mol
RT 8,31 293
Lorsque la soupape se déclenche (T= 120°C, Ptot=2bar, Pair?) : l’air se trouve à T=120°C, elle
occupe toujours un volume de 7 L, et son nombre de moles n’a pas encore varié. La pression
de l’air est donc :
nair RT 0,29 8,31 393
Pair 3
1,35.105 Pa 1,35bar
V 7.10
5) Lorsque la soupape se déclenche : Ptot= Pair+Pvap = 2 bars.
Donc la pression de vapeur d’eau présente est Pvap= 2 – 1,35 = 0,65 bar
Le nombre de moles de vapeur est donc :
PvapV 0,65.105 7.103
nvap 0,14mol
RT 8,31 393
1
Donc mvap nvap M 0,14 18 2,52g Soit 2,5 ml = cuillère à café.
2
6) Lorsque la soupape se déclenche, la pression est de 2 bars.
1 kg d’eau prend un volume de 1 L, il reste donc 7 L de volume pour la vapeur.
Comme 2,5 mL d’eau suffisent à atteindre les 2 bars (1,35 bars étant fournis par l’air), on en
déduit que l’eau reste donc essentiellement liquide dans la cocotte ! soit 1kg .
Evidement si on laisse la soupape trop longtemps déclenchée, toute l’eau sera évaporée et
évacuée, ... c’est brulé, fallait ne pas discuter trop au téléphone !
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 5 – Page 3
Exercice N 4° – durée d'échauffement
Nous possédons 2 récipients qui renferment la phase liquide (1 kg) et solide (200g) de l'eau et de
l'argent (voir le schéma ci-joint).
Quelle est la durée nécessaire pour échauffer d'1 °C la température de chaque bain ?
Données :
Chaleurs latentes de fusion : L fHg 0,12.105 Jkg1 et L f glace 3,52.105 Jkg1
Chaleurs massiques, supposées Constantes :
1 1
Ceau 4180JK 1kg1 et CHg 139JK kg
Solution
Pour faire fondre la glace il faut une chaleur :
Qglace mglace L f 0,2 3,52.105 70,4kJ
Pour échauffer l’eau de 1K = 1°C, il faut une chaleur :
Qeau meauCeau 1,2 4180 5016 J
Il faut donc apporter en tout :
QH2O Qglace Qeau 70400 5016 75416J
La durée nécessaire pour apporter cette énergie :
QH 2O 75416
t H 2O
P
1.10 3
75 ,4 s tH O 1min15s
2
De même pour le bain de mercure
QHg QHg sol QHg Liq 0,2 0,12.105 1,2 139 2567J
t Hg
QHg
P
2567
1.10 3
t Hg 2,57s Environ 30 fois plus rapide que pour l’eau.
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 5 – Page 4
Année universitaire 2020/2021
Filière SMC, S4
Département de Chimie Module : Thermodynamique Chimique
Solution TD Série N°6 Pr ABDALLAOUI A.
Exercice N°1 - Mélange binaire dioxygène-diazote
1. Mélange idéal :
a. C’est un mélange où les propriétés des corps purs sont conservées.
b. C’est un mélange de deux liquides purs miscibles dont le volume total de la solution est la
somme des volumes des deux liquides mélangés. Vmél = V1 + V2
c. C’est un mélange où sa vapeur peut-être considérée comme un mélange de gaz parfaits.
d. C’est un mélange où la pression de vapeur totale de la solution varie linéairement avec les
valeurs P°A et P°B en fonction des fract. molaires dans la solution liquide.
e. C’est un mélange où ΔHdissol ≈ 0 c-à-d les interactions soluté-solvant sont du même ordre
de grandeur que interactions soluté-soluté et solvant-solvant.
2. L’aspect du fuseau quasi régulier montre un mélange proche de l’idéal. Nous pouvons donc
considérer que les interactions entre les molécules de dioxygène et de diazote sont
identiques, et la solution se comporte donc quasiment comme un liquide pur.
3. S’agissant d’un diagramme liquide-vapeur, l’élévation de température fait passer le mélange
de l’état liquide à l’état gazeux.
Nous en déduisons que le domaine I est celui de la phase liquide, le domaine II est un mélange
liquide-vapeur, et le domaine III contient la phase vapeur.
4. La courbe (a) représente l’ensemble des points pour lesquels apparaît la première goutte de
liquide lors du refroidissement de la vapeur.
5. La courbe (a) est la courbe de rosée, la courbe (b) la courbe d’ébullition.
6. D’après la position du point figuratif M sur le diagramme, nous observons qu’il y a un
mélange des deux phases (liquide et vapeur).
Le nombre de mole n du mélange se répartit donc en phase vapeur (nV) et en phase liquide
(nL), soit les relations :
𝑛 = 𝑛𝑉 + 𝑛𝐿 ; 𝑛𝑉 = 𝑛𝑉(𝑂2) + 𝑛𝑉(𝑁2) ; 𝑛𝐿 = 𝑛𝐿(𝑂2) + 𝑛𝐿(𝑁2)
Soient les fractions molaires en dioxygène xV et xL respectivement pour la phase vapeur et la phase
liquide, nous obtenons alors la relation :
𝑥𝑉 . 𝑛𝑉 + 𝑥𝐿 . 𝑛𝐿 = 𝑛. 𝑥𝑀 avec 𝑛𝑉 = 𝑛 − 𝑛𝐿
Relation qui se transforme donc en :
𝑛𝐿 . (𝑥𝐿 − 𝑥𝑉 ) = 𝑛(𝑥𝑀 − 𝑥𝑉 )
Or (𝑥𝐿 − 𝑥𝑉 ) est égale au segment AB, et (𝑥𝑀 − 𝑥𝑉 ) est égale au segment AM.
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 6 – Page 1
Donc : 𝑛𝐿 . 𝐴𝐵 = 𝑛. 𝐴𝑀
Remarque
Cette relation représente le théorème des moments qui s’exprime plus souvent sous la forme :
𝑀𝐵 + 𝑛𝑉 . ̅̅̅̅̅
𝑛𝐿 . ̅̅̅̅̅ 𝑀𝐴 = 0
Ce théorème permet, en fonction de la position d’un point figuratif dans le diagramme binaire,
de connaître la répartition de la quantité en phase vapeur et de celle en phase liquide.
7. La composition du mélange indique une fraction en dioxygène de xL = 0,60. La première
goutte de vapeur apparaît donc à une température de 83 K.
8. Il faut trouver la température pour laquelle la fraction molaire en dioxygène est de xL = 0,75.
Nous obtenons sur le diagramme une température proche de 85 K.
9. Pour un tel mélange où xL = 0,75 en dioxygène, la composition de la phase vapeur est
de xV = 0,42.
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 6 – Page 2
Nous pouvons appliquer le théorème des moments au point figuratif N, ce qui nous donne le nombre
de mole de la phase liquide nL
𝑉𝑁 (𝑥−𝑥𝑉 )
𝑛𝐿 . 𝑉𝐿 = 𝑛. 𝑉𝑁 ⇒ 𝑛𝐿 = 𝑛.
𝑉𝐿
= 𝑛.
(𝑥𝐿 −𝑥𝑉 )
Le nombre de mole total n du mélange est donné par la relation :
𝑚
𝑛=
(0,6𝑀𝑂2 ) + (0,4𝑀𝑁2 )
Nous obtenons donc finalement :
𝑉𝑁 𝑚 𝑉𝑁
𝑛𝐿 = 𝑛. = .
𝑉𝐿 (0,6𝑀𝑂2 ) + (0,4𝑀𝑁2 ) 𝑉𝐿
1.106 (0,60 − 0,42)
𝑛𝐿 = .
(0,60 𝑋 32) + (0,40 𝑋 28) (0,75 − 0,42)
𝑛𝐿 = 1,8.104 𝑚𝑜𝑙
Cette quantité de liquide correspond à un mélange dont la composition est de 75 % de dioxygène et
de 25 % de diazote. La masse molaire d’un tel mélange est donc de :
𝑀𝐿 = (0,75𝑀𝑂2 ) + (0,25𝑀𝑁2 )
𝑀𝐿 = (0,75 𝑋 32) + (0,25 𝑋 28) = 31 𝑔/𝑚𝑜𝑙
La masse de liquide récupérée est donc de : 𝑚𝐿 = 𝑛𝐿 . 𝑀𝐿
𝑚𝐿 = 1,8.104 𝑋 31 = 5,6.105 𝑔
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 6 – Page 3
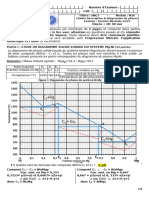
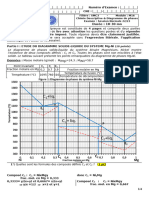
Exercice N°2 - Mélange binaire - diagramme isotherme
On s’intéresse au mélange binaire A-B, dont le
diagramme isotherme est donné ci-joint. Soient :
xA : fraction molaire de A dans la phase liquide,
yA : fraction molaire de A dans la phase vapeur,
PoA : pression de vapeur saturante de A,
PoB : pression de vapeur saturante de B,
Pt : pression totale de la phase vapeur.
1) Définir les zones I, II et III
Zone I : Liquide - Gaz
Zone II : Gaz
Zone III : Liquide
2) Définir les courbes a et b
Courbe a : Courbe de Rosé Courbe b : Courbe d’Ebullition
3) Donner les valeurs des pressions de vapeur saturante de A et de B
PoA = 12,7 KPa PoB = 3,8 KPa
4) Pour ce mélange, quel est le composé le plus volatil ? Justifier votre réponse.
- Composé A
- Car PoA > PoB
5) Rappeler la loi de Raoult et donner la signification des termes de cette loi.
PA x A PA0 PA : Pression de vapeur de A au-dessus de mélange ;
x A : Fraction molaire de A dans la phase liquide ;
PA0 : Pression de vapeur saturante de A pur ;
6) Rappeler la loi de Dalton et donner la signification des termes de cette loi.
PA y A Pt PA : Pression de vapeur de A ;
y A : Fraction molaire de A dans la phase vapeur ;
Pt : Pression total de la phase vapeur ;
7) Donner l’équation mathématique qui relie Pt en fonction de xA ; PoA et PoB
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 6 – Page 4
Expression littéraire :
Pt PB0 xA PA0 PB0
8) Donner l’équation mathématique qui relie yA en fonction de Pt ; PoA et PoB
Pt PA* PB* PA*
Expression littéraire yA
Pt PA PB
12,7 Pt 48,26
Expression numérique yA
8,9 Pt
9) Quelle est la pression de vapeur totale au-dessus d’un mélange équimolaire en A et B ?
Pt 8,25 KPa
Pt PB0 xA PA0 PB0 x A 0,5
10) Quelles sont les fractions molaires de A et de B dans la phase vapeur du mélange équimolaire ?
y A 0,77
y B 0,23
11) En comparant les fractions molaires du liquide et de vapeur, tirer une conclusion concernant la
volatilité des composés de ce mélange.
x A xB
et y A yB A est plus volatil que B
Exercice 3 - Diagramme binaire eau éthanol
On étudie le diagramme binaire isobare du
mélange eau-éthanol établi en fonction des
fractions molaires XA et YA dans le mélange à
pression constante. Ce diagramme est reporté
ci-joint :
1) Donner les températures d’ébullition de l’eau
pure et de méthanol pur.
Teb Eau : 100°C
Teb Méthanol : 74,5°C (entre 74 et 75)
2) Définir les fractions molaires XA et YA
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 6 – Page 5
XA : Fraction molaire de l’éthanol dans la phase liquide.
YA : Fraction molaire de l’éthanol dans la phase vapeur.
3) Donner le nom du point E et sa caractéristique :
Point azéotrope, ou mélange azéotropique
C’est un mélange qui présente, pour une composition particulière, une phase
vapeur ayant la même composition que la phase liquide avec laquelle elle est en
équilibre.
4) On considère une mole de mélange liquide de composition Xeau =0,7 et initialement à 20°C que l’on
chauffe sous pression constante.
4.a) A quelle température l’ébullition commence-t-elle et quelle est la composition de la première
bulle formée ?
≈ 73°C (Entre 72°C et 74 °C) ≈ 74 % en Ethanol
4.b) A quelle température la dernière goutte de liquide s’évapore-t-elle et quelle est la composition de
cette dernière goutte ?
94 °C ≈ 3 % en Ethanol
5) On place à 84°C une mole d’un mélange équimolaire eau/éthanol, déterminez numériquement les
fractions molaires en éthanol et en eau de chaque phase.
Xéth ≈ 10 % Xeau ≈ 90 %
yéth ≈ 60 % Yeau ≈ 40 %
Thermodynamique Chimique - Filière SMC, S4 Solution Série N° 6 – Page 6
Vous aimerez peut-être aussi
- Echangeur de Chaleur-Correction Du Devoir LibreDocument5 pagesEchangeur de Chaleur-Correction Du Devoir LibreBadr KaakouaPas encore d'évaluation
- Exo GéochimieDocument16 pagesExo GéochimieRouchda Ibrahim100% (1)
- Corrigé EX 2-b Série3 PE PDFDocument5 pagesCorrigé EX 2-b Série3 PE PDFgehikaw100% (3)
- TD2 ContraintesDocument10 pagesTD2 ContraintesSara Kbt78% (9)
- Pompes Et Compresseurs Corriges D Exercices Et ProblemesDocument12 pagesPompes Et Compresseurs Corriges D Exercices Et Problemesabdou67% (3)
- MMC Exo CorrigerDocument4 pagesMMC Exo Corrigerounous100% (4)
- Diagramme D'équilibre Chap2 SDM 2015-16.2Document28 pagesDiagramme D'équilibre Chap2 SDM 2015-16.2pixouPas encore d'évaluation
- TD2 PDFDocument3 pagesTD2 PDFManal Nebhani100% (1)
- Analyse Thermique SimpleDocument8 pagesAnalyse Thermique SimpleSalim Bouazizi33% (3)
- Serie01 SemiconducteurDocument5 pagesSerie01 SemiconducteurGoldFreind100% (2)
- Exercice Corrigé - Méthode Des Trois Moments 2Document4 pagesExercice Corrigé - Méthode Des Trois Moments 2Kamel Oumrich50% (2)
- Support de Cours de Diagramme de Phases SMC3Document65 pagesSupport de Cours de Diagramme de Phases SMC3Yc YacinePas encore d'évaluation
- Cycle FrigorifiqueDocument9 pagesCycle FrigorifiqueFaycal Bouhania100% (1)
- TD #04 Milieux PoreuxDocument3 pagesTD #04 Milieux PoreuxFolla ZahraPas encore d'évaluation
- Contreventement NIAZIDocument48 pagesContreventement NIAZIroma JamanPas encore d'évaluation
- M 3 16 CorDocument3 pagesM 3 16 Cormostafamazih.00Pas encore d'évaluation
- Demarche Calcul BilanDocument19 pagesDemarche Calcul Bilanrihab messaiPas encore d'évaluation
- Suite Suj Exam OP-2017-2018Document5 pagesSuite Suj Exam OP-2017-2018AliOucharPas encore d'évaluation
- Bts TP 2018 U41 Corrige PDFDocument7 pagesBts TP 2018 U41 Corrige PDFMehdi El MelaliPas encore d'évaluation
- TD1 - Unité Et Descente Des ChargesDocument2 pagesTD1 - Unité Et Descente Des ChargesBrahim Zlatan100% (1)
- Correction Examen l2 PDT 2016-2017 - PDT I - e RattrapageDocument3 pagesCorrection Examen l2 PDT 2016-2017 - PDT I - e Rattrapagehar asPas encore d'évaluation
- Solution Exercices de Suivi Temporeldune Transformation Vitesse DereactionDocument13 pagesSolution Exercices de Suivi Temporeldune Transformation Vitesse DereactionTsu BakiPas encore d'évaluation
- Application Pour Les LissesDocument2 pagesApplication Pour Les LissesRoi DadaPas encore d'évaluation
- Corrigé Session Normale Descriptive & Diagramme de Phases 2022-2023Document4 pagesCorrigé Session Normale Descriptive & Diagramme de Phases 2022-2023Ali AtbirPas encore d'évaluation
- PiscineDocument19 pagesPiscineOmar BoukhrisPas encore d'évaluation
- Corrigé Session Normale Descriptive & Diagramme de Phases 2022-2023Document5 pagesCorrigé Session Normale Descriptive & Diagramme de Phases 2022-2023Ali AtbirPas encore d'évaluation
- TD 1 ArbreDocument6 pagesTD 1 Arbreislam.boubekeurPas encore d'évaluation
- Solution de La Série D'exercices 03 MDFDocument7 pagesSolution de La Série D'exercices 03 MDFMar WaPas encore d'évaluation
- Thermo L2 TD2 CorrectionDocument4 pagesThermo L2 TD2 CorrectionRahal karim100% (2)
- TD2 Transmission Palan MotDocument6 pagesTD2 Transmission Palan MotFerchichi HatemPas encore d'évaluation
- Solution Fiche de TD2 BA (Partie1)Document7 pagesSolution Fiche de TD2 BA (Partie1)Sad EkPas encore d'évaluation
- Correction Exam21Document4 pagesCorrection Exam21Zineb KhadranePas encore d'évaluation
- Travaux Dirigés 1 Eqt NRJDocument11 pagesTravaux Dirigés 1 Eqt NRJAMIneeePas encore d'évaluation
- Corrige Travaux Diriges de La Serie 1Document4 pagesCorrige Travaux Diriges de La Serie 1Yousra adouanePas encore d'évaluation
- TDs Et Corrigés - Mecanique Des FluidesDocument36 pagesTDs Et Corrigés - Mecanique Des FluidesGaoussou O. DoumbiaPas encore d'évaluation
- Assemblages Par Boulons HR-1Document8 pagesAssemblages Par Boulons HR-1aymen nouariPas encore d'évaluation
- Solution Des Exercices Du td-2Document6 pagesSolution Des Exercices Du td-2soumia bouPas encore d'évaluation
- Solutions TD No.3 Exercice 1Document9 pagesSolutions TD No.3 Exercice 1pwremilyPas encore d'évaluation
- Transfert de ChaleurDocument10 pagesTransfert de ChaleurAyoubPas encore d'évaluation
- Examen2 Turbomachines 2Document4 pagesExamen2 Turbomachines 2Brice GamintePas encore d'évaluation
- Turbomachines 2-Chapitre 1 - Application Cours PDFDocument1 pageTurbomachines 2-Chapitre 1 - Application Cours PDFZAKI HITLERPas encore d'évaluation
- Concours 2005 CorrigeDocument17 pagesConcours 2005 CorrigeMohammed Ben AliPas encore d'évaluation
- Chimie (5points)Document7 pagesChimie (5points)melekPas encore d'évaluation
- 5transport Par Convoyeur À BandeDocument3 pages5transport Par Convoyeur À BandeHalim SarriPas encore d'évaluation
- CH 07Document77 pagesCH 07박병준100% (1)
- ـ نشاط عينة مشعDocument6 pagesـ نشاط عينة مشعleader0Pas encore d'évaluation
- 4-Acroter2 New1 PDFDocument9 pages4-Acroter2 New1 PDFSalah HadjiPas encore d'évaluation
- Chapitre 2Document77 pagesChapitre 2Mohamed El YahyaouiPas encore d'évaluation
- TD PSCH - Exo 18-Au 23Document18 pagesTD PSCH - Exo 18-Au 23Inas DrPas encore d'évaluation
- Axamen DDS S2 2017Document2 pagesAxamen DDS S2 2017Ishak BaïchePas encore d'évaluation
- Z R L V I A Z PRI KW V Z I RI P S VI: Solutions OnduleursDocument4 pagesZ R L V I A Z PRI KW V Z I RI P S VI: Solutions OnduleursAnes KassoulPas encore d'évaluation
- Calculo de Materiales Sistema de Luz1Document3 pagesCalculo de Materiales Sistema de Luz1innovaing2023Pas encore d'évaluation
- Examen de Thermodynamique-2018-2019Document3 pagesExamen de Thermodynamique-2018-2019Abdellatif OudranePas encore d'évaluation
- CI05 AD15 Corrigé - Déterminer Les Équations de Mouvement Et Les Lois de Commande en Effort Dans Un Mécanisme en Chaîne FerméeDocument6 pagesCI05 AD15 Corrigé - Déterminer Les Équations de Mouvement Et Les Lois de Commande en Effort Dans Un Mécanisme en Chaîne FerméenadyPas encore d'évaluation
- Cours Transformateur 2018Document33 pagesCours Transformateur 2018Abdourazak AbouPas encore d'évaluation
- SJ VomDocument27 pagesSJ Vomkacem19985Pas encore d'évaluation
- Fiche TD N01Document2 pagesFiche TD N01amiira bouzouadaPas encore d'évaluation
- Rattrapage de La Thermodynamique 1ére ST (Dr. OUDRANE A.)Document3 pagesRattrapage de La Thermodynamique 1ére ST (Dr. OUDRANE A.)Abdellatif OudranePas encore d'évaluation
- TD ENSA Onduleur N02 CorrigeDocument5 pagesTD ENSA Onduleur N02 CorrigeMohamed BoukhalfaPas encore d'évaluation
- Corriges Chimie Atomistique 1Document16 pagesCorriges Chimie Atomistique 1Aziz KABOREPas encore d'évaluation
- Chapitre 4 Transition de Phase Version Simplifiée STDocument45 pagesChapitre 4 Transition de Phase Version Simplifiée STArmel YmgPas encore d'évaluation
- Diagramme de PhaseDocument170 pagesDiagramme de Phaseafaf dPas encore d'évaluation
- Systemes A 3 ConstituantsDocument4 pagesSystemes A 3 Constituantsہٰﮱۅ ہٰﮱۅPas encore d'évaluation
- Air HumideDocument20 pagesAir HumidefwilcorporationPas encore d'évaluation
- SMC3 Session Rattrapage 20-21-CorrigéDocument4 pagesSMC3 Session Rattrapage 20-21-CorrigéTalel pdfPas encore d'évaluation
- Série #3 - S4 2021 PDFDocument3 pagesSérie #3 - S4 2021 PDFYounesPas encore d'évaluation
- Exercices CHP2Document6 pagesExercices CHP2haythemkantasPas encore d'évaluation
- Chapitre 4 - Équilibre PhysiqueDocument14 pagesChapitre 4 - Équilibre PhysiqueRAMDEPas encore d'évaluation
- Magmatisme TD1 L3 2021Document8 pagesMagmatisme TD1 L3 2021ali BourenanePas encore d'évaluation
- Memoire Exploitation Des Navires CiternesDocument74 pagesMemoire Exploitation Des Navires CiternesAchraf ChaoukiPas encore d'évaluation
- Equilibres Solide Liquide PDFDocument5 pagesEquilibres Solide Liquide PDFWael ZidPas encore d'évaluation
- Chap 4 Diagramme de Phase Et Diagramme Fer Carbone 2016Document14 pagesChap 4 Diagramme de Phase Et Diagramme Fer Carbone 2016Fernando kipaykoPas encore d'évaluation
- Mines Et Pont 99Document6 pagesMines Et Pont 99Anonymous XNijip100% (2)
- Chap3 - Thermodynamique AppliquéeDocument23 pagesChap3 - Thermodynamique AppliquéeHamza HachimPas encore d'évaluation
- Wa0001.Document7 pagesWa0001.jzpbdmm6ncPas encore d'évaluation
- Syst Bin AiresDocument21 pagesSyst Bin AiresChristy KlPas encore d'évaluation
- Chapitre 2 - 2Document13 pagesChapitre 2 - 2Mimou DriouchePas encore d'évaluation
- Poly 13x14 BinairesDocument33 pagesPoly 13x14 BinairesMohammed Az-GOUNDERPas encore d'évaluation
- Partie 3 - Le Magmatisme PDFDocument105 pagesPartie 3 - Le Magmatisme PDFSicke LunkomoPas encore d'évaluation
- Iapo Magmatisme2 Reduit PDFDocument92 pagesIapo Magmatisme2 Reduit PDFSicke LunkomoPas encore d'évaluation
- Chapitre 5 Diagramme de Phases de Corps Purs-1Document10 pagesChapitre 5 Diagramme de Phases de Corps Purs-1Rayen Jlassi100% (1)
- ulaSnZ-thermodynamique Chapitre3Document15 pagesulaSnZ-thermodynamique Chapitre3souilia690Pas encore d'évaluation
- Diagrammes - Solide - Liquide (Chimie)Document8 pagesDiagrammes - Solide - Liquide (Chimie)Chedly TrimechPas encore d'évaluation
- Chapitre IV Diagramme Des Phases A L'EquilibreDocument25 pagesChapitre IV Diagramme Des Phases A L'EquilibreMaha SsinePas encore d'évaluation
- Chapitre 2 Diagrammes EquilibreDocument10 pagesChapitre 2 Diagrammes EquilibreBahazPas encore d'évaluation