Académique Documents
Professionnel Documents
Culture Documents
Untitled 1EE TP Desciptive Meknes
Transféré par
choaib.nouhyTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Untitled 1EE TP Desciptive Meknes
Transféré par
choaib.nouhyDroits d'auteur :
Formats disponibles
TRAVAUX PRATIQUE DE CHIMIE
DE COORDINATION ET DESCRIPTIVE
DES ELEMENTS DE TRANSITION
Filiére : SMC/S6
Groupe : G3
Responsable : Pr.A.BENTAYEB
Réallisé par :
♦ Nouhy Choaib
♦ Laghrissi Ayoub
Année Universaitre : 2021/2022
Manipulation N°1: LE CUIVRE
I. PARTIE THEORIQUE :
1. Etude bibliographique :
● Généralité:
Le cuivre est un élément chimique de symbole Cu et numéro atomique
Z=29. C’est élement du 11 groupe , de 4 période , et appartient au bloc d donc
c’est un métal de transition .
Dans le tableau périodique des éléments , le cuivre est de meme famille
que l’argent et l’or , parce que chacun possède une orbitale s’occupée par un
seul électron sur des sous-couches p et d totalement remplies ,ce qui permet la
formation de liaisons métalliques ( configuration électronique [Ar] 3d 10 4s 1 ).
Le cuivre pur est un des seul métaux colorés il présente sur ses surfaces
fraiches une teinte rose saumon et est aussi appelé le “ métal rouge ” .On le
nommé des fois le cuivre rouge par opposition aux laitons.
Dans la nature le métal rouge est présent dans le croùte terrestre on le utilisé
souvent sous forme de métal (il est essentiel dans notre vie ) .
Le métal de couleur rouge ou orangé ,le cuivre est ductile et malléable . Il
possède une très grande conductivité électrique et présente une certaine
résistance à l corrosion . Et aussi présente aussi des propriétés antisalissure.
Les plus important poriété du cuivre:
Nom Cuivre
Symbole Cu
Numéro atomique 29
Groupe 11
Période 4éme périod
Bloc Bloc d
Famille d’élements Métal de transiton
Configuration éléctronique [Ar] 3d11 4s1
État d’oxydation 1 et 2
Masse atomique 63,546 ± 0,003 u
Rayon atomique (calc) 135 pm (145 pm)
Électonégativité 1,9
Parmi les utilisation du cuivre :
► La bonne conductivité électrique et thermique du cuivre (la meilleure
parmi les métaux non précieuc) en fait un matériau de choix en télécommunica
-tion ,dans le batiment les transports ou encore le domaine de l’énergie. Les
circuits intégrés et les circuits imprimés possédent de plus de cuivre .On utilise
aussi le cuivre dans les tubes à vide est les guides l’ onde .
►En architecture , le cuivre pent servir comme matériau de couvrture étanche ,
sur les toits par exemple . Dans les alliage avec le Nickel , le cuivre est
employé construction navale pour sa tenue à la corrosion .
● Minerais de cuivre:
Le cuivre est élément parfois abondant en certains sites miniers .Le clarke
s’élève à 55 à 70 g par tonne .
Le cuiver est un des rares métaux qui existent à l’état natif sous des cristaux de
maille cubique . Les cristaux bien formés sont rares , mais souvent des fils
dentritique , des assemblages de feuilles ou des recouvrements d’imprégnation
plus ou mois massifs peuvent etre communs dans les rares sites , où il peut etre
observé . Là les hommes du Néolithique avait accès à ce matériau facile à
mettre en forme, en le martelant légèrement, le cuivre natif est cependant assez
faible.
Cristaux d’azurite et de malachite sur cuivre natif.
L’élément cuivre, du fait de son caractère chalcophile ou son attirance pour
l’élément soufre S , aparait le plus fréquemment sous forme de sulfure ou sulfo-
sel . Onle trouvait en quantités importantes dans l’ile aux mille mines [16] . Les
minéraux sulfures comme la chalcopyrite (CuFeS 2 ),bornite (Cu 5 FeS 4 ),
cubnite (CuFe 2 S 3 ) et surtout la covelline (CuS) et la chalcosine (Cu 2 S) sont
des sourceintéressantes de cuivre , de meme que ses carbonates : azurite
(Cu 3 (CO 3 ) 2 (OH) 2 ) et malafchite (Cu 2 CO 3 (OH) 2 ) et un de ses oxydes :
cuprite (Cu 2 O)[17] .Les minéraux contenant l’élément cuivre ont souvent un bel
aspect coloré , à l’instar de la pierre d’Eilat.
Cristaux d’azurite et de malachite cuivre natif .
● L’extraction du cuivre :
Le cuivre n’est présent dans l’écorce terrestre qu’à la concentration moyenne
de 55 parties par million . Il n’existe plus dans la nature à l’état natif , comme
dans l’ antiquité . Il se présente sous forme de sels contenant 30 à 90 % de
cuivre, eux-meme mélangés aux stériles et quelquefois à d’autrses métaux,dont
certains peuvent etre plus rares que le cuivre , comme l’or et l’argent .un
minerai est considéré comme riche à partir de 1,8 % de cuivre pur .Selon la
forme des gisement et leur profondeur , il existe 2 types d’exploitation :
♣ Les mines à ciel ouvert
♣ Les minse souterraines
L’exploitation à ciel ouvert a lieu lorsque les gisements sont relativement
proches de la surface du sol, de façon à ce que les travaux d’excavation et de
terrassement puissent se faire dans des condition économiquement rentables.
A titre d’exemple , dans la mine à ciel ouvert de Chuquicamata au Chili, le
rapport déchets-minerais est de 3 à 1 .
Lorsque le pourcentage de déchets est trop élévé ou lorsque la typologie du
terrain ou les conditins climatiques sont défavorables , il devint opportun de
creuser des mines souterraines .
A la surface du globale , les minerais de cuivre se présentent généralement
sous 2 formes :
♣ Les minerais sulfurés .
♣ Les minerais oxydés .
Cette différenciation définit le processus à suivre pour l’obtention du cuivre
pur : pyrométallurgie pour les minerais sulfurés , hydrométallurgie pour les
minerais oxydés .
Les minerais sulfurés ont une origine géologique profonde et proviennent de
la cristallisation à l’abri de l’air de composés sulfurés de cuivre et d’autres
métaux. Ils sont souvent appelés minerais primares .
Les minerais sulfurés sont les plus répandus et représentent plus de 80 % de
la production mondiale .Ce minerais sont très nombreux . Les espèces
minéralogique les plus courantes sont :
♣ la chalchopyrite CuFeS2 .
♣ la chalchosine Cu2S .
♣ la covelline CuS .
♣ la bornite Cu5FeS4 .
♣ l’énargite Cu3AsS4 .
Ce différents minerais se trouvent assez souvent mélangés et leurs teneurs
moyennes en cuivre varient généralement de 0,7 à 2 % . Les minerais oxydés
sont des carbonates complexes ayant subi une oxydation par l’eau et l’air au
cours des ages .
♣ malachite Cu2CO3(OH)2 .
♣ cuprite Cu2O .
♣ azurite Cu3(CO3)2(OH)2 .
♣ dioptase CuO3H2O .
dent les teneurs sont d’environ 1 à 2 %.
Il faut mentionner pour mémoire que les nodules polymétalliques présents sur
les fonds de certaine océans contiennent du cuivre à coté de nickel, cobalt, et
manganése . Mais de difficile problémes juridique et techniques sont encore à
résoudre avant de pouvoir les exploiter.
● Affinage du cuivre .
Le blistre doit etre affiné pour obtenir la pureté nominale de 99,90 %
utilisable dans la plupart des applications .Il existe deux procédés d’affinage :
1°-L’affinage thermique :
Qui consiste à refondre le blister en l’oxydant pour éliminer les impuretés
sous forme d’oxyde qui se volatilisent.
Au cours de ce traitement , le cuivre se charge de 0,6 à 0,9 % d’oxygéne dont
il faut éliminer l’essentiel par une opération de perchage, qui consiste à
introduire des troncs de bois vert dans le bain de cuivre . On obtient alors un
cuivre de qualité thermique, qui contient encore de 0,02 à 0,04 % d’oxygéne et
un peu d’hydrogéne , et qui, de ce fait , n’a que peu d’applications dans
l’industrie .
2°-L’affinage électrolytique :
Qui transforme le blister, préalablement coulé sous forme d’anode, en
cathode par le procédé de l’anode soluble.
Le cuivre obtenu est pur mais il n’est pas encore utilisable en état à cause
de sa porosité et de la présence possible d’inclusions d’électrolyte.
Pour avoir à la fois lecuivre pur à 99,90 % ou davantage et les meilleures
caractéristiques de plasticité, on refond ultérieurement les cathodes suivent
plusieurs procédés ,qui permettent d’obtenir les différentes qualités de cuivre
utilisées dans l’industrie et qui correspondent aux diveres catégorie
d’applications.
On distingue ainsi les trois principales catégories de cuivre suiventes :
► Le cuivre Cu-a l (Cu-ETP, CW004A,CR004A) qui contient de oxygéne, est
caractérisé par sa haute conductibilité électrique, mais se pretr mal au soudage à
température supérieure à couse de sa sensibilité aux atmosphéres réductrices
(hydrogéne).
► Le cuivre Cu-b1 (Cu-DHP,CW024A,CR024A), désoxydé au phosphore, à
conductibilité électrique réduite, est particuliérement apte aux déformations et
au soudage .
► Le cuivre Cu-c1 (Cu-OF,CW008A,CR008A), exemple d’oxygéne, réunit les
avantages desdeux catégories précédentes.Il correspond à des application
particulières.
2. But de la manipulation :
L’objectif de cette manipulation est la formation de CuSO 4 a partie d’une
série du réaction (Cu a l’état d’oxydation +2) dans la premier partie ; dans la
deuxéme partie on va former le cuivre a l’étate d’oxydation 0 c’est ta dire a
l’état métallique et a l’état d’oxydation +1.
3. Qelques réaiction avec le cuivre .
Vous aimerez peut-être aussi
- Technologie de l’acier: Les Grands Articles d'UniversalisD'EverandTechnologie de l’acier: Les Grands Articles d'UniversalisPas encore d'évaluation
- Les MateriauxDocument13 pagesLes Materiauxbhsbhs19Pas encore d'évaluation
- Cours Metallurgie & SoudageDocument89 pagesCours Metallurgie & Soudageرضا بن عمارPas encore d'évaluation
- Diamants (Paris - 2001): Les Fiches Exposition d'UniversalisD'EverandDiamants (Paris - 2001): Les Fiches Exposition d'UniversalisPas encore d'évaluation
- TP - L'hydrométallurgie Du Zinc - GUERFI SABRINEDocument18 pagesTP - L'hydrométallurgie Du Zinc - GUERFI SABRINEرحمـة ربيعـي100% (1)
- Élaboration Des MetauxDocument23 pagesÉlaboration Des MetauxdayangPas encore d'évaluation
- Lecons de ChosesDocument148 pagesLecons de ChosesAndrei PoseaPas encore d'évaluation
- Les Metaux Non FerreuxDocument22 pagesLes Metaux Non Ferreuxhalima halimaPas encore d'évaluation
- PyrometallurgieDocument6 pagesPyrometallurgieMag ManPas encore d'évaluation
- Cuivre TPDocument12 pagesCuivre TPmohmed50% (2)
- TP N°18.1 - Corrosion Et Protection Du FerDocument14 pagesTP N°18.1 - Corrosion Et Protection Du FerWael MaatougPas encore d'évaluation
- ZincDocument17 pagesZincmohamedouffaPas encore d'évaluation
- Mémoire de Traduction: La Technique Du Plique À Jour en BijouterieDocument92 pagesMémoire de Traduction: La Technique Du Plique À Jour en BijouterieCharlotte Connan de VriesPas encore d'évaluation
- Le Fer PDFDocument12 pagesLe Fer PDFLkl Hadjer100% (1)
- 221.01 - Cours-Corrosion Et Protection (T3) PDFDocument6 pages221.01 - Cours-Corrosion Et Protection (T3) PDFfarouk1120Pas encore d'évaluation
- Web CorrosionDocument69 pagesWeb CorrosionNada AzerPas encore d'évaluation
- Presentation MateriauxDocument27 pagesPresentation MateriauxBARNABAS KOUASSIPas encore d'évaluation
- Toxicologie Du Cuivre FINALDocument24 pagesToxicologie Du Cuivre FINALYoucef100% (1)
- CuivreDocument13 pagesCuivrezakiazakiaPas encore d'évaluation
- Métallurgie Du Cuivre1Document14 pagesMétallurgie Du Cuivre1salif mbengue dioufPas encore d'évaluation
- Metallurgie Du CuivreDocument9 pagesMetallurgie Du Cuivrekobbiyoussef49Pas encore d'évaluation
- Le Cuivre Et Ses AlliagesDocument6 pagesLe Cuivre Et Ses AlliagesElfadil ElharrakPas encore d'évaluation
- Métallurgie Du CuivreDocument23 pagesMétallurgie Du Cuivresalif mbengue dioufPas encore d'évaluation
- MMP G3 2020Document67 pagesMMP G3 2020CharlesPas encore d'évaluation
- Cours de Chimie Inorganique BAC 1 (Chap 8 Et 9)Document44 pagesCours de Chimie Inorganique BAC 1 (Chap 8 Et 9)Baraka Makan100% (1)
- Cours Corr 17 P1Document26 pagesCours Corr 17 P1tristan.baudlotPas encore d'évaluation
- Travail Pratique Du Groupe 1 ELABORATION DES METAUXDocument17 pagesTravail Pratique Du Groupe 1 ELABORATION DES METAUXdominique ayamedaPas encore d'évaluation
- Travail Pratique Du Groupe 1 ELABORATION DES METAUXDocument17 pagesTravail Pratique Du Groupe 1 ELABORATION DES METAUXdominique ayameda100% (1)
- 13-BUP PassivationDocument16 pages13-BUP PassivationinsfpiaablidaPas encore d'évaluation
- Questions:: Nom:Ouali BRENOM:abdelhalimDocument12 pagesQuestions:: Nom:Ouali BRENOM:abdelhalimHalim OualiPas encore d'évaluation
- Les Métaux Non FerreuxDocument33 pagesLes Métaux Non Ferreuxالكرة العصريةPas encore d'évaluation
- CuivreDocument11 pagesCuivreSayf BouyeddaPas encore d'évaluation
- Sc4 TP4 Corrosion Et Protection Contre La CorrosionDocument3 pagesSc4 TP4 Corrosion Et Protection Contre La CorrosionAbde TamPas encore d'évaluation
- Tpe bch431 TOXICOLOGIEDocument12 pagesTpe bch431 TOXICOLOGIEissaalimahamat1998Pas encore d'évaluation
- Preparation Metallographique Du Cuivre Et Des Alliages APN 12 CopperDocument6 pagesPreparation Metallographique Du Cuivre Et Des Alliages APN 12 CopperAcharf GassemPas encore d'évaluation
- Introduction À La Science Des Matériaux - Les Métaux Et Alliages Non Ferreux - WikiversitéDocument8 pagesIntroduction À La Science Des Matériaux - Les Métaux Et Alliages Non Ferreux - WikiversitéLaurent MorgePas encore d'évaluation
- TSEI 1 Matériaux Et ComposantsDocument97 pagesTSEI 1 Matériaux Et Composantscheikhou oumar BaldePas encore d'évaluation
- Exposé TOXICODocument20 pagesExposé TOXICOwiamchekattPas encore d'évaluation
- h7g6 - Cuivre Alliages CuivreDocument8 pagesh7g6 - Cuivre Alliages CuivremauricePas encore d'évaluation
- Chapitre 7Document18 pagesChapitre 7nassima chenikhaPas encore d'évaluation
- Les MetauxDocument28 pagesLes MetauxElla Elycia IrumvaPas encore d'évaluation
- Cours RedoxDocument19 pagesCours RedoxSam DallaliPas encore d'évaluation
- OxygèneDocument6 pagesOxygènesandraPas encore d'évaluation
- 15 Essentiel Cycle de Vie MateriauxDocument2 pages15 Essentiel Cycle de Vie Materiauxfranck adouPas encore d'évaluation
- Les Réactions de La LixiviationDocument11 pagesLes Réactions de La LixiviationCharles Walter100% (1)
- Alcalins TerreuxDocument29 pagesAlcalins TerreuxZakia Medad100% (1)
- Métallurgie Du NickelDocument7 pagesMétallurgie Du NickelJosiasPas encore d'évaluation
- Examen de CorrosionDocument4 pagesExamen de CorrosionBichou Derres100% (2)
- T 3 CorrosionDocument7 pagesT 3 Corrosioncelia bgrnPas encore d'évaluation
- Activité Corrosion 1ère STI2DDocument4 pagesActivité Corrosion 1ère STI2DELACHE31Pas encore d'évaluation
- Spe-3 1 1 CorrosionDocument3 pagesSpe-3 1 1 CorrosionPaul DayangPas encore d'évaluation
- CuivreDocument2 pagesCuivreIbtissam MalekPas encore d'évaluation
- DS2 Spécialité TS Exercice-1: Corrosion Et Protection Des MétauxDocument5 pagesDS2 Spécialité TS Exercice-1: Corrosion Et Protection Des MétauxManal StudiesPas encore d'évaluation
- Copper IS FR-high ResDocument24 pagesCopper IS FR-high ResMeryem Lamri ZeggarPas encore d'évaluation
- L'Or - Cyanuration: Dissolution de L'or Par L'eau ?: Table Des MatièresDocument4 pagesL'Or - Cyanuration: Dissolution de L'or Par L'eau ?: Table Des MatièresZoubir BRAHAMIPas encore d'évaluation
- LES AMALGAMES DENTAIRES ÉtudiantsDocument16 pagesLES AMALGAMES DENTAIRES ÉtudiantsHaniDjekrifPas encore d'évaluation
- Edition WEB: Le Nickel: Presqu'île de Kola Et Nouvelle-Calédonie Nicole SantarelliDocument23 pagesEdition WEB: Le Nickel: Presqu'île de Kola Et Nouvelle-Calédonie Nicole SantarellitohouriPas encore d'évaluation
- TPcorrosionDocument16 pagesTPcorrosionMehdi Bekhechi100% (1)
- E Chpsi2023Document5 pagesE Chpsi2023Moad BarbariPas encore d'évaluation
- CDM11 - Les Métaux Non-Ferreux - 1BADocument6 pagesCDM11 - Les Métaux Non-Ferreux - 1BAniconeusyPas encore d'évaluation
- Metallurgie - Du - Cuivre ChristianDocument11 pagesMetallurgie - Du - Cuivre ChristianErrel AlfPas encore d'évaluation
- Chimie Systématique Des PDFDocument35 pagesChimie Systématique Des PDFTaouil MohamedPas encore d'évaluation
- 2017 NR CRCDocument3 pages2017 NR CRCdouchnaima09Pas encore d'évaluation
- Annexe 2b Regles Dingenierie Appuis Aeriens 087575900 1528 06092018Document24 pagesAnnexe 2b Regles Dingenierie Appuis Aeriens 087575900 1528 06092018zhiro sahibPas encore d'évaluation
- N 3-Dosage Du Cuivre Dans Le LaitonDocument1 pageN 3-Dosage Du Cuivre Dans Le LaitonMehdi LAHCENEPas encore d'évaluation
- Memoire11 PDFDocument73 pagesMemoire11 PDFAfaf FafaPas encore d'évaluation
- A3M Plaquette Industrie MinièreDocument17 pagesA3M Plaquette Industrie MinièreFranck Carls100% (1)
- 2nd TP1 Identification Des GazDocument3 pages2nd TP1 Identification Des Gazphysiquechimie.mmewerquinPas encore d'évaluation
- ARGILE BENTONITE - Fiche Technique - 00468 PDFDocument5 pagesARGILE BENTONITE - Fiche Technique - 00468 PDFIsaac NgoiePas encore d'évaluation
- Raissouni Et Al - Evaluation de La Pollution Métallique Dans Les Principaux Cours D'eau Débouchant Dans La Méditerranée Occidentale. Mobilité Et Impact Des Activités Anthropiques PDFDocument6 pagesRaissouni Et Al - Evaluation de La Pollution Métallique Dans Les Principaux Cours D'eau Débouchant Dans La Méditerranée Occidentale. Mobilité Et Impact Des Activités Anthropiques PDFAhmed RaissouniPas encore d'évaluation
- PlomberieDocument7 pagesPlomberieMoustapha SallPas encore d'évaluation
- Cours Djema - OK Dif - Equipement Des Units Pétrochimiques0001Document24 pagesCours Djema - OK Dif - Equipement Des Units Pétrochimiques0001saa naaPas encore d'évaluation
- Deformulation D Une Peinture AntifoulingDocument1 pageDeformulation D Une Peinture AntifoulingsiaPas encore d'évaluation
- MM 200801 Rap 001Document673 pagesMM 200801 Rap 001Alioune Badara MbodjPas encore d'évaluation
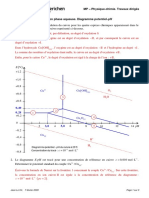
- TD25 Diagramme Potentiel-pH Du Cuivre CorrigeDocument3 pagesTD25 Diagramme Potentiel-pH Du Cuivre Corrigesarah jiji100% (2)
- Vicia Faba (La Féve)Document85 pagesVicia Faba (La Féve)Martine FatouPas encore d'évaluation
- 5-Masse Corrosion (Provisoire)Document67 pages5-Masse Corrosion (Provisoire)dimachampion100% (1)
- Oxydoréduction PDFDocument5 pagesOxydoréduction PDFGaniyou AdenidjiPas encore d'évaluation
- Les Eaux Industrielles: 3.1. Utilisations de L'Eau Et Qualités RecherchéesDocument29 pagesLes Eaux Industrielles: 3.1. Utilisations de L'Eau Et Qualités RecherchéesabdelbarrPas encore d'évaluation
- 1-ALIMENTATION - MINERALE Pour ChevreDocument6 pages1-ALIMENTATION - MINERALE Pour ChevredebourouPas encore d'évaluation
- TP3 Prospection Spacialisation de Données D'analyse GeochimiqueeDocument14 pagesTP3 Prospection Spacialisation de Données D'analyse GeochimiqueeCherif Kante100% (1)
- Cours - Chimie Test D'identification - 2ème Sciences (2014-2015) MR Mekni NejibDocument2 pagesCours - Chimie Test D'identification - 2ème Sciences (2014-2015) MR Mekni NejibMouhamed Ali SahbaniPas encore d'évaluation
- Chim Sol ArialDocument35 pagesChim Sol Arialسمير دبيليPas encore d'évaluation
- ZnDocument4 pagesZnisam-eddine.babouriPas encore d'évaluation
- Traitements de Surface Des Métaux1Document5 pagesTraitements de Surface Des Métaux1OualidPas encore d'évaluation
- Transformations Spontanees Dans Les Piles Et Production D Energie Activites 1Document1 pageTransformations Spontanees Dans Les Piles Et Production D Energie Activites 1tedjuniormomboPas encore d'évaluation
- Final PDFDocument28 pagesFinal PDFKhadija LakhdiriPas encore d'évaluation
- Un Dépôt Monétaire Du Milieu Du XIIIe Siècle À Gisors (F Dumas)Document23 pagesUn Dépôt Monétaire Du Milieu Du XIIIe Siècle À Gisors (F Dumas)Christophe BAUGERPas encore d'évaluation
- Correction Epreuve de Chimie Des Electrolytes 2014 2015 2Document5 pagesCorrection Epreuve de Chimie Des Electrolytes 2014 2015 2Chimiste ChimistePas encore d'évaluation
- M1295 PDFDocument20 pagesM1295 PDFMohamedPas encore d'évaluation