Académique Documents
Professionnel Documents
Culture Documents
Chapitre II. Mécanismes Réactionnels - PARTIE II
Transféré par
Wissal Mel MelTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Chapitre II. Mécanismes Réactionnels - PARTIE II
Transféré par
Wissal Mel MelDroits d'auteur :
Formats disponibles
Chapitre II.
Mécanismes réactionnels
II.7. Mécanismes de quelques réactions complexes
On distingue deux grandes classes de réactions complexes :
1-Réactions en chaîne ou réactions à séquence fermée.
Réactions en chaîne linéaires
Réactions en chaîne ramifiée
2-Réactions par stade ou réactions à séquence ouverte.
Remarque :
Energie d’activation et mécanisme réactionnel
Chaque mécanisme correspond à une vitesse (la vitesse de l’étape cinétiquement
limitante) et comme chaque vitesse est reliée à Ea donc chaque mécanisme est relié à Ea.
Ea est faible → Mécanisme est facile
Soit le mécanisme réactionnel suivant :
A → A1…….…………………………….Ea1
A1 → A2…………………………………Ea2
A2 → B ………………………………….Ea3
A → B …………….……………………...Ea
A1 et A2 sont des intermédiaires,
Et : état transitoire (voir schéma suivant).
Dans la pratique on cherche à minimiser Ea.
Energie
Ea1 >Ea2 et Ea1 >Ea3 : la première étape est la plus lente.
Ea (mécanisme réactionnel) = Ea1
Pr GHIABA ZINEB Page 1
Chapitre II. Mécanismes réactionnels
II.7.1. Les réactions en chaîne
Lorsqu’un produit intermédiaire se trouve régénéré (renouvelé) au cours d’une étape,
après l’étape de sa première formation et qu’il peut à nouveau réagir, il s’établit une suite de
réactions cycliques ou à séquence fermée.
Exemple :
Ce mécanisme en chaîne se rencontre dans les groupes de réactions suivantes :
-Réactions d’oxydation.
-Réactions de combustion.
-Réaction de décomposition thermique.
-Réaction de polymérisation.
-Réactions photochimiques.
Elles mettent en jeu des espèces radicalaires et se déroulent selon un mécanisme
II.7.1.1. Mécanisme d’une réaction en chaîne
L’espèce radicalaire est engendrée par une étape d’initiation, la réaction se poursuit par une
étape de propagation et se termine par une étape de rupture ou de terminaison.
A) Etape d’initiation :
C’est l’étape qui permet la formation d’un centre actif. C’est la réaction par laquelle se
forment les radicaux libres à partir des réactifs de départ. Ce centre peut être obtenu par les
voies suivantes :
Pr GHIABA ZINEB Page 2
Chapitre II. Mécanismes réactionnels
Effet thermique : Il s’agit de fournir suffisamment d’énergie vibratoire (la chaleur)
pour que la liaison se casse.
A-B → A● + B●, ou bien M → R●1 + R●2
Dans ce cas, l’énergie d’activation du processus est voisine de l’énergie de dissociation de la
liaison rompue.
Photochimique : La dissociation de la liaison est obtenue grâce à l’utilisation d’une
radiation.
AB + hν→ A● + B●
Emploi d’un inducteur : Un inducteur est une substance très réactive qui se
décompose facilement en donnant des espèces libres. Et la décomposition de
l’inducteur entraîne la réaction entre les réactifs. Ces substances peu stables très
utilisées sont :
Les peroxydes : substances refermant un pont oxygéné –O-O- (exemple :
(CH3)3-C-OO-C-(CH3)3
Les azoîques : substances renfermant un pont azoté –N=N- (exemple : N≡C-C(CH3)2-
N=N-(CH3)2-C≡N.
B) Etape de propagation de chaîne:
Au cours de cette étape se forment les produits principaux de la réaction selon le
processus suivant :
Le premier centre actif engendre un autre centre actif qui à son tour réagit pour donner un
autre centre actif jusqu’à ce que un des centre soit régénéré ; On a ainsi un cycle.
Le processus de propagation est schématisé comme suit
Les produits qui se forment au cours d la propagation constituent les produits principaux de la
réaction.
C) Etape de transfert (Processus de transfert) :
Pr GHIABA ZINEB Page 3
Chapitre II. Mécanismes réactionnels
Lorsque le radical produit par l’étape d’initiation n’intervient pas dans la propagation,
il existe une étape qui transforme ce radical non porteur de chaîne en radical porteur de
chaîne. Les produits qui se transforment au cours de cette étape constituent les produits
mineurs de la réaction (produits secondaires).
D) Etape de terminaison (Rupture de chaîne) :
Cette étape rassemble les réactions entre espèces radicalaires avec une énergie
d’activation Ea proche de zéro. Ces réactions se produisent au hasard des rencontres dans le
milieu réactionnel et arrêtent la propagation.
R●1 + R● → M
R●2 + R●3 → N
Quelques exemples :
La rupture peut être causée par l’intermédiaire d’un radical avec la paroi du réacteur, ou avec
un inhibiteur.
Exemple 1 : Réactions complexe en chaîne sans étape de transfert
Pr GHIABA ZINEB Page 4
Chapitre II. Mécanismes réactionnels
Exemple 2 : Réactions complexe en chaîne avec étape de transfert
II.7.1.2. Cinétique d’une réaction en chaîne linéaires (Droite)
II.7.1.2.1. Application de l’Etat Quasi-Stationnaire (A.E.Q.S)
Nous allons étudier la cinétique de l’exemple précédent (exemple 1):
Pr GHIABA ZINEB Page 5
Chapitre II. Mécanismes réactionnels
Nous allons étudier la cinétique de l’exemple précédent (exemple 2):
II.7.1.2.2. Calcul des vitesses de consommation des réactifs et de formation des produits
Pr GHIABA ZINEB Page 6
Chapitre II. Mécanismes réactionnels
Remarques :
La vitesse finale ne doit pas être en fonction des radicaux. On peut même calculer la
vitesse
de formation des produits secondaires.
On peut même calculer la vitesse de formation des produits secondaires :
On Remarque que l’on parle plus de vitesse de réaction globale, mais seulement de
vitesse des réactifs et d’apparition des produits.
II.7.1.2.3. Longueur de la chaîne
La longueur de chaîne (λ) correspond au nombre de maillons (cycles) qui peut effectuer en
moyenne un centre actif à partir de sa formation avant de disparaître.
II.7.1.2. Réactions en chaîne ramifiée
Lorsqu’un centre actif donne naissance à plusieurs autres centres actifs, la réaction
atteint un développement auto accéléré qui peut la rendre explosive. La multiplication des
centres actifs empêchent l’établissement d’un régime stationnaire.
Le mécanisme semble être :
Pr GHIABA ZINEB Page 7
Chapitre II. Mécanismes réactionnels
II.7.2. Réactions par stade (à séquence ouverte)
Leurs mécanismes fait également intervenir des espèces radicalaires actives.
Cependant un centre actif consommé n’est pas régénéré.
Les réactions de substitution se déroulent selon un mécanisme par stade : RX+ Y ⇌ RY + X
L’agent substituant Y peut être initialement libre mais il peut appartenir à une espèce
chimique « AY ». La réaction de substitution s’effectue selon deux processus simples :
II.7.2.1 Mécanisme S1
Pr GHIABA ZINEB Page 8
Chapitre II. Mécanismes réactionnels
II.7.2.2. Mécanisme S2
Pr GHIABA ZINEB Page 9
Chapitre II. Mécanismes réactionnels
Exemple :
Pr GHIABA ZINEB Page 10
Chapitre II. Mécanismes réactionnels
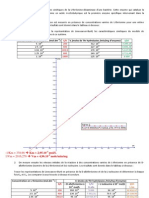
Décomposition du pentoxyde d’azote N2O5(g )
N2O5(g ) en phase gazeuse ou en solution dans le CCl4(l ) se décompose suivant une loi
cinétique de premier ordre dans un grand domaine de T (273 à 423 K) et de P (5.10-5 à 1 bar)
avec une constante de vitesse k0 telle que :
Pr GHIABA ZINEB Page 11
Vous aimerez peut-être aussi
- Cours de Reacteurs ChimiquesDocument171 pagesCours de Reacteurs ChimiquesYoussef Jrifi100% (1)
- Lhomme Qui Parle Avec Les Plantes by Yvo Pérez Barreto PDFDocument278 pagesLhomme Qui Parle Avec Les Plantes by Yvo Pérez Barreto PDFJonathan SinclairPas encore d'évaluation
- TSTL - Bioch.Cours .Chap.2.Enzymologie - Correction Exercice.7Document3 pagesTSTL - Bioch.Cours .Chap.2.Enzymologie - Correction Exercice.7Chris Zericho0% (3)
- Chapitre II. Mécanismes Réactionnels - PARTIE IDocument8 pagesChapitre II. Mécanismes Réactionnels - PARTIE IJojo BoubPas encore d'évaluation
- Partie 2 MécanismesDocument9 pagesPartie 2 MécanismesAmina BadaouiPas encore d'évaluation
- Mecanisme ReactionnelDocument18 pagesMecanisme ReactionnelTomin Paterne BambaPas encore d'évaluation
- CH10 Évolution Temporelle D'un SystèmeDocument5 pagesCH10 Évolution Temporelle D'un SystèmeYasminaPas encore d'évaluation
- Chapitre VI - Réactions Complexes Et Mécanismes Réactionnels - OdpDocument20 pagesChapitre VI - Réactions Complexes Et Mécanismes Réactionnels - OdpOthMane TaPas encore d'évaluation
- Cinétique 2Document13 pagesCinétique 2Mustapha ZouantiPas encore d'évaluation
- Chap 01-Cinétique-Durée-RéactionDocument5 pagesChap 01-Cinétique-Durée-Réactionmube 75Pas encore d'évaluation
- CHAPITRE II Les Réacteurs IdéauxDocument3 pagesCHAPITRE II Les Réacteurs Idéauxpc ghomriPas encore d'évaluation
- Cours Cinétique SabeurDocument4 pagesCours Cinétique SabeurSabeur Khemakhem100% (1)
- Phot Cata Chapitre IDocument11 pagesPhot Cata Chapitre IHk EhPas encore d'évaluation
- Chapitre - III (2) - Adsoption - Catalyse CINèTIQUE Joseph GoodDocument14 pagesChapitre - III (2) - Adsoption - Catalyse CINèTIQUE Joseph GoodYoussef JayedPas encore d'évaluation
- 40-103 Vitesse RéactionDocument14 pages40-103 Vitesse RéactionKhalil LasferPas encore d'évaluation
- Cinétique en Catalyse HétérogèneDocument72 pagesCinétique en Catalyse Hétérogènesabrina miloudi100% (1)
- Cours CinetiqueDocument12 pagesCours CinetiqueArthur TigreatPas encore d'évaluation
- Reacteurs Chapitre-2Document8 pagesReacteurs Chapitre-2raouf raoufPas encore d'évaluation
- Chapitre II BM GHODBANEDocument19 pagesChapitre II BM GHODBANESennaoui LaraPas encore d'évaluation
- Chapitre I Généralité Sur La CatalyseDocument22 pagesChapitre I Généralité Sur La CatalyseAya HassaniPas encore d'évaluation
- Cours Catalyse Cinétique en Catalyse Hétérogène A. BENAMARDocument53 pagesCours Catalyse Cinétique en Catalyse Hétérogène A. BENAMARLi NaPas encore d'évaluation
- PolymeresDocument48 pagesPolymeresImedooImedPas encore d'évaluation
- M1 Polymeres-Cours3Document38 pagesM1 Polymeres-Cours3Mengade Ossama100% (1)
- Chimie Organique Pcsi - Partie2Document52 pagesChimie Organique Pcsi - Partie2the knowledge is powerPas encore d'évaluation
- Catalyse Partie1 2022Document84 pagesCatalyse Partie1 2022Mira MslPas encore d'évaluation
- Chapitre 3Document9 pagesChapitre 3pc takouachetPas encore d'évaluation
- Catalyse L3Document85 pagesCatalyse L3Wassi La100% (1)
- 2 CatalysesRappelsDocument86 pages2 CatalysesRappelsFATIHA EL FARGANYPas encore d'évaluation
- Reacteurs. Polyphasiques-GC-Chap1 PDFDocument24 pagesReacteurs. Polyphasiques-GC-Chap1 PDFMajda100% (2)
- C08 COURS Transformations en Chimie OrganiqueDocument13 pagesC08 COURS Transformations en Chimie OrganiquesalamPas encore d'évaluation
- Ch3 Cinetique Et Catalyse ElDocument6 pagesCh3 Cinetique Et Catalyse ElNlem NdongoPas encore d'évaluation
- Vanhaverbeke Cecile p02 PDFDocument33 pagesVanhaverbeke Cecile p02 PDFMourad Makhlouf100% (1)
- Cours Catalyse Heterogene 2020 DaloaDocument42 pagesCours Catalyse Heterogene 2020 DaloaMohamed CoulibalyPas encore d'évaluation
- 1 Concepts CatalyseDocument15 pages1 Concepts CatalyseAbdullah MohamedPas encore d'évaluation
- Cinétique Chimique MPSI Et MPDocument23 pagesCinétique Chimique MPSI Et MPmomoadamso07Pas encore d'évaluation
- Cours 1ere SVV Chimi2-ConvertiDocument20 pagesCours 1ere SVV Chimi2-ConvertiChahd Ikhlas RstPas encore d'évaluation
- Suport Cours-Réacteurs Homogènes 2022Document30 pagesSuport Cours-Réacteurs Homogènes 2022Manel 123Pas encore d'évaluation
- Définition Et Mesure de La Vitesse D'une Réaction ChimieDocument16 pagesDéfinition Et Mesure de La Vitesse D'une Réaction ChimieKhadija BiallachPas encore d'évaluation
- La Cinétique ChimiqueDocument7 pagesLa Cinétique ChimiqueAS asPas encore d'évaluation
- 1 Cinétique ChimiqueDocument12 pages1 Cinétique ChimiqueYoucef KrPas encore d'évaluation
- II 04 CinetiqueDocument3 pagesII 04 CinetiqueMohamed ElouakilPas encore d'évaluation
- Cours M Canisme R Actionnels-1Document12 pagesCours M Canisme R Actionnels-1FZLPas encore d'évaluation
- CatalyseDocument9 pagesCatalyseChoaib NouhyPas encore d'évaluation
- Chapitre 9: Temps Et Évolution Chimique: 1) RappelsDocument11 pagesChapitre 9: Temps Et Évolution Chimique: 1) Rappelspapa samba sarrPas encore d'évaluation
- UAA6 - Cinétique Des RéactionsDocument14 pagesUAA6 - Cinétique Des RéactionsThomas CocoPas encore d'évaluation
- الامتحان الوطني في مادة الفيزياء والكيمياء 2016 علوم فيزيائية ترجمة فرنسية الدورة الاستدراكيةDocument13 pagesالامتحان الوطني في مادة الفيزياء والكيمياء 2016 علوم فيزيائية ترجمة فرنسية الدورة الاستدراكيةjouaitiPas encore d'évaluation
- Corrigé 6.3 ChimieDocument4 pagesCorrigé 6.3 ChimieMaeva SimPas encore d'évaluation
- Cour CinétiqueDocument83 pagesCour CinétiqueMathilde MonperrusPas encore d'évaluation
- Chapitre 1Document7 pagesChapitre 1مصطفى داودPas encore d'évaluation
- Avancement D Une Reaction ChimiqueDocument4 pagesAvancement D Une Reaction ChimiqueFitouri MoncefPas encore d'évaluation
- Hassbgli 927Document37 pagesHassbgli 927christina.tchissamboPas encore d'évaluation
- Examen National Physique Chimie SPC 2016 Rattrapage Sujet 3Document7 pagesExamen National Physique Chimie SPC 2016 Rattrapage Sujet 3Bouafia AhmedPas encore d'évaluation
- CHP 1 Catalyse MasterDocument11 pagesCHP 1 Catalyse MasterabdarxPas encore d'évaluation
- Extrait de Introduction À La Théorie Des Réacteurs Chimiques J.VillermauxDocument4 pagesExtrait de Introduction À La Théorie Des Réacteurs Chimiques J.VillermauxOussama amasouPas encore d'évaluation
- Cour cinétiqueIIDocument71 pagesCour cinétiqueIIMathilde MonperrusPas encore d'évaluation
- Partie 2 Chap 3 Et 4Document9 pagesPartie 2 Chap 3 Et 4incocc nnuuPas encore d'évaluation
- Chapitre IIDocument21 pagesChapitre IIياسمين لقرافPas encore d'évaluation
- Reaction Chimique Complet PDFDocument25 pagesReaction Chimique Complet PDFabderrahimn100% (1)
- Partie IIIDocument6 pagesPartie IIIHamza FerkousPas encore d'évaluation
- Cinetique Chapitre2Document26 pagesCinetique Chapitre2sii hemPas encore d'évaluation
- Simulation des vibrations mécaniques, 2e édition: par Matlab, Simulink et AnsysD'EverandSimulation des vibrations mécaniques, 2e édition: par Matlab, Simulink et AnsysPas encore d'évaluation
- Dégradation Photo Catalytique Des Colorants Dans Un Réacteur Semi Pilote À Lumière ArtificielleDocument21 pagesDégradation Photo Catalytique Des Colorants Dans Un Réacteur Semi Pilote À Lumière ArtificiellePFE M2Pas encore d'évaluation
- Physiologie Du Pancreas ExocrineDocument29 pagesPhysiologie Du Pancreas ExocrineDouniazed100% (2)
- Thème 2-1 de La Plante Sauvage À La Plante Domestiquée - ProgTspé SVTDocument5 pagesThème 2-1 de La Plante Sauvage À La Plante Domestiquée - ProgTspé SVTel.camelia94800Pas encore d'évaluation
- Chap1 PurinsDocument19 pagesChap1 Purinsapi-498872834100% (1)
- Sciences de La Matière Chimie: WWW - Fsac.ac - MaDocument1 pageSciences de La Matière Chimie: WWW - Fsac.ac - MaQPas encore d'évaluation
- Cours NomenclatureDocument14 pagesCours NomenclatureJean-François AbenaPas encore d'évaluation
- Les Fibres Textiles Et Leurs Origines - ComplémentDocument16 pagesLes Fibres Textiles Et Leurs Origines - ComplémentImani SouksouvanhPas encore d'évaluation
- La Panification Au Levain Natur - Philippe RousselDocument111 pagesLa Panification Au Levain Natur - Philippe RousselTrinidad Contreras100% (2)
- Fiches D'étalonnagesDocument5 pagesFiches D'étalonnagesBeatrice FlorinPas encore d'évaluation
- DiolsDocument9 pagesDiolsAhmad ElhamriPas encore d'évaluation
- Samedi, Le 18 Juin 2022 Faculte Des Sciences Biologie Physiologie Animal Departement de Biochimie Année-Scolaire: 2021-2022Document12 pagesSamedi, Le 18 Juin 2022 Faculte Des Sciences Biologie Physiologie Animal Departement de Biochimie Année-Scolaire: 2021-2022Kokou AliPas encore d'évaluation
- PL IndustrieDocument69 pagesPL Industriemjdavies21Pas encore d'évaluation
- Enzymologie PDFDocument28 pagesEnzymologie PDFTCHEMMIK NazihaPas encore d'évaluation
- Travaux Diriges de Biomasse EnergieDocument27 pagesTravaux Diriges de Biomasse Energiehamza kadim100% (1)
- Production de YaourtDocument10 pagesProduction de YaourtSayah Ben Dob70% (10)
- Mémoire Finale de Master de Savon À Base D'huile de Friture UsagéeDocument135 pagesMémoire Finale de Master de Savon À Base D'huile de Friture UsagéemsitankoPas encore d'évaluation
- TD 1 Les Mileux de CultureDocument35 pagesTD 1 Les Mileux de CultureÑã DåPas encore d'évaluation
- L3 Sol Et Eau Pédologie Générale Chap1à7Document34 pagesL3 Sol Et Eau Pédologie Générale Chap1à7abdoulkaderzabrePas encore d'évaluation
- Confiture 2 Processus de Gelification Des PectinesDocument15 pagesConfiture 2 Processus de Gelification Des PectinesChristopheChadoutaudPas encore d'évaluation
- Thèse LMD 66 2016 PDFDocument141 pagesThèse LMD 66 2016 PDFLaiadhi DjemouiPas encore d'évaluation
- CalSol17 Suite de La Fertilisation Basique Calcique en Cultures Adaptées.Document4 pagesCalSol17 Suite de La Fertilisation Basique Calcique en Cultures Adaptées.Yves Olivier LamarchePas encore d'évaluation
- PFEDocument8 pagesPFEGOUAREF SAMIRPas encore d'évaluation
- 70 Examens Corriges Chimie Organique Generale SMC s3 2014Document12 pages70 Examens Corriges Chimie Organique Generale SMC s3 2014r.agadimPas encore d'évaluation
- Technology - 56 - I RACC. PVC PR 010222Document49 pagesTechnology - 56 - I RACC. PVC PR 010222pastaPas encore d'évaluation
- Manuel de Stratification-Edition 2014 Rev01Document185 pagesManuel de Stratification-Edition 2014 Rev01becemPas encore d'évaluation
- 15 Proteines FibreusesDocument24 pages15 Proteines FibreusesBook Hunter100% (4)
- Geologie de Pétrole 2Document160 pagesGeologie de Pétrole 2missaoui100% (2)
- Eucaryotes Et Virologie (Version 1)Document46 pagesEucaryotes Et Virologie (Version 1)coursenligne.lille188% (17)