Académique Documents
Professionnel Documents
Culture Documents
07 Reactions Addition Sur Des Systemes Conjugues
Transféré par
lilTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
07 Reactions Addition Sur Des Systemes Conjugues
Transféré par
lilDroits d'auteur :
Formats disponibles
Complément - Chapitre 7
Alcènes et alcynes
Réactions d’addition sur des systèmes conjugués (addition électrophile
et cycloaddition de Diels-Alder sur les diènes conjugués)
Puisque le phénomène de résonance est possible dans les systèmes conjugués, une
attention particulière doit être apportée à ce genre de structure lors des réactions
chimiques.
- Addition électrophile sur les diènes conjugués
Les réactions d’addition sur les diènes conjugués donnent lieu à un résultat quelque peu
étonnant. En effet, quand une mole de bromure d’hydrogène est additionnée à une mole
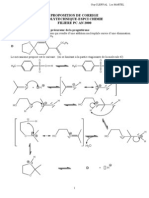
de buta-1,3-diène, deux produits sont obtenus (voir la figure 7.a).
Figure 7.a Réaction globale de l’addition d’un halogénure d’hydrogène sur un diène
conjugué
CH2 CH CH CH2 (Addition-1,2)
H Br
CH2 CH CH CH2 HBr
3-bromobut-1-ène
buta-1,3-diène
CH2 CH CH CH2 (Addition-1,4)
H Br
1-bromobut-2-ène
Au cours d’une addition-1,2, le réactif est additionné au premier et au deuxième atome de
carbone d’un diène conjugué, tandis que pour l’addition-1,4, l’addition se réalise sur le
premier et le quatrième carbone ; une liaison double apparaît entre les carbones 2 et 3.
La formation du 3-bromobut-1-ène implique que le HBr s’est additionné à l’une des deux
liaisons doubles, sans toucher à la seconde. Ce produit résulte d’une addition-1,2. La
formation du 1-bromobut-2-ène peut paraître inattendue. L’hydrogène et le brome se sont
ajoutés au carbone-1 et au carbone-4 du diène de départ, mais une nouvelle liaison double
est apparue entre le carbone-2 et le carbone-3. Ce phénomène, appelé addition-1,4, se
rencontre couramment avec les additions électrophiles sur les diènes conjugués.
Comment peut-on l’expliquer ?
Au cours de la première étape, l’atome d’hydrogène s’additionne à l’atome de carbone
terminal de l’une des liaisons doubles selon la règle de Markovnikov (voir la figure 7.b).
Chimie organique 1 – Chapitre 7 – Complément © 2008 Les Éditions de la Chenelière inc. 1
Figure 7.b Première étape du mécanisme réactionnel :
attaque du diène sur l’halogénure d’hydrogène
+ CH2
CH2 CH CH CH2 + H Br CH2 CH CH
1 2 3 4
H
buta-1,3-diène
Le carbocation qui en découle est stabilisé par résonance. Il s’agit de l’hybride de
résonance des deux formes limites de résonance présentées à la figure 7.c.
Figure 7.c Formes limites de résonance du carbocation
+ +
CH2 CH CH CH2 CH2 CH CH CH2
H H
La charge positive est donc délocalisée sur le carbone 2 et le carbone 4. Au cours de
l’étape suivante, le carbocation réagit avec l’ion bromure (le nucléophile), soit sur le
carbone 2 pour aboutir au produit de l’addition-1,2, soit sur le carbone 4 pour former le
produit de l’addition-1,4 (voir la figure 7.d).
Figure 7.d Deuxième étape du mécanisme réactionnel : deux additions possibles
de l’ion halogénure menant aux additions-1,2 et -1,4
_
+ CH2 Br CH2
CH2 CH CH CH2 CH CH
H H Br
et
+
_
+ Br
CH2 CH CH CH2 CH2 CH CH CH2
H H Br
L’addition-1,2 est un produit à contrôle cinétique. Il est plus rapide à former et
majoritaire lorsque la réaction est réalisée à basse température. Par opposition,
l’addition-1,4 est un produit à contrôle thermodynamique et s’avère être plus stable
que celui de l’addition-1,2 puisque l’alcène résultant est plus substitué, c’est-à-dire qu’il
y a plus de substituants, autres que des atomes d’hydrogène, sur les carbones de la liaison
double (on respecte ici la règle de Saytzev, voir la section 9.3.1). Le produit d’une
addition-1,4 sera majoritaire lorsque la réaction se déroule à haute température.
Chimie organique 1 – Chapitre 7 – Complément © 2008 Les Éditions de la Chenelière inc. 2
Exercice 7.a
Expliquez pourquoi, pendant la première étape de la réaction présentée à la figure 7.b, le
proton s’additionne sur le C-1 et non sur le C-2.
Dans un cation allylique, la liaison double carbone–carbone est adjacente à l’atome de
carbone positivement chargé.
Le carbocation intermédiaire de ce genre de réaction, muni d’une liaison double carbone–
carbone adjacente à l’atome de carbone positivement chargé, est appelé cation allylique.
Le cation allylique parent, illustré ci-dessous sous la forme d’un hybride de résonance, est
un carbocation primaire. Cependant, il est plus stable qu’un cation primaire ordinaire
(comme, par exemple, le cation propyle) car sa charge positive est délocalisée entre les
deux atomes de carbone terminaux, comme le montre la carte du potentiel électrostatique
accompagnant la figure 7.e.
Figure 7.e Formes limites de résonance d’un cation allylique et carte de potentiel
électrostatique de son hybride de résonance
H H
H H H H
+ +
H H H H
Exercice 7.b
Dessinez les formes limites de résonance qui contribuent à l’hybride de résonance du
cation cyclopentén-3-yle.
Chimie organique 1 – Chapitre 7 – Complément © 2008 Les Éditions de la Chenelière inc. 3
Exercice 7.c
Écrivez l’équation des produits escomptés de l’addition-1,2 et de l’addition-1,4 du brome
(Br2) sur le buta-1,3-diène.
Cycloaddition sur les diènes conjugués : réaction de Diels-Alder
Les diènes conjugués subissent un autre type d’addition-1,4 lorsqu’ils réagissent avec les
alcènes (ou les alcynes). L’exemple le plus simple est l’addition d’éthylène sur le buta-
1,3-diène qui donne naissance au cyclohexène (voir la figure 7.f).
Figure 7.f Mécanisme général d’une réaction de Diels-Alder
Nouvelle liaison π Nouvelle liaison σ
CH2 CH2
HC CH2 200oC HC CH2
+
HC CH2 HC CH2
CH2 CH2
Nouvelle liaison σ
buta-1,3-diène éthylène cyclohexène
Rendement : 20%
Cette réaction est un exemple de cycloaddition, soit une addition qui aboutit à un produit
cyclique. Cette cycloaddition, qui transforme trois liens π en deux liens σ et un nouveau
lien π, est appelée réaction de Diels-Alder, d’après les deux chercheurs allemands qui
l’ont mise au point, Otto Paul Hermann Diels (1876-1954) et son étudiant Kurt Alder
(1902-1958). La grande utilité de cette réaction pour fabriquer des composés cycliques a
valu à ces chercheurs le prix Nobel de chimie en 1950. Comme pour l’hydroboration,
cette réaction s’effectue selon un mécanisme concerté. En effet, la rupture et la
formation des liaisons se font simultanément.
Les deux réactifs sont constitués d’un diène et d’un diénophile (qui aime les diènes). La
réaction présentée à la figure 7.f n’est pas typique de la plupart des réactions de Diels-
Alder parce qu’elle nécessite une forte température (200 °C) et ne se solde pas par un bon
rendement (20 %). Ce type de réaction donne un excellent rendement à des températures
modérées si le diénophile porte des groupes électroattracteurs 1 , comme on peut
l’observer à la figure 7.g.
La réaction de Diels-Alder est une cycloaddition mettant en jeu un diène conjugué et
un diénophile et qui aboutit à un produit cyclique dans lequel deux liens σ et un nouveau
lien π sont formés simultanément au bris de trois liens π.
1
Les groupes électroattracteurs sont des groupes d’atomes qui attirent les électrons du lien π, ce qui
appauvrit l’alcène de ses électrons et le rend donc plus électrophile vis-à-vis du diène.
Chimie organique 1 – Chapitre 7 – Complément © 2008 Les Éditions de la Chenelière inc. 4
Figure 7.g Réactions de Diels-Alder impliquant des groupements électroattracteurs
sur le diénophile
O O
H H
30oC
+
CN
NC CN
CN
+ 0o C
CN
NC CN
CN
Remarque : Les réactions de Diels-Alder peuvent donner plusieurs produits possibles et
sont régiosélectives lorsque les diènes et les diénophiles ne sont pas symétriques. Ces
réactions sont alors nettement plus complexes et ne sont pas au programme du cours de
chimie organique au niveau collégial.
Exemple 7.a
Comment une réaction de Diels-Alder pourrait-elle permettre la synthèse du composé
suivant ?
O
Solution
Travaillons dans le sens inverse. La liaison double du produit obtenu était auparavant une
liaison simple entre les deux liaisons doubles du diène conjugué de départ. Par
conséquent,
O O
Chimie organique 1 – Chapitre 7 – Complément © 2008 Les Éditions de la Chenelière inc. 5
Exercice 7.d
Montrez comment le limonène pourrait être formé par une réaction de Diels-Alder de
l’isoprène (2-méthylbuta-1,3-diène) avec lui-même.
limonène
Exercice 7.e
Dessinez la structure du produit obtenu pour chacune des réactions de cycloaddition
suivantes.
a)
O + CH2 CH CN
b) CH2 CH CH CH2 + CN C C CN
Chimie organique 1 – Chapitre 7 – Complément © 2008 Les Éditions de la Chenelière inc. 6
Solutionnaire des exercices du complément
Exercice 7.a
Lorsque le proton s’additionne sur le deuxième carbone (C-2), il y a formation d’un
carbocation primaire, qui ne peut être en plus stabilisé par la résonance. Par contre,
lorsque le proton s’additionne sur le premier carbone (C-1), il y a formation d’un
carbocation secondaire, plus stable par effet inductif répulsif (respect de la règle de
Markovnikov) et qui, en plus, fait partie d’un système conjugué (résonance).
Exercice 7.b
+ +
Exercice 7.c
CH2 CH CH CH2 (Addition-1,2)
Br Br
Br2
CH2 CH CH CH2
3,4-dibromobut-1-ène
buta-1,3-diène
CH2 CH CH CH2 (Addition-1,4)
Br Br
1,4-dibromobut-2-ène
Chimie organique 1 – Chapitre 7 – Complément © 2008 Les Éditions de la Chenelière inc. 7
Exercice 7.d
Pour déterminer les structures du diène et du diénophile, il suffit de briser la deuxième
liaison de part et d’autre de la double liaison du cyclohexène tel que démontré ci-dessous.
+
Δ
L’équation est donc :
Exercice 7.e
a) O b) CN
CN
CN
Chimie organique 1 – Chapitre 7 – Complément © 2008 Les Éditions de la Chenelière inc. 8
Vous aimerez peut-être aussi
- 537db9f9e0633 PDFDocument4 pages537db9f9e0633 PDFfateh bouzianePas encore d'évaluation
- TD COD1 Alcane Et HC Insatur e 2024.PDF Filename UTF 8''TD COD1 Alcane Et HC Insaturée 2024Document3 pagesTD COD1 Alcane Et HC Insatur e 2024.PDF Filename UTF 8''TD COD1 Alcane Et HC Insaturée 2024jerytsiriniainaPas encore d'évaluation
- Alcènes AlcynesDocument17 pagesAlcènes AlcynesINFINITY & BEYONDPas encore d'évaluation
- Chapitre VI Hydrocarbures InsaturésDocument14 pagesChapitre VI Hydrocarbures Insaturésmoustaph09Pas encore d'évaluation
- Chapitre I CorrectionDocument4 pagesChapitre I CorrectionNAVENDRAN AjananPas encore d'évaluation
- Cours Bts Les ArenesDocument7 pagesCours Bts Les Arenesdady babelPas encore d'évaluation
- AclcenesDocument25 pagesAclcenesSamba BarhamPas encore d'évaluation
- Chapitre 3: Transformations Chimiques S'effectuant Dans Les Deux SensDocument6 pagesChapitre 3: Transformations Chimiques S'effectuant Dans Les Deux SensDounia Larhouasli MarrakchiPas encore d'évaluation
- Chap 4 DiènesDocument16 pagesChap 4 DiènesWahab HoubadPas encore d'évaluation
- Les AlcenesDocument3 pagesLes AlcenesKeyvanPas encore d'évaluation
- Cour L2PC 2023 ALCYNEDocument13 pagesCour L2PC 2023 ALCYNEemmanuel cerda adonaïPas encore d'évaluation
- Chapitre 7Document84 pagesChapitre 7Gabriel Lapointe-GuayPas encore d'évaluation
- 03 Alcenes2Document20 pages03 Alcenes2Camille YaoPas encore d'évaluation
- Car Bony Les Alpha-Beta InsaturesDocument7 pagesCar Bony Les Alpha-Beta InsaturesJean-François Abena100% (2)
- C3Chim Transformations Limitees PDFDocument4 pagesC3Chim Transformations Limitees PDFAzizElheniPas encore d'évaluation
- Cours Alcènes Et AlcynesDocument63 pagesCours Alcènes Et Alcynesrihabessaadi02Pas encore d'évaluation
- Cours Chimie Organique S3 Chapitre 1Document37 pagesCours Chimie Organique S3 Chapitre 1FADWA ENNAZIPas encore d'évaluation
- A 3 CompetitionDocument3 pagesA 3 CompetitionEmilie BoubinetPas encore d'évaluation
- Cours - Réact° Chimiq Par Échange de Proton.Document8 pagesCours - Réact° Chimiq Par Échange de Proton.FILALI AOUAL OumaimaPas encore d'évaluation
- Orga - 23 SN1 ET SN2Document7 pagesOrga - 23 SN1 ET SN2زيد بخليفةPas encore d'évaluation
- Correction AlcanesDocument2 pagesCorrection AlcanesMichael VoulnangPas encore d'évaluation
- Cours - Chimie - Les Acides Et Les Bases - Bac Sciences Exp (2014-2015) MR NabilDocument6 pagesCours - Chimie - Les Acides Et Les Bases - Bac Sciences Exp (2014-2015) MR NabilAliMchirgui100% (4)
- Composes AromatiquesDocument51 pagesComposes AromatiquesFatima Ben100% (1)
- Chimie Organique Série 01: Alcanes Et Cyclanes: Exercice 1Document36 pagesChimie Organique Série 01: Alcanes Et Cyclanes: Exercice 1brandonPas encore d'évaluation
- Essentiel ALCENES - Word (2) - 1Document7 pagesEssentiel ALCENES - Word (2) - 1MohamedPas encore d'évaluation
- Boumendjel Ahcene p12 PDFDocument45 pagesBoumendjel Ahcene p12 PDFMàâçhë ĶămęłPas encore d'évaluation
- Chimie-B-chap5-transfo Totales Ou LimiteesDocument4 pagesChimie-B-chap5-transfo Totales Ou LimiteesMed yahyaPas encore d'évaluation
- C4 Correction Exercices AciditeDocument5 pagesC4 Correction Exercices AciditeAndrés Tobías Mba MICHA ALENEPas encore d'évaluation
- Ch13 Reaction Chimique Echange ProtonDocument5 pagesCh13 Reaction Chimique Echange Protonالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- 2 AlcenesDocument8 pages2 Alcenesam47Pas encore d'évaluation
- Corrigé S2-2008Document5 pagesCorrigé S2-2008Doro CisséPas encore d'évaluation
- Chapitre 3: Transformations Chimiques S'effectuant Dans LesDocument6 pagesChapitre 3: Transformations Chimiques S'effectuant Dans LesFATIMA fatiiiPas encore d'évaluation
- Fractionné 20240212 2129Document7 pagesFractionné 20240212 2129Mouhamed lamine SonkoPas encore d'évaluation
- Alcènes ExercicesDocument5 pagesAlcènes ExercicesLamine Ould DidiPas encore d'évaluation
- Boumendjel Ahcene p08Document16 pagesBoumendjel Ahcene p08جعدبندرهمPas encore d'évaluation
- Série 1 RPDocument2 pagesSérie 1 RPAyoub DjouabiPas encore d'évaluation
- Les Reactions Acido Basiques Resume de CoursDocument2 pagesLes Reactions Acido Basiques Resume de CoursMahfoud NatsuPas encore d'évaluation
- Corrige de L'Epreuve de Sciences PhysiquesDocument6 pagesCorrige de L'Epreuve de Sciences PhysiquesKéitaPas encore d'évaluation
- Spe Physique Chimie 2021 Metropole 2 CorrigeDocument11 pagesSpe Physique Chimie 2021 Metropole 2 CorrigeChahid OUAAZIZIPas encore d'évaluation
- Série 3 SMC4Document5 pagesSérie 3 SMC4anwar jakriPas encore d'évaluation
- Chapitre I: Equilibres Chimiques: I-Les Lois Quantitatives Et Qualitatives I-1 - DéfinitionDocument36 pagesChapitre I: Equilibres Chimiques: I-Les Lois Quantitatives Et Qualitatives I-1 - DéfinitionLawrence Mundene-timotheePas encore d'évaluation
- Chimie: - Chimie en Solution AqueuseDocument35 pagesChimie: - Chimie en Solution AqueuseAyoub Maverick100% (1)
- C 00 XP 1 CDocument13 pagesC 00 XP 1 CMihnea GamanPas encore d'évaluation
- Chemical Engineering LabDocument15 pagesChemical Engineering LabOmairPas encore d'évaluation
- 4-Réactions S'effectuant Dans Les Deux Sens (WWW - Pc1.ma)Document6 pages4-Réactions S'effectuant Dans Les Deux Sens (WWW - Pc1.ma)Amine ElasriPas encore d'évaluation
- Alcènes Énoncés ExercicesDocument62 pagesAlcènes Énoncés ExercicesMaxime EidelsbergPas encore d'évaluation
- 1 PFCpolypDocument6 pages1 PFCpolypPrincess FatiPas encore d'évaluation
- (1bis) Solutions DétailléesDocument7 pages(1bis) Solutions DétailléescharleyrandrianjatovoPas encore d'évaluation
- Cours de Chimie OrganiqueDocument33 pagesCours de Chimie OrganiqueFADWA ENNAZIPas encore d'évaluation
- DS03 CDocument12 pagesDS03 CbaatoutmbPas encore d'évaluation
- Chapitre IIDocument12 pagesChapitre IIPascal GadedjissoPas encore d'évaluation
- ExtraitDocument9 pagesExtraitSteeven VillagePas encore d'évaluation
- Exercices 2transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseDocument1 pageExercices 2transformations Liées À Des Réactions Acido - Basiques Dans Une Solution Aqueuselabiadsihame73Pas encore d'évaluation
- SV1 Chimie1Document49 pagesSV1 Chimie1Yassine ElkaPas encore d'évaluation
- Chapitre 2Document64 pagesChapitre 2ILHAM AMRAOUIPas encore d'évaluation
- Fiche TD Equlibre Chimique CorrigéDocument5 pagesFiche TD Equlibre Chimique CorrigéIslam BelhadjPas encore d'évaluation
- ExtraitDocument8 pagesExtraitprepamontaPas encore d'évaluation
- Chapitre 5 PH Des Solutions AqueusesDocument16 pagesChapitre 5 PH Des Solutions AqueusesSyryne DridiPas encore d'évaluation
- TP Piles ConcentrationDocument3 pagesTP Piles ConcentrationlilPas encore d'évaluation
- d1n4j-AP07 Et 08 Spectroscopie UV Visible Et IRDocument5 pagesd1n4j-AP07 Et 08 Spectroscopie UV Visible Et IRlilPas encore d'évaluation
- Chap04D ExosBeerLambertDocument1 pageChap04D ExosBeerLambertlilPas encore d'évaluation
- 2012 Pondichery Exo2 Correction Spectrophotometrie 5 5ptsDocument2 pages2012 Pondichery Exo2 Correction Spectrophotometrie 5 5ptslilPas encore d'évaluation
- 5géologie StructuraleDocument27 pages5géologie StructuraleChakib SafarPas encore d'évaluation
- Département de Génie Mécanique Option - Génie Des Matériaux Mémoire de Fin D Étude en Vue de L Obtention Du Diplôme de Master en Génie Des MatériauxDocument120 pagesDépartement de Génie Mécanique Option - Génie Des Matériaux Mémoire de Fin D Étude en Vue de L Obtention Du Diplôme de Master en Génie Des MatériauxmoummouPas encore d'évaluation
- Devoir de Contrôle N°2 1er Semestre - Math - Bac Technique (2018-2019) MR Dkhili AhmedDocument2 pagesDevoir de Contrôle N°2 1er Semestre - Math - Bac Technique (2018-2019) MR Dkhili Ahmedkougfst ldhdPas encore d'évaluation
- Ondes Sonores Fluides 1Document7 pagesOndes Sonores Fluides 1SaraIdrissiPas encore d'évaluation
- 1 Cours Catenaire Date Inconnue FraDocument130 pages1 Cours Catenaire Date Inconnue Frasnoofsnoof100% (5)
- Exercice MRPDocument2 pagesExercice MRPMõűñã BõūãbîdPas encore d'évaluation
- TDM3 Sans RéponsesDocument2 pagesTDM3 Sans RéponsesOumaima LemouyiPas encore d'évaluation
- StatiqueDocument4 pagesStatiqueMounire BenmoussaPas encore d'évaluation
- Livre Secourisme GénéralDocument91 pagesLivre Secourisme GénéralAmalia Dragan-SuciuPas encore d'évaluation
- Guide Anglais 1èDocument13 pagesGuide Anglais 1èMike KeitaPas encore d'évaluation
- Transmission Puissance 1ere Doc ÉlèveDocument5 pagesTransmission Puissance 1ere Doc ÉlèveMarouen Mekki100% (1)
- Engin BTP Et Terrassement-1Document37 pagesEngin BTP Et Terrassement-1SamuelPas encore d'évaluation
- 8 French Werber Bernard Le Livre Du Voyage PDFDocument83 pages8 French Werber Bernard Le Livre Du Voyage PDFmariaPas encore d'évaluation
- Chap 1Document14 pagesChap 1NoussaPas encore d'évaluation
- Croquis Quartier Batignolles ParisDocument23 pagesCroquis Quartier Batignolles ParisBruno BROCHARDPas encore d'évaluation
- Electromag c13 SiteDocument36 pagesElectromag c13 Siteabdelilah.hassounePas encore d'évaluation
- Developpement Dun Systeme de Production Du Biodiesel A Partir Dhuile UtiliseDocument59 pagesDeveloppement Dun Systeme de Production Du Biodiesel A Partir Dhuile UtiliseyveseonePas encore d'évaluation
- Rapport Revue Processus Production Septembre 2023 (2) ADocument16 pagesRapport Revue Processus Production Septembre 2023 (2) AKOUAMEPas encore d'évaluation
- Tpe Seminaire Et ConferenceDocument19 pagesTpe Seminaire Et ConferenceErickPas encore d'évaluation
- InvestissementsDocument2 pagesInvestissementsMOUSSA DIABATEPas encore d'évaluation
- VELLARD, Jehan - Une Civilisation Du Miel PREVIEWDocument22 pagesVELLARD, Jehan - Une Civilisation Du Miel PREVIEWResearcherPas encore d'évaluation
- 2013 - Audit EnergetiqueDocument58 pages2013 - Audit EnergetiqueMouhcine HajjoujePas encore d'évaluation
- 200 Questions Isolées en QCM-Orthopédie TraumatologieDocument222 pages200 Questions Isolées en QCM-Orthopédie TraumatologieZohra Targui67% (3)
- Le Renouveau Rural (Algérie - 2006)Document435 pagesLe Renouveau Rural (Algérie - 2006)cissmaroc100% (3)
- ZAP05 Pages SimplesDocument68 pagesZAP05 Pages SimplesFourier MakambioPas encore d'évaluation
- 6180Document827 pages6180Justyna Podlecka67% (3)
- Corrigé DS01 2014 PDFDocument6 pagesCorrigé DS01 2014 PDFEssaidi AliPas encore d'évaluation
- Information Metier Hotellerie Restauration Personnel Du Hall WWW - Hotellerie-Restauration - CoDocument4 pagesInformation Metier Hotellerie Restauration Personnel Du Hall WWW - Hotellerie-Restauration - CoEmploi Hotellerie RestaurationPas encore d'évaluation
- 4 InfrastructureDocument27 pages4 InfrastructureAhmed MediouniPas encore d'évaluation
- SOLIDEC Plusieurs PostesDocument3 pagesSOLIDEC Plusieurs PostesIr Justin MULANGIPas encore d'évaluation