Académique Documents
Professionnel Documents
Culture Documents
CS Cours Résidents
Transféré par
mina ycTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
CS Cours Résidents
Transféré par
mina ycDroits d'auteur :
Formats disponibles
Faculté de Médecine d’Alger Année universitaire 2020/2021
UNIVERSITE BENYOUCEF BENKHEDDA Ŕ ALGER1
FACULTE DE MEDECINE
COMITE PEDAGOGIQUE REGIONALE DE SPECIALITE (CPRS)
CENTRE DE BIOCHIMIE
ENSEIGNEMENT DE RESIDANAT
Cours de Biochimie Clinique
HORMONES
CORTICOSURRENALIENNES
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 1
Faculté de Médecine d’Alger Année universitaire 2020/2021
Plan
INTRODUCTION
Rôles des hormones stéroïdes
Structure et nomenclature
Classification des stéroïdes
Organes Stéroidogènes
I/ La glande surrénale
II/ Les sécrétions surrénaliennes
1/ CORTISOL
2/ ALDOSTERONE
3/ ANDROGENES
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 2
Faculté de Médecine d’Alger Année universitaire 2020/2021
INTRODUCTION
Les hormones stéroïdes (HS) sont des composés biologiques doués de propriétés hormonales.
Les HS se ressemblent sur le plan structural.
Toutes ces hormones dérivent du cholestérol.
Rôles : Les HS sont indispensables
-à la survie : minéralocorticoïdes (aldostérone), glucocorticoïdes (cortisol)
-à la reproduction des espèces : les œstrogènes et les androgènes et la progestérone.
Structure et nomenclature :
Précurseur: cyclopentanoperhydrophénantréne
Les hormones stéroïdes dérivent toutes du noyau stérane après :
Fixation de radicaux oxygénés.
Fixation de chaines latérales
Désaturation.
Classification des stéroïdes:
Les HS avec squelette carboné à 21C, possèdent un noyau prégnane : Progestérone, Cortisol,
Aldostérone
Les HS avec squelette carboné à 19C, possèdent un noyau androstane : Androgènes.
Les HS avec squelette carboné à 18C, possèdent un noyau œstrane, exemple : Œstrogènes.
Classe Noyau de Base Nombre de carbone Hormones actives
Œstrogènes Œstrane C18 Œstradiol
Androgènes Androstane C19 Testostérone
Progestins Prégnane C21 Progestérone
Glucocorticoides Prégnane C21 Cortisol
Minéralocorticoides Prégnane C21 Aldostérone
Vitamine D Cholestane C27 1,25 dihydroxycalciférol
Organes Stéroidogènes :
1 / Cortico surrénale
2 / Gonades (Ovaires, Testicules)
3 / Placenta
Et à moindre degré on a :
4 / Tissu adipeux
5 / Cerveau
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 3
Faculté de Médecine d’Alger Année universitaire 2020/2021
Remarque: Un stéroïde, peut être précurseur dans une glande et hormone dans une autre glande:
La molécule carrefour de la synthèse de ces hormones est la progestérone (précurseur)
Rappel structural et Biosynthèse des hormones stéroïdes :
Cholestérol → Prégnénolone (P5) → Progestérone (P4)
(C27) (C21) (C21)
Les molécules stéroïdes qui ont une double liaison entre C5-C6 sont les molécules de la voie ∆5
(3βOH∆5)
Celles qui ont une double liaison entre C4-C5 sont les molécules de la voie ∆4 (3céto∆4)
Celles qui ont une double liaison entre C5-C6 mais avec une molécule de sulfate en plus sur le C3 sont
les molécules de la voie sulfate ∆5 (S-∆5)
Les HS sont divisés en 3 groupes :
- Les Stéroïdes sexuels : Androgènes, Œstrogènes, Progestérone
- Les Glucocorticoïdes : cortisol
- Les Minéralocorticoïdes : aldostérone.
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 4
Faculté de Médecine d’Alger Année universitaire 2020/2021
Sites de production : les HS sont synthétisées au niveau de tissus spécialisés.
- Progestérone : Ovaire et Placenta (de même pour les Œstrogènes)
- Cortisol : couche fasciculée de la corticosurénale (CS) = glucocorticoïdes.
- Aldostérone : couche glomérulée de la CS = minéralocorticoïdes.
- Androgènes : 2 origines différentes : - Testicules & couche réticulée de la CS
(corticosurrénale).
Les hormones corticosurrénaliennes sont sécrétées par la corticosurrénale.
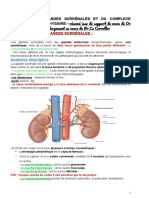
I/ La glande surrénale
A. Histoire de la glande surrénale
La glande surrénale a été décrite pour la première fois dans la littérature en 1563 par
l’anatomiste italien Bartolomeo Eustachi qui travaillait alors sur le rein. Bien plus tard, en 1805,
Georges Cuvier remarque que la surrénale est composée de deux parties ; le cortex et la médulla. En
1893, Oliver et Schäfer décrivent le potentiel hypertensif d’extraits surrénaliens chez le chien.
L’isolement et la synthèse chimique partielle des hormones corticosurrénaliennes sont réalisés en
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 5
Faculté de Médecine d’Alger Année universitaire 2020/2021
1946, permettant ainsi à Philip S. Hench, Tadeusz Reichstein et Edward C. Kendall d’utiliser les
hormones surrénaliennes pour la première fois en thérapeutique et de recevoir le prix Nobel de
physiologie et de médecine en 1950.
B. Anatomie
Chez l’Homme, la glande surrénale est un organe pair situé dans l’espace rétro-péritonéal, au
pôle apical des reins. De part et d’autre de la colonne vertébrale, elles sont localisées entre la douzième
vertèbre thoracique et la première vertèbre lombaire. Les deux glandes surrénales humaines ont
globalement une forme pyramidale à base inférieure. La glande surrénale gauche est légèrement plus
petite et plus allongée que la droite, pesant toutes deux environ 5 à 8 g. Cette glande est composée
d’une capsule de tissu conjonctif renfermant deux parties ; le cortex et la médulla d’origines
embryologiques distinctes et ayant chacune des sécrétions propres.
C. Origine embryologique
Durant le développement embryonnaire, le mésoderme intermédiaire donne naissance au cortex
tandis que la médulla est issue de l’ectoderme.
D. Histologie
La médulla, ou médullosurrénale, est la partie la plus centrale de la glande. Chez l’Homme, la
médulla n’adopte son histologie définitive qu’après la naissance, entre 12 et 18 mois, lorsque les
cellules se regroupent au cœur de la glande. Les cellules chromaffines matures produiront l’adrénaline
(80%) et la noradrénaline (20%) synthétisées à partir de la tyrosine.
Le cortex surrénalien, également appelé « corticosurrénale », est la partie externe de la glande
surrénale et représente environ 90% de la glande surrénale saine chez l’Homme adulte. Il est composé
de trois couches concentriques distinctes, décrites pour la première fois en 1866 par le pathologiste
allemand Julius Arnold. Ces trois zones diffèrent par leur morphologie et leur fonction :
La zone glomérulée (ZG), située sous la capsule, est la zone la plus externe et la plus fine. Les
cellules stéroïdogènes y sont organisées en glomérules, depuis peu également appelés « rosettes ».
C’est le lieu de synthèse des hormones minéralocorticoïdes et plus particulièrement de l’aldostérone.
La zone fasciculée (ZF) représente environ 80% de la corticosurrénale. Elle est organisée en
faisceaux de cellules perpendiculaires à la capsule. C’est le lieu de production des glucocorticoïdes
dont le chef de file est le cortisol chez l’Homme et la corticostérone chez le rongeur.
La zone réticulée (ZR) est formée de petites cellules qui sécrètent les androgènes : la
déhydroépiandrostérone (DHEA) et son dérivé sulfaté (DHEA-S) ainsi qu’une faible quantité
d’androstènedione. Leur activité biologique, faible en conditions physiologiques, provient surtout de
leur conversion en testostérone et di-hydroxytestostérone dans les tissus périphériques. Les androgènes
sont principalement impliqués dans le développement des caractères sexuels secondaires.
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 6
Faculté de Médecine d’Alger Année universitaire 2020/2021
E. Vascularisation et innervation
Compte tenu de leurs fonctions endocrines, les glandes surrénales sont des organes très richement
vascularisés.
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 7
Faculté de Médecine d’Alger Année universitaire 2020/2021
Leur irrigation est assurée par l’artère surrénale supérieure issue de l’artère phrénique, l’artère
surrénale moyenne issue de l’aorte abdominale et l’artère surrénale inférieure provenant de l’artère
rénale. Les artères pénètrent dans la glande surrénale au niveau de la capsule dans laquelle elles
forment le réseau capsulaire. Elles se ramifient ensuite pour donner naissance au réseau sous
capsulaire, cortical puis médullaire et ainsi permettre l’irrigation de toutes les couches du parenchyme.
Les glandes surrénales sont dotées d’une riche innervation sympathique provenant du nerf
splanchnique et des nerfs abdomino-pelviens associée à une innervation parasympathique autonome
assurée par les nerfs phrénique et vague. Les fibres nerveuses afférentes innervant la surrénale suivent
fidèlement le réseau vasculaire décrit ci-dessus. Les fibres pénètrent dans la corticosurrénale par la
capsule pour s’insinuer profondément dans le cortex.
F. Stéroïdogenèse surrénalienne
1. Entrée et stockage du cholestérol
Le cholestérol est le précurseur de nombreux composés biologiques et en particulier des
hormones stéroïdiennes. Les cellules surrénaliennes font partie des cellules capables de synthétiser le
cholestérol à partir d’acétylcoenzyme A puisque qu’elles expriment l’HMG CoA
(Hydroxyméthylglutaryl Coenzyme A) réductase. Le cholestérol circulant est transporté à l’intérieur
de la cellule stéroïdogène par deux lipoprotéines majoritaires ; les lipoprotéines de faible densité ou
LDL (low-density lipoproteins) et les lipoprotéines de haute densité ou HDL (high-density
lipoproteins). Les HDL et les LDL sont captées au niveau de la membrane plasmique de la cellule
stéroïdogène par deux types de récepteurs majoritaires. Le récepteur SR-B1 (scavenger receptor de
type B1) est capable de lier les HDL avec une forte affinité permettant ainsi l’entrée sélective des
esters de cholestérol dans les cellules surrénaliennes. L’entrée des LDL passe par le récepteur aux
LDL (LDL-R). A la différence des HDL, les complexes LDL/LDL-R sont internalisés. Le cholestérol
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 8
Faculté de Médecine d’Alger Année universitaire 2020/2021
estérifié est hydrolysé et la lipoprotéine peut ensuite être recyclée. Les cellules corticosurrénaliennes
expriment également le récepteur aux lipoprotéines de très faible densité (VLDL ; very low-density
lipoproteins) qui participe à la biosynthèse des hormones corticosurrénaliennes en augmentant la
capacité à produire de l’aldostérone et du cortisol via l’augmentation de la concentration calcique
intracellulaire. Après son entrée dans la cellule, le cholestérol cytosolique est ensuite stocké sous
forme d’esters de cholestérol formant ainsi des gouttelettes lipidiques. En cas de besoin, les esters de
cholestérol sont clivés en cholestérol libre par une cholesterol-ester hydrolase également appelée HSL
(hormone-sensitive lipase). Le cholestérol est transporté par la protéine SCP-2 (sterol carrier protein 2)
jusqu’à la membrane mitochondriale externe où la stéroïdogenèse peut alors débuter.
2. Synthèse des hormones corticosurrénaliennes
La synthèse des hormones corticosurrénaliennes se fait au niveau de chaque zone à partir
du cholestérol (LDL + synthèse surrénalienne). La transformation du cholestérol fait intervenir deux
types d’enzymes :
- une série d’enzymes de la famille des cytochromes P450 :
*CYP 21A2 :21Hydrolase
* CYP 11A1 : régulée par l’ACTH, étape limitante de la stéroidogenèse
* CYP 11B1 : régulée par l’ACTH, synthèse du cortisol
* CYP 11B2 : régulée par la rénine Ŕangiotensine, synthèse d’aldostéone.
- et des hydroxy-stéroïdes- déshydrogénases localisées dans la mitochondrie ou le réticulum
endoplasmique.
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 9
Faculté de Médecine d’Alger Année universitaire 2020/2021
Cette série d’oxydations nécessite l’intervention de flavoprotéines, le NADPH (nicotinamide adénine
dinucléotide phosphate), classe de transporteurs d’électrons de la chaîne respiratoire. La première
étape de la stéroïdogenèse fait intervenir l’enzyme P450scc (side chain cleavage), présentant une
activité 20-22 desmolase et qui permet la formation de Δ5-prégnénolone via le clivage de la chaîne
latérale du cholestérol (étape indispensable à la stéroisynthèse). La prégnénolone sort ensuite de la
mitochondrie pour rejoindre le réticulum endoplasmique lisse et synthèse des minéralocorticoides ou
des glucocorticoides selon une topographie spécialisée au sein du cortex surrénalien.
Dans la ZG, la prégnénolone est transformée en progestérone par l’enzyme 3β-hydroxystéroïde
déshydrogénase de type 2 ou 3β-HSD2 (HSD3B2), puis en 11- déoxycorticostérone par l’enzyme 21-
hydroxylase (CYP21A1 ou 21-OH). Ce stéroïde est alors transféré dans la mitochondrie pour y être
métabolisé en corticostérone et enfin en aldostérone par l’aldostérone synthase ou 11β-hydroxylase de
type 2 (CYP11B2 ou 11β-OH).
Dans la ZF, les cellules expriment spécifiquement la 17α-hydroxylase (CYP17A1 ou 17α-OH) qui
catalyse la réaction d’hydroxylation de la prégnénolone en 17-hydroxyprégnénolone. A son tour,
l’enzyme 3β-HSD2 convertit ce stéroïde en 17-hydroxyprogestérone (17-OHP), intermédiaire qui sera
modifié en 11-déoxycortisol sous l’action de la 21-OH. La dernière réaction enzymatique se déroule
également dans la mitochondrie. L’intervention de l’enzyme 11β-hydroxylase de type 1 (CYP11B1)
sur le 11-déoxycortisol conduit à la production de cortisol.
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 10
Faculté de Médecine d’Alger Année universitaire 2020/2021
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 11
Faculté de Médecine d’Alger Année universitaire 2020/2021
II/ Les sécrétions surrénaliennes
1/ CORTISOL
1.1) Etude du cortisol
a) Lieu de biosynthèse :
Glucocorticoïde synthétisé au niveau de la zone fasciculé de la CS.
Synthèse commence et se termine au niveau de la mitochondrie.
Pour donner le cortisol, la P4 subit 3 hydroxylations successives.
3βOH isomérase 17α OHase 2 1α OHase
Cholestérol P5 P4 17αOHP4 17,21diOHP4
Mitoch Cyto Cyto
11β OHase
11β, 17α, 21α triOHP4 = 11β désoxycortisol = composé S Cortisol (composé F)
Cyto Mitoch
b) Formes circulantes
Concentration ≈ 50-150 ,
Rythme circadien, nycthéméral (toutes les 24h).
La sécrétion de cortisol varie au cours de la journée car elle dépend
de l'apport alimentaire et de l'activité physique.
Le pic le plus élevé de la cortisolémie : 7-8h du matin
(Peu après le lever)
Le minimum c’est vers minuit (à l’endormissement).
L’ACTH impose son rythme à la surrénale.
Au niveau de la circulation le cortisol existe sous 2 formes :
- Sous forme libre 5% forme hormonale active
- Sous forme liée à des protéines de transports 95%.
c) Protéines de transport du cortisol : le transport plasmatique du cortisol est assuré par 2
types de protéines :
1°) CBG = Cortisol Binding Globulin ou Tanscortine
Le cortisol est lié spécifiquement à la CBG (90%).
Sa concentration plasmatique = 30mg/l
Sa biosynthèse est stimulée par les œstrogènes (grossesse) et les H. thyroïdiennes et
inhibée par les androgènes.
La CBG intervient dans la régulation de la concentration du cortisol si CBG↑ → cortisol libre ↓.
2°) Albumine
Non spécifique, lie environ 10% du cortisol plasmatique.
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 12
Faculté de Médecine d’Alger Année universitaire 2020/2021
La demi-vie du cortisol ≈ 30minutes.
d) Catabolisme
Essentiellement hépatique.
Donne des dérivés inactifs.
Consiste, en des réactions d’hydrogénations
1ère hydrogénation sur C5 → apparition de dérivés dihydrogènes (DiH2) → C5β
2ème hydrogénation sur C3 → apparition de dérivés tétra hydrogénés (TétraH2) → C3, 5β
3ème hydrogénation sur C20 → apparition de dérivés hexahydrogénés (hexaH2) → C3α, 5β, 20α
Elimination dans les urines sous forme libres ou glucurono-jugués.
Les formes chimiques les plus abondantes au niveau du foie sont les dérives tétrahydrogénés.
Tous ces dérivés subissent une conjugaison afin d’améliorer leur solubilité (glucurono-jugués).
Le cortisol peut subir une transformation hépatique (oxydation) grâce à la 11βOH stéroïde
O-R à NAD, d’où apparition d’une fonction cétone au niveau C11 et le produit = Cortisone (inactif).
Au niveau du foie le cortisol est en équilibre avec la cortisone (forme de réserve hépatique).
Toutes ces molécules urinaires portent un OH au niveau du C17 en position α.
La majorité des catabolites urinaires du cortisol (21C) sont appelés dérivés 17αOH stéroïdes.
Une minorité des catabolites urinaires du cortisol sont des molécules à 17C sont appelés dérivés
17cétostéroïdes.
Concentration 17αOH stéroïdes urinaires : Homme : 4-10 mg/24H
Femme : 3-8 mg/24H
e) Régulation de la libération du cortisol
Sous l’effet de l’axe hypothalamo-hypophyso-corticosurrénalien
L’hypothalamus sécrète la CRH, qui agit au niveau de l’antéhypophyse et stimule la
synthèse et la libération de l’ACTH.
L’ACTH agit sur 2 couches de la CS :
- Zone fasciculée : stimulation de la synthèse et libération du cortisol.
- Zone réticulée : stimulation de la synthèse et libération des androgènes
surrénaliens : S-DHEA, DHEA, Androstènedione, Testostérone.
[ACTH] plasmatique = 25-50 ng/l
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 13
Faculté de Médecine d’Alger Année universitaire 2020/2021
f) Effecteurs (+) sur la libération du cortisol
Stress
Peptides opiacés : endorphines,….
g) Effets biologiques du cortisol
Agit sur la quasi-totalité des tissus et sur les différents métabolismes.
Sur le métabolisme des protéines : stimule le catabolisme des protéines (protéolyse au
niveau des muscles, de la peau des tissus conjonctifs) d’où libération des acides aminés qui entre dans
la voie de la néoglucogenèse (Effet hyperglycémiant).
Sur le métabolisme des lipides : stimule la lipolyse d’où augmentation des AG libres et
des lipoprotéines, et la dégradation des AG = éléments énergétiques pour la cellule
Autres rôles du cortisol :
- il possède un effet hypertensif,
- stimule la production de l’acidité gastrique,
- agit sur le comportement,
- agit sur la maturation pulmonaire en fin de grossesse,
- à forte dose, présente une faible activité minéralocorticoide (favorise l’élimination
urinaire d’eau par diminution de l’action et synthèse de l’ADH d’où effet diurétique).
- modifie la répartition des graisses,
- Favorise la résistance aux stress et aux agressions :
* prévention de la vasodilatation et de l’hypotension artérielle
* diminution des réactions immunitaires (immunosurprésseur),
* inhibition des phénomènes inflammatoire (anti-inflammatoire),
* diminution des taux d’éosinophile (antiallergique)
- Métabolisme phosphocalcique et remodelage osseux : augmente la résorption osseuse et
diminue la croissance du cartilage.
- Autres effets physiologique du cortisol :
*Axe somatotrope : ↓ GH
* SNC : euphorisant, ↑ l’appétit.
* Thrombogène : ↑ la coagulation.
1.2) Exploration
a) Exploration statique :
Faire cortisolémie libre : le dosage du cortisol sanguin est réalisé par immunoanalyse et les
résultats peuvent être exprimés en nmol/l ou en ng/ml (nmol/l 0,36 ng/ml).
Précautions : pas de corticothérapie en cours, ni dans les 2 mois précédents, sang hépariné à 8 h du
matin le sujets étant à jeun et au repos.
Valeurs usuelles : variation nycthémérales :
A 8h à jeun : 250 à 650 nmol/l (100 à 200 ng/l) ;
Entre 16h et 20h le soir : valeur diminuée de plus de 50% chez le même patient par rapport au
matin à jeun : 54 à 250 nmol/l (20 à 90 ng/l).
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 14
Faculté de Médecine d’Alger Année universitaire 2020/2021
Faux positifs :
situation avec augmentation de la CBG (grossesse, oestroprogestatifs), ce qui entraine
une augmentation de la cortisolémie alors que le cortisol libre urinaire reste normal ;
pseudo- cushing : stress important, état infectieux, insuffisance rénale sévère,
insuffisance hépatique sévère, dépression, anorexie mentale, obésité, alcoolisme.
Quelquefois dosage de la CBG plasmatique.
Dosage du cortisol libre urinaire (CLU) des 24h : une faible partie du cortisol plasmatique
(<5%) est libre (fraction active). Elle subit une excrétion urinaire donnant le CLU qui reflète
le cortisol libre plasmatique. cette fraction augmente de façon fidèle au cours des
hypercorticismes.
La meilleure méthode de dosage du CLU est l’HPLC après extraction à partir des urines sans
hydrolyse.
Valeurs usuelles :
Femme : 27 à 135 nmol/24h (10 à 50 ;
Homme : 54 à 135 nmol/24 h (20 à 50μg/24h).
Le CLU est un indicateur très sensible d’un syndrome de Cushing, avec sensibilité de 100% et une
spécificité de 98%.
Il est légèrement augmenté chez moins de 5% des sujets obèses (pseudo-Cushing).
Avantage : peut se faire à domicile, mais nécessite un recueil rigoureux des urines et le dosage de la
créatininurie.
Parfois dosage des catabolites urinaires du cortisol.
Cortisol libre salivaire : mêmes précaution d’horaire, se conserve toujours à T° ambiante.
Valeurs usuelles :
De 8h à 10h : < 19 nmol/l ;
De14h30 à 15h30 : < 12 nmol/l.
Avantage : facilité de prélèvement, peut se faire à domicile.
Dosage de l’ACTH : Diagnostic étiologique++++
Prélèvement à 8h du matin.
ACTH < 5 pg/ml hypercorticisme ACTH indépendant
ACTH > 15 pg/ml hypercorticisme ACTH dépendant
ACTH > 60000 pg/ml sécrétion ectopique en générale.
Souvent on est appelé à faire les épreuves dynamiques (soit de stimulation soit de freination).
b) Exploration dynamique
1) Tests de stimulation :
1.1) Test à l’ACTH : comme la demie vie de l’ACTH est très courte (< 10 min),
on utilise un analogue structural de l’ACTH de demie vie plus longue = ACTH retard = Synacthène.
- Test au synacthène immédiat :
Préparation du patient : sujet à jeun depuis 12h, au repos pendant l’épreuve.
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 15
Faculté de Médecine d’Alger Année universitaire 2020/2021
Prélèvement à T0 : dosage du cortisol sanguin.
Protocole : 0,250 mg de synacthène IM ou IV, et doser le cortisol sanguin à T30 mn et T60 mn.
Seuil pour définir une absence d’insuffisance surrénalienne :
Cortisolémie > 550-600 nmol/l à T30 mn et / ou T60mn
- Test au synacthène retard :
Préparation du patient : identique au précédent.
Prélèvement à T0 : dosage du cortisol sanguin. Injection de 1 mg de synacthène retard IM et dosage
du cortisol sanguin à T1h et jusqu’à T24h (soit de 1 à 5 h toutes les heures, soit de 1h à 24h à raison
de 4 à5 prélèvements) : le cortisol doit être multiplié par 2 dès la première heure, continuer à
augmenter ensuite.
1.2) Test à l’insuline (agent de stress)
1.3) Test à la CRH : permet la distinction entre une étiologie hypophysaire et
ectopique.
Administration du CRH et dosage d’ACTH et du cortisol
Une élévation > 100 % ACTH et > 50% cortisol élimine une origine ectopique.
2) Test de freination :
2.1) Test à la Dexaméthasone (Dectancyl®) : (dérivé fluoré du cortisol)
Glucocorticoïde de synthèse ayant des effets plus important, car 20 fois plus
active que le cortisol (parce que toutes les molécules de déxaméthasone restent libres), son injection
entraine la ↓ ACTH et une forte ↓ cortisol.
Préparation du patient : sujet à jeun depuis 12h.
Suivant la quantité de Dectancyl administrée, on a 3tests :
- Test de freinage minute :
®
Dectancyl 1mg per os à minuit et dosage du cortisol sanguin à 8h.
Normal si < 30ng/ml (< 50 nM /L)
Pas de test de freinage si obésité, stress, alcoolisme, dépression, prise d’oestroprogestatifs,
etc…
- Test de freinage standard (ou test de Liddle faible) :
Dectancyl® 0,5mg per os toutes les 6 heures pendant 48h, et doser le cortisol sanguin ou le
CLU à J0 et entre J2 et J3.
Normal si : cortisolémie < 30ng/ml (< 50 nmol/L), CLU < 10 µg/24h.
- Test de freinage fort (ou test de Liddle fort) :
Dectancyl® 2mg per os toutes les 6 heures pendant 48h (soit une dose totale de 16mg), et doser
le cortisol sanguin ou le cortisol urinaire à J0 et J2.
Une diminution de la cortisolémie < 5 nmol/l (soit indétectable) et du cortisol urinaire < 10
µg/24h et en faveur d’une origine hypophysaire de la sécrétion d’ACTH (et en défaveur d’une
sécrétion ectopique : en général pas de freinage).test à visée étiologique uniquement, à réaliser
quand le diagnostic positif d’hypercorticisme ACTH-dépendant a été effectué.
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 16
Faculté de Médecine d’Alger Année universitaire 2020/2021
2.2) Test à la Métopirone
Ce test stimule l’ACTH endogène.
La métopirone est un inhibiteur de l’enzyme cible 11β hydroxylase qui
entraine une diminution de la cortisolémie, entrainant une augmentation de l’ACTH et une stimulation
des corticossurénales.
On donne 4,5 g de métopirone en 6 prises (toutes les 4h) et on prélève sang et urines (J0, J1, J2) : des
17 corticostérone et des 17 hydroxycorticostérones..
1.3) Pathologies
1.3.1) HYPERCORTICISMES
Excès de cortisol dans la circulation sanguine.
Souvent due à un apport exogène secondaire à la prise de corticoïdes de synthèse.
a) Hypercorticisme périphérique (primaire).
Hypersécrétion de cortisol par les corticosurrénales, liée à l’atteinte de la CS,
essentiellement tumeurs au niveau de la CS.
- Tumeurs bénignes : adénome = syndrome de Cushing : c’est une affection qui siège au
niveau de la CS → ↑ cortisol plasmatique et ↓ libération d’ACTH plasmatique par FB(-).
- Tumeur maligne : adénocarcinome.
Cliniquement : on a
• Prise de poids avec répartition anormale des graisses (Obésité facio-tronculaire)
résistante à la restriction.
• amyotrophie des membres : aspect grêle des membres inférieurs contraste avec
l’obésité facio-tronculaire,
• HTA souvent modérée.
• Fragilité cutanéo-capillaire : ecchymoses en l’absence de traumatisme, vergetures
abdominal et à la racine du membre supérieur,
• Atrophie cutanée et sous cutanée : lenteur de cicatrisation.
• Troubles de règles (aménorrhées) due à l’effet freinateur des glucocorticoïdes sur
la sécrétion de LH FSH.
• hirsutisme, acné avec séborrhée virilisation (Signes d’hyperandrogénie)
• Problèmes osseux (ostéoporose avec fracture spontanées)
• Signes psychiques : dépression et états d’agitation
• Intolérance au glucose voire diabète
Exploration :
- Dosage hormonaux :
• Cortisol à 8h : Cortisolémie ↑
• ACTH basse,
• CRH diminuée
• Rupture du rythme circadien
→ Si dosage impossible on fait :
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 17
Faculté de Médecine d’Alger Année universitaire 2020/2021
• Dosage des catabolites urinaire 17αOH stéroide : élevés et 17 cétostéroide.
• Dosage cortisol urinaire libre (CLU) : augmenté (4 X la limite sup de la normale)
• En cas douteux on fait des tests dynamiques :
- Test de freination :
* Test à la métopirone : négatif. La métopirone ne freine pas la libération du cortisol.
* Test à la dexaméthasone : positif.
- Dosages non hormonaux:
• Hypokaliémie, Hyperglycémie, Hypercalciurie
• Dyslipidémie.
b) Hypercorticisme central (secondaire).
Atteinte hypothalamo-hypophysaire
- Maladie de Cushing : tumeur siégeant au niveau de l’antéHp (adénome
corticotrope).
- Hypercorticisme ACTH-dépendant:
• Hyperplasie bilatérale des surrénales
• Cliniques : Mêmes signes d'hypercorticisme décrit plus haut +
Mélanodermie : pigmentation cutanée et muqueuse non uniforme (acquise, d’apparition retardée)
Remarque : la: Mélanodermie se voit aussi au cours de l’hypocorticisme Iaire
Noter que :
Quand l’ACTH est d’origine hypophysaires :
- La maladie de Cushing est due à un adénome corticotrope.
- Se voit chez les femmes jeunes dans 80% des cas.
Quand l’ACTH est d’origine ectopique (rare):
- Produite par une tumeur non hypophysaire.
Exploration :
- ↑ cortisol plasmatique due à l’↑ de l’ACTH plasmatique.
- Taux du cortisol urinaire (CLU) est augmenté
- Rupture ou perte du rythme circadien de sécrétion CLU est augmenté
Tests dynamique :
- Tests de stimulation : *Test au synacthène : (+)
- Tests de freination :
*Test à la Dexaméthasone :
- si Hypercorticisme Iaire : test (+), ACTH ↓
- si Hypercorticisme IIaire : test (-), ACTH ne baisse pas.
*Test à la métopirone : (+) réponse normale de la CS, le cortisol ↓ et ↑↑↑ de l’ACTH (diagnostic
de l’étage).
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 18
Faculté de Médecine d’Alger Année universitaire 2020/2021
1.3.2) HYPOCORTICISMES (Insuffisance surrénalienne chronique)
a) Hypocorticisme primaire = insuffisance primitive de la CS
*Etiologies :
- Insuffisance surrénalienne chronique = Maladie d’ADDISON, destruction de la glande
- Hypocorticisme d’origine iatrogène exemple : médicaments (corticoïdes à long court).
- Autres causes : certains déficits enzymatiques empêchant la synthèse du cortisol.
Exemple : déficit en 21αOHase, déficit en 11βOHase ou déficit en 17αOHase,
= Hypocorticisme congénital par déficit enzymatique → ACTH ↑↑
* Clinique :
- Hypotension orthostatique
- Asthénie d’effort en fin de journée
- Asthénie psychique et sexuelle
- Amaigrissement progressif
- Mélanodermie (aspect de taches brunes sur les zones découvertes, cicatrices et plies
palmaires hyperpigmentées,)
- Troubles digestifs de type anorexie, nausées et constipation
- Appétence pour le sel
- Hypoglycémies (malaises)
- Douleurs articulaires et musculaires.
*Exploration :
- Dosage des dérivés urinaires : 17αOHstéroides ↓ et 17cétostéroides ↑.
- Test au synacthène : (-) (glande détruite).
b) Hypocorticisme secondaire (hypophysaire) = central
Cortisol ↓, dérivés urinaires ↓
*Exploration : Test de stimulation :
- Test au synacthène : (+) → cortisol va↑.
- Test à la CRH : (-) (atteinte IIaire, l’Hp ne répond pas)
c) Hypocorticisme tertiaire (Hypothalamus) = central
- même tableau
- Causes : lésion de l’Ht d’origine traumatique, tumorale, ……….
*Exploration : Test de stimulation :
- Test à la CRH : (+).
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 19
Faculté de Médecine d’Alger Année universitaire 2020/2021
2/ ALDOSTERONE
2.1) Etude de l’aldostérone
a) Lieu de biosynthèse :
- Couche glomérulée de la CS
- Série d’hydroxylation de la P4 ,trois hydroxylations pour aboutir à l’aldostérone :
*21OHylation →DOC
*β11OHylation →Composé B
*18αOHylation →18αOHCorticostérone
Desmolase 3βOH ∆5-∆4 isomérase 21α OHase 11β OHase
Cholestérol P5 P4 21αOHP4 11β, 21α diOHP4
(C27) Mitoch Cyto Cyto (11 β Mitoch (corticostérone =
Désoxycorticostérone composé B)
DOC)
18α OHase 18α Déshydrogénase(Réductase)
18αOHCorticostérone Aldostérone
Mitoch
L’aldostérone plasmatique se trouve essentiellement s/f hémiacétalique (forme chimique majoritaire).
b) Formes circulantes
L’aldostérone à une concentration plasmatique = 100- 400 ng/l
Cette concentration varie selon la position de l’individu (debout, assisse, ou
coucher). Les 2/3 de l’aldostérone se trouvent liés et 1/3 libre.
c) Protéines de transport
1°) CBG : Cortisol Binding Globulin = Transcortine
Transporteur non spécifique
2°) Albumine
Non spécifique.
d) Catabolisme
Comparable à celui du cortisol
Consiste en une série de réduction (déshydrogénation)
Etapes :
1. Sur C5 → dérivé dihydrogéné = 5βdihydroaldostérone
2. Sur C3 → dérivé tétrahydrogéné = 3α5β tétraaldostérone = catabolite majeur
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 20
Faculté de Médecine d’Alger Année universitaire 2020/2021
e) Régulation de la libération de l’aldostérone
La libération de l’aldostérone est régulée principalement par le système rénine Ŕ
angiotensine (système le plus important), la volémie et par la kaliémie.
L’aldostérone exerce un rétrocontrôle négatif sur la libération de rénine.
Système rénine Ŕangiotensine
* Rénine : enzyme synthétisé au niveau des cellules endothéliales de l’artériole afférente (appareil
juxtaglomérulaire),
Catalyse la transformation de l’angiotensinogène en angiotensine I
Constitue l’étape limitante de la synthèse de l’angiotensine
Les facteurs de sécrétion de la rénine :
1. baisse de la perfusion au niveau de l’artériole afférente
2. stimulation des fibres β adrénergiques
3. variation de la composition électrolytique de l’urée (Na+, K+, H+…) au
niveau du tube proximal.
*Angiotensine = protéine synthétisée au niveau du foie, sa biosynthèse est stimulée par les
œstrogènes et le cortisol, son PM= 50 KD).
Rénine agit sur l’angiotensine en libérant un décapeptide du côté C-terminal, on obtient alors
l’angiotensine I (inactive) qui subit au niveau du cerveau une conversion grâce à l’enzyme
angiotensine convertase, d’où libération de 2aa, on obtient l’angiotensine II active, cette dernière va
agir au niveau (action vasoconstrictrice) :
- de la CS → sécrétion de l’aldostérone par la couche glomérulée
- de la paroi vasculaire → entrainant une vasoconstriction.
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 21
Faculté de Médecine d’Alger Année universitaire 2020/2021
f) Action de l’aldostérone libre et tissus cibles
-Aldostérone agit essentiellement au niveau du rein (TCD) en favorisant la
réabsorption de Na+ contre élimination de K+. Quelquefois il y’a échange entre Na+ et H3O+ (d’où
acidité urinaire ↑) Effet hypernatrémiant
- Aldostérone agit sur la volémie d’où sa participation au maintien de la pression
artérielle. (L’hypo volémie= facteur de stimulation de libération de la rénine). Effet hypertenseur.
- Tissus cibles : aldostérone agit sur plusieurs tissus ou épithéliums sécréteurs :
1) sur épithélium ou muqueuse intestinale → absorption de Na+ contre fuite de K+
2) aussi sur l’épithélium des glandes salivaires, sudoripares et lacrymales.
Aldostérone possède l’activité minéralcorticoïde la plus puissante.
g) Effecteurs de l’aldostérone
*Facteurs de stimulation de l’aldostérone :
- Chute de Na+ (hyponatrémie) → ↑ production de l’aldostérone → réabsorption Na+
- ↑ de K+ (hyperkaliémie) → ↑ production de l’aldostérone → élimination K+
- ↑ de l’ACTH → stimulation transitoire (qq jours)
- Hypovolémie
- grossesse : ↑ production de l’aldostérone
*Facteurs inhibiteurs de la synthèse de l’aldostérone
- Les antialdostérones naturels : P4 et la 17αOHP4
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 22
Faculté de Médecine d’Alger Année universitaire 2020/2021
- Molécules synthétiques : spironolactones, fixation sur les récepteurs de l’aldostéones (TCD)
- Autre facteur inhibant la synthèse de l’aldostérone, on a le FNA (facteur Natriurétique
Atrial) = ANP (Atrial Natriuretic Peptid)= ANF (Atrial Natriuretic Factor).
2.2) Exploration
a) Exploration statique :
Les conditions de prélèvement doivent être rigoureuses :
- Régime normosodé au moins sept jours avant l’analyse
- Suppression des laxatifs et diurétiques ( 6 semaines pour spironolactone, et 4 pour les
autres).
- Patient au repos.
Dosage de l’aldostérone plasmatique : elle se fait par radio-immunologie
Valeurs usuelles :
- Sujet couché : 30 à 300 pmol/l
- Sujet debout : 100 à 850 pmol/l
Activité Rénine plasmatique (ARP)
Méthode radioimmunologique utilisant l’angiotensinogène
Dosage hormonaux statiques en régime normosodé
Urinaires : Aldostérone : c20- 40 nmol/24h ;
Tétrahydroaldostérone : 80 -120 nmol/24h.
Plasmatiques : Aldostérone : mesure le matin à jeun (cycle circadien) en décubitus dorsal
strict depuis au moins une heure.
Rénine plasmatique (RP) :
- Rénine basse + aldostérone élevée : Hyperaldostéronisme primaire.
- Rénine élevée + aldostérone élevée : Hyperaldostéronisme secondaire.
- Rénine élevée + aldostérone basse: Hypoaldostéronisme primaire (insuffisance
surrénale).
- Rénine basse + aldostérone basse: Hypoaldostéronisme secondaire (rare).
b) Tests ou explorations dynamiques
a) Test de stimulation de l’aldostérone :
- Soit par test au synacthène
- Soit par administration des diurétiques
- Soit par régime désodé
- Soit par changement de position
- On peut injecter du K+ ou donner de l’angiotensine II.
Deux cas peuvent se présenter :
- les tests de stimulation sont (-) → hypoaldostéronisme Iaire
- les tests de stimulation sont (+) → hypoaldostéronisme IIaire
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 23
Faculté de Médecine d’Alger Année universitaire 2020/2021
- Test au synacthène (stimulation par l’ACTH) : après injection en IM de 0,25mg de Synacthène le
taux plasmatique de l’aldostérone s’élève de 3 à 5 fois au-dessus de son niveau de base en 30 min.
cette épreuve permet d’éliminer rapidement l’hypothèse d’un déficit en minéralocorticoides.
- Stimulation par régime sans sel : après 5 jours d’un régime apportant 0,3 mmol/kg de Na+/ j , on a
une miltiplication par 3 ou 4 des taux de base de l’aldostérone plasmatique ou urinaire par rapport au
régime de controle (3 mmol/kg de Na+/ j). un même effet de stimulation peut être obtenu par
l’administration d’un diurétique (80mg de furosémide) avec mesure de l’aldostérone plasmatique 3
heures après : forte augmentation chez le sujet normal.
- Stimulation par l’orthostatisme : le passage de la position couchée à la position debout permet de
juger de l’adaptation de la surrénale à son système de commande. Sécrétion autonome de la
glomérulée, adaptation de l’appareil vasculaire.
b) Test de freination de l’aldostérone
- Charge sodique : régime hypersodé 200mEq/l pendant 2 à 3 j.
Ou perfusion de sérum salé → inhibition de sécrétion d’aldostérone.
- Expansion volémique (freinage court) : hypervolémie par perfusion de soluté
isotonique (glucose 5%)
- Test à la Fluorohydrocortisone (freinage long)
- Test à l’ANP inhibiteur physiologique de libération de l’aldostérone.
Deux cas peuvent se présenter :
- Test de freination (-) → hyperaldostéronisme Iaire
- Test de freination (+) → hyperaldostéronisme IIaire.
- Freinage court : l’expansion volémique provoquée par la perfusion IV de 2 litres de NaCl à 9
pour1000 en 4 heures provoque un abaissement de l’aldostérone plasmatique.
- Freinage long : l’administration d’une forte dose de 9 alpha- Fluorohydrocortisone (un puissant
minéralocorticoide de synthèse (400µg/J/3J) provoque également, en l’absence de tumeur sécrétant de
l’aldostérone, un abaissement profond de ce stéroïde.
L’état cardiovasculaire du malade devra être pris en compte avant la réalisation de ces 2 dernières
épreuves. En pratique, le test dynamique le plus utilisé est le test à l’orthostatisme.
2.3) Pathologies
2.3.1) Hyperaldostéronisme
a) Hyperaldostéronisme Iaire :
*Etiologies :
- Tumeur bénigne ou maligne siégeant au niveau de la CS hypersécrétante en aldostérone seul.
- Atteinte simultanée avec hypersécrétion en aldostérone, cortisol et androgènes surrénaliens
= SYNDROME DE CONN
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 24
Faculté de Médecine d’Alger Année universitaire 2020/2021
- Maladie de la Fasciculée : blocage enzymatique de la voie de biosynthèse du cortisol (déficit en
17αOHy lase)
*Exploration
Faire ionogramme sanguin et urinaire (Na+, K+)
-Natrémie normale : au cours de l’hyperaldostéronisme chronique la natrémie reste normale cela
est dû à la désensibilisation du rein à l’aldostérone.
- Natriurie normale
- Hypokaliémie, Hypokaliurie
- Dosage de l’aldostérone plasmatique par radioimmuno ou Immunoenzymologie. Chiffres élevés
- Dosage de catabolites majeurs urinaires de l’aldostérone (dérivés tétrahydrogénés de
l’aldostérone)
- Test de freination à l’ANP : (-)
- Activité rénine plasmatique (ARP) : basse.
b) Hyperaldostéronisme IIaire :
*Etiologies :
- Hyperaldostéronisme lié à une hypovolémie :
.Cirrhose hépatique .Syndrome néphrotique .Insuffisance cardiaque
- Hyperrénénisme (hypersécrétion de rénine suite à une diminution de la volémie) : soit cause
tumorale, soit stimulation chronique des fibres β adrénergique.
- Insuffisants rénaux dialysés → Hyperkaliémie → Hyperaldostéronisme
- Fuite exagérée de sodium (fistules digestives) → Hyperaldostéronisme
- Anomalie vasculaire en particulier restriction de l’artériole rénale →↑ ARP →
Hyperaldostéronisme II.
* Exploration
- ARP élevée
- Test de freination (+).
2.3.2) Les Hypoaldostéronismes
a) Hypoaldostéronismes Iaire :
*Etiologies :
- Génétique : déficit en 18α OHase, en 21 α OHase, ou déficit en 11βOHase.
- Lésionnelle : destruction de la CS.
Maladie d’ADDISON= Insuffisance surrénalienne chronique.
Autres hormones de la CS comme le cortisol vont chuter, mais de l’aldostérone
est plus importante. Au cours de la Maladie d’Addison la destruction de la CS est due soit à
Une cause infectieuse (tuberculose) Ou à une cause autoimmune.
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 25
Faculté de Médecine d’Alger Année universitaire 2020/2021
*Exploration
- Ionogramme (sg, Urine) : Hyponatrémie, Hypernatriurie
Hyperkaliémie, Hypokaliurie.
- [Aldostérone] est en baisse
- Aldostérone Urinaire libre bas
- Dérivés tétrahydrogénés conjugués bas
- ARP est ↑ (par FB positif)
- Tests de stimulation sont (-)
b) Hypoaldostéronismes IIaire :
- Insuffisance rénale et certaines tubulopathies : on a une baisse de la production de la rénine→
Hyporénénisme → ARP en baisse → Hypoaldostéronisme
- Atteinte hépatique (insuffisance hépatique sévère) l’angiotensinogène en baisse, Diagnostic :
par test de stimulation à l’angiotensinogène II.
- Neuropathie périphérique (atteinte des fibres β adrénergique) → absence de stimulation
adrénergique → pas de rénine → pas d’angiotensine I → pas d’aldostérone.
3/ ANDROGENES
On compte 5 molécules androgéniques :
1) Testostérone (Te)
2) Androstènedione (∆4)
3) Déhydroépiandrostènedione (DHEA)
4) Sulfatedéhydroépiandrostènedione (S-DHEA)
5) 11βOH androstènedione.
Etudes des Androgènes
a) Biosynthèse
Cholestérol(C27) P5 (C21) P4 (C21)
Lieu de synthèse des Androgènes : 2 origines
- Testicules (2 voies ∆5 et ∆4)
- Couche réticulée de la CS (2 voies ∆5 et S-∆5)
* Origine de la testostérone (Te)
Au niveau des testicules la Te est obtenue à partir de la ∆4 grâce à une oxydo-réductase (O-R) :
la 17βOHdéshydrogénase.
∆4 Te 5αDihydrotestostérone (5αDHT)
17βOHdéshydrogénase 5α réductase
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 26
Faculté de Médecine d’Alger Année universitaire 2020/2021
La Te est active au niveau du muscle, au niveau des cellules cibles elle n’est qu’une
préhormone.
Elle pénètre dans ces cellules pour être transformée en hormone active, la 5αDHT grâce à la
5α réductase,
Origine de la testostérone plasmatique :
Chez l’Homme : 95% provient des testicules
5% liés à la production périphérique (muscle, ……).
Chez la Femme : 15% provient des Ovaires
85% liés à la production périphérique.
Noter que les androgènes surrénaliens sont moins actifs que les androgènes testiculaires.
Exploration :
S-DHEA ou sulfate de déhyroépiandrogène, principale forme circulante liée à l’albumine.
Technique d’exploration : immunodosage, surtout la chromatographie liquide couplée à la
spectrométrie de masse (LC/MS).
S-DHEA :
- Chez la femme :
< 10ans : 0,06 à 7,7µ mol/L
11 Ŕ 20 ans : 1,4 à 11,5 µ mol/L
21 Ŕ 50 ans : 1 à 11,5 µ mol/L
> 50 ans : 0,5 à 5,5 µ mol/L
- Chez l’homme :
< 10ans : 0,08 à 4,0µ mol/L
11 Ŕ 20 ans : 1,2 à 7,9 µ mol/L
21 Ŕ 50 ans : 2 à 14,3 µ mol/L
> 50 ans : 1 à 11,2 µ mol/L
Androstènedione ou ∆4
Provient de la sécrétion surrénalienne (30 Ŕ 40%) ou ovarienne (40 Ŕ 60%) et pour une faible
part (5 Ŕ 10%) de la conversion périphérique de la DHEA.
Précurseur immédiat à la fois de la testostérone et de l’œstrone pouvant être ensuite tous les 2
converti en œstradiol au niveau périphérique.
Marqueur de la biosynthèse des androgènes (faible efficacité)
Méthode de dosage : immunodosage I125
Prélèvement effectué sur sérum de préférence.
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 27
Faculté de Médecine d’Alger Année universitaire 2020/2021
Bibliographie
Biochimie clinique. DENIS DORE. Editeur Groupe Modulo Incorporated.1994
Biochimie clinique. PIERRE METAIS. Edition Simep. 1988.
Biochimie Médicale physiopathologie et diagnostic William J. Marshall et Stephen K. Bangert.
Elsevier 2005
Guide pratique des analyses médicales. PASCAL DIEUSAERT. 5ème Edition. Malouine 2009.
Layachi C. Exploration biochimique de la corticosurrénale. Site de l’université de Rabat.
Beaudaux J.L, Durand G Biochimie Clinique Marqueurs actuels et perspectives. 2ème Edition.
Medecine Sciences.
Duron F. Cours endocrinologie. Université Pierre et Marie Curie.
Pathologies surrénaliennes. http : //www.memobio.fr.
The Journal of Clinical Endocrinology &Metabolism, Vol 93, issue 4, pages 1105 Ŕ 1120, 2008.
Cain DW, and Cidlowski JA (2017) Immune regulation by glucocorticoids. Nat Rev Immunol 17:233Ŕ
247.
Ben-David S, Zuckerman-Levin N, Epelman M, Shen-Orr Z, Levin M, Sujov P, and Hochberg Z
(2007). Parturition Itself Is the Basis for Fetal Adrenal Involution. J Clin Endocrinol Metab 92:93Ŕ97.
Miller WL, and Bose HS (2011) Early steps in steroidogenesis: intracellular cholesterol trafficking.
Thematic Review Series: Genetics of Human Lipid Diseases. J Lipid Res 52:2111Ŕ2135.
Monkhouse WS, and Khalique A (1986) The adrenal and renal veins of man and their connections
with azygos and lumbar veins. J Anat 146:105Ŕ115.
Nishiyama A, and Kim-Mitsuyama S (2010) New Approaches to Blockade of the ReninŔAngiotensinŔ
Aldosterone System: Overview of Regulation of the ReninŔAngiotensinŔAldosterone System. J
Pharmacol Sci 113:289Ŕ291.
BIOCHIMIE CLINIQUE. Hormones Corticosurrénaliennes. Pr D.H.DJOGHLAF Page 28
Vous aimerez peut-être aussi
- Surrénales: Les Grands Articles d'UniversalisD'EverandSurrénales: Les Grands Articles d'UniversalisPas encore d'évaluation
- Glande SurrénaleDocument4 pagesGlande SurrénalehichemPas encore d'évaluation
- Pfe Declencheurs Du Cortisol 2Document25 pagesPfe Declencheurs Du Cortisol 2aymane2002elfinouPas encore d'évaluation
- Les Hormones Steroides NewDocument52 pagesLes Hormones Steroides NewSabrina KoufiPas encore d'évaluation
- Ontogenèse de La Sécrétion Des Hormones Stéroïdes Pendant LaDocument13 pagesOntogenèse de La Sécrétion Des Hormones Stéroïdes Pendant LaaissaPas encore d'évaluation
- TD2 EndocrinoDocument2 pagesTD2 EndocrinoMoussaoui KhouiraPas encore d'évaluation
- Hormonologie Reproduction Août 2014Document20 pagesHormonologie Reproduction Août 2014Alex BiguetPas encore d'évaluation
- Le Système EndocrinienDocument7 pagesLe Système Endocrinienbendifmr94Pas encore d'évaluation
- 1-Generalites en EndocrinoDocument21 pages1-Generalites en EndocrinobasassynenedianePas encore d'évaluation
- 1-Generalites en Endocrinologie PDFDocument21 pages1-Generalites en Endocrinologie PDFthierno amadou bahPas encore d'évaluation
- Physio Endocrine PDFDocument80 pagesPhysio Endocrine PDFPascal KaseroPas encore d'évaluation
- Cours D'histologie: Mme EL Lemdani 2022/2023Document37 pagesCours D'histologie: Mme EL Lemdani 2022/2023oumaima hannachiPas encore d'évaluation
- Chapitre 1 Et 2 HistologieDocument74 pagesChapitre 1 Et 2 HistologieinesPas encore d'évaluation
- Cours Histologie Glandes Endocrines 1Document3 pagesCours Histologie Glandes Endocrines 1Dany MelPas encore d'évaluation
- Glande Surrénale - WikipédiaDocument5 pagesGlande Surrénale - Wikipédiaothmane zohryPas encore d'évaluation
- Cours Physiologie S4 2017Document62 pagesCours Physiologie S4 2017Narciso RodriguezPas encore d'évaluation
- Antidote PhysioDocument47 pagesAntidote PhysioIkapiklevice15Pas encore d'évaluation
- 2-Cortex Surrenalien 01 Février 2014Document99 pages2-Cortex Surrenalien 01 Février 2014hanane elPas encore d'évaluation
- 1-Physiologie Du Système EndocrinienDocument8 pages1-Physiologie Du Système EndocrinienNateche NassiraPas encore d'évaluation
- 2 Cours ThyroideDocument11 pages2 Cours ThyroideLem AhPas encore d'évaluation
- Physio Endocrine Revise 2019Document78 pagesPhysio Endocrine Revise 2019mbusaPas encore d'évaluation
- 01 - Axe HypothalamoDocument10 pages01 - Axe Hypothalamokilo Romeo23Pas encore d'évaluation
- Physiocoeur - UPC - 2012-2 2Document96 pagesPhysiocoeur - UPC - 2012-2 2Sabrina MubengaPas encore d'évaluation
- Cours EM Fusionné 2020Document99 pagesCours EM Fusionné 2020Serge Mbainoudji TendoPas encore d'évaluation
- 1-Physiologie Endocrinienne Generalites en EndocrinologieDocument102 pages1-Physiologie Endocrinienne Generalites en EndocrinologieAfdal BiosicaPas encore d'évaluation
- Poly S1 PCEM2 2020Document113 pagesPoly S1 PCEM2 2020pvfbszf9mtPas encore d'évaluation
- Corticosurrénale 2018 PolyDocument19 pagesCorticosurrénale 2018 PolyHerby BayoliPas encore d'évaluation
- Anatomie 1Document45 pagesAnatomie 1anajaryassine93Pas encore d'évaluation
- Table Des Matieres: Organisation Du Systeme Vivant: Anatomie-Physiologie 2-4Document95 pagesTable Des Matieres: Organisation Du Systeme Vivant: Anatomie-Physiologie 2-4N'driPas encore d'évaluation
- TD1 Regulation SABRINA.2019Document5 pagesTD1 Regulation SABRINA.2019axelPas encore d'évaluation
- Anatomie Et Cytologie Pathologie 6Document9 pagesAnatomie Et Cytologie Pathologie 6Bah LandryPas encore d'évaluation
- 25 26 27 HormonesDocument138 pages25 26 27 HormonesVicaCosteţchiPas encore d'évaluation
- ThyroideDocument11 pagesThyroidebencheikhkaouther0Pas encore d'évaluation
- Le Système EndocrinienDocument23 pagesLe Système Endocrinienchadi ouechtatiPas encore d'évaluation
- Cours de Génomique, Master BH, S1, DR OKON, 2020-2021Document34 pagesCours de Génomique, Master BH, S1, DR OKON, 2020-2021KONAN ABO PHILEMON ARONOUPas encore d'évaluation
- UE8 TC Physio Cours 2 - Régulation Endocrinienne Tutorat 2013-2014Document10 pagesUE8 TC Physio Cours 2 - Régulation Endocrinienne Tutorat 2013-2014Ali EL Kihel100% (1)
- L'Hygiène Des MainsDocument15 pagesL'Hygiène Des Mainsayadi ayaPas encore d'évaluation
- 1.système EndocrinienDocument31 pages1.système EndocrinienSid ahmed Zerrouki sbaPas encore d'évaluation
- Hormones Thyroïdiennes PDFDocument38 pagesHormones Thyroïdiennes PDFNazim LmcPas encore d'évaluation
- 1 Principes Du Système de Contrôle Hormonal BDocument61 pages1 Principes Du Système de Contrôle Hormonal BOXGAMINGXOPas encore d'évaluation
- Cours - 3 Les Régulation Hormonale de La MétabolismeDocument9 pagesCours - 3 Les Régulation Hormonale de La Métabolismemiss anthropocenePas encore d'évaluation
- 2 - Epithelium Glandulaire 23aDocument15 pages2 - Epithelium Glandulaire 23aMey ZPas encore d'évaluation
- 12 PeroxysomesDocument5 pages12 PeroxysomesImen Mestar100% (1)
- 4 - BDR - Physiologie, Régulation Et Signalisation de L'axe Gonadotrope Masculin (Partie 1)Document26 pages4 - BDR - Physiologie, Régulation Et Signalisation de L'axe Gonadotrope Masculin (Partie 1)Hay LinPas encore d'évaluation
- Syllabus Physiologie Endocrinienne 2017-18Document58 pagesSyllabus Physiologie Endocrinienne 2017-18Johnathan ILUNGA100% (1)
- Introduction Au Corps HumainDocument22 pagesIntroduction Au Corps HumainInas Hassanat100% (1)
- Physiologie - Glandes - SurrenalesDocument41 pagesPhysiologie - Glandes - SurrenalesChokri MAKTOUF100% (1)
- 3-Polycope BiochClin - Part 3-DDocument28 pages3-Polycope BiochClin - Part 3-Dcabinetelmrinihafsa1Pas encore d'évaluation
- Complexe SurrenalienDocument2 pagesComplexe Surrenalienzenmehdi04Pas encore d'évaluation
- Hormonologie Reproduction Juin 2014Document20 pagesHormonologie Reproduction Juin 2014Alex BiguetPas encore d'évaluation
- Cours Dendocrinologie 2021-2022 - Partie 1Document32 pagesCours Dendocrinologie 2021-2022 - Partie 1carineyenkeyPas encore d'évaluation
- Universite Saad Dahleb Faculte de Medecine 2 Annee Medecine Cours de BiochimieDocument9 pagesUniversite Saad Dahleb Faculte de Medecine 2 Annee Medecine Cours de BiochimieDîãmønd QùeenPas encore d'évaluation
- Chapitre1 Cycle CellulaireDocument17 pagesChapitre1 Cycle CellulaireEnnassiki Med EnnassikiPas encore d'évaluation
- SteroidesDocument8 pagesSteroidesSafae MaaroufPas encore d'évaluation
- Système EndocrinienDocument22 pagesSystème EndocrinienngoufacktsougmoPas encore d'évaluation
- Chapitre 1 - Généralités HistologieDocument9 pagesChapitre 1 - Généralités HistologieFernando KollaPas encore d'évaluation
- GLANDES SURRÉNALES22-23-Version LibreDocument7 pagesGLANDES SURRÉNALES22-23-Version LibreLoubna KaouachiPas encore d'évaluation
- Cours N°1d'endocrinologie S4 2020Document32 pagesCours N°1d'endocrinologie S4 2020Younes Masoud100% (1)
- EndocrinologieDocument43 pagesEndocrinologiePierre MonharoulPas encore d'évaluation
- GLANDES ENDOCRINES 2Document37 pagesGLANDES ENDOCRINES 2NAIBAN TONGAPas encore d'évaluation
- 15 Enzyme AllosteriqueDocument31 pages15 Enzyme Allosteriquemina ycPas encore d'évaluation
- 24 Eab Residents 2021Document80 pages24 Eab Residents 2021mina ycPas encore d'évaluation
- Hypoglycmie 2013Document1 pageHypoglycmie 2013mina ycPas encore d'évaluation
- Hypoglyémies RéactivesDocument3 pagesHypoglyémies RéactivesHenry TraoréPas encore d'évaluation
- Dysfonctionnement Du Cycle Cellulaire Et PathologiesDocument20 pagesDysfonctionnement Du Cycle Cellulaire Et Pathologiesmina ycPas encore d'évaluation
- Acide UriqueDocument5 pagesAcide Uriquemina yc100% (2)
- Thèse À ImprimerDocument154 pagesThèse À ImprimerEL Hassania EL HERRADIPas encore d'évaluation
- Comment Suivre Un Nouveau ConvertiDocument15 pagesComment Suivre Un Nouveau Convertiben tshikendaPas encore d'évaluation
- موضوع اختبار الفصل الثالث -اللغة الفرنسية -الأولى ثانوي آداب وفلسفة-2Document2 pagesموضوع اختبار الفصل الثالث -اللغة الفرنسية -الأولى ثانوي آداب وفلسفة-2azoug.karim01Pas encore d'évaluation
- Lanista RPGDocument32 pagesLanista RPGWanda Von DunajevvPas encore d'évaluation
- Cours de Biophysique Eqiulibre de Donnan Phénomènes de SurfaceDocument5 pagesCours de Biophysique Eqiulibre de Donnan Phénomènes de SurfaceSmail AazzaPas encore d'évaluation
- Etat Des Unités IndustriellesDocument7 pagesEtat Des Unités Industrielleshama abdoulaye diallo aboubacar100% (2)
- 3 Les Modèles Systémiques de La Pensée CommunicationnelleDocument3 pages3 Les Modèles Systémiques de La Pensée CommunicationnelleIbrahim Bekkali100% (1)
- Droit de La Responsabilité Civile S3 - PR AQABLI - 1Document24 pagesDroit de La Responsabilité Civile S3 - PR AQABLI - 1mellouki.ayoubPas encore d'évaluation
- Catalogue ChaussuresDocument62 pagesCatalogue ChaussuresSERATPas encore d'évaluation
- 20220212000935Document255 pages20220212000935Said BabaciPas encore d'évaluation
- CV Sahbani Taher FraDocument3 pagesCV Sahbani Taher FrataherPas encore d'évaluation
- Catalogue Picasso CafeDocument26 pagesCatalogue Picasso CafeAbderrahmane EssaouriPas encore d'évaluation
- Organigramme-2Document3 pagesOrganigramme-2Abdel Motaleb AL-SaadyPas encore d'évaluation
- Wittfogel Le Despotisme OrientalDocument712 pagesWittfogel Le Despotisme Orientalzaadig100% (1)
- Lettre de MotivationDocument2 pagesLettre de MotivationGabriel ValtchevPas encore d'évaluation
- Gabion ÉlectrosoudésDocument1 pageGabion ÉlectrosoudésLouis JacquesPas encore d'évaluation
- Centrale Tsi2019pc2e 1Document6 pagesCentrale Tsi2019pc2e 1سامي لمرابط Sami MrabetPas encore d'évaluation
- Merise 1 Csi Ida1Document65 pagesMerise 1 Csi Ida1maurian seuPas encore d'évaluation
- CV Julia Szanka FRDocument1 pageCV Julia Szanka FRJulija SankaPas encore d'évaluation
- Mésologiques - La Chôra Chez Platon - Augustin BerqueDocument6 pagesMésologiques - La Chôra Chez Platon - Augustin BerquemaxiPas encore d'évaluation
- Autovision Rue Satoris - Recherche GoogleDocument1 pageAutovision Rue Satoris - Recherche GoogleLaurent BerishajPas encore d'évaluation
- Chapitre 9 Les Édifices Chimiques CondensésDocument4 pagesChapitre 9 Les Édifices Chimiques Condensésjean06Pas encore d'évaluation
- 5.3 Correction Des Systèmes AsservisDocument21 pages5.3 Correction Des Systèmes AsservisKeubeng CriyosPas encore d'évaluation
- NF EN 450-1 - Octobre 2005 PDFDocument33 pagesNF EN 450-1 - Octobre 2005 PDFKevin CodjoviPas encore d'évaluation
- DS TW 11mai CorDocument6 pagesDS TW 11mai CorDescartes VergezPas encore d'évaluation
- Partie2 - Java - Bases de ProgrammationDocument49 pagesPartie2 - Java - Bases de ProgrammationimaneshfaraPas encore d'évaluation
- Cahier de Charge AEPDocument60 pagesCahier de Charge AEPRKAM MellecemPas encore d'évaluation
- Tarea 5 de Frances Yoa Intermedio 2Document6 pagesTarea 5 de Frances Yoa Intermedio 2jose limaPas encore d'évaluation
- Notice de Montage Et D EntretienDocument44 pagesNotice de Montage Et D EntretienFarid ChekaliPas encore d'évaluation
- Taxes D'effet Équivalant À Des Droits de Douane 2006Document15 pagesTaxes D'effet Équivalant À Des Droits de Douane 2006berniverPas encore d'évaluation