Académique Documents
Professionnel Documents
Culture Documents
Biochimie Microbienne
Transféré par
sino spagoTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Biochimie Microbienne
Transféré par
sino spagoDroits d'auteur :
Formats disponibles
Biochimie microbienne L3 MICROBIOLOGIE
Page facebook ; Domaine SNV : Biologie,Agronomie,Science Alimentaire,Ecologie
INTRODUCTION
Le métabolisme bactérien est l’ensemble des réactions biochimiques et
physiologiques se déroulant au sein de la bactérie. Il est divisé en deux voies :
• celle impliquée dans la dégradation de substrats avec production d’énergie
• celle impliquée dans la synthèse de nouvelles molécules nécessaires à la
construction de structure bactérienne avec consommation d’énergie
provenant des réactions de dégradation.
L’ensemble de ces réactions est sous le contrôle de catalyseurs biologiques
appelés enzymes.
De l’étude du métabolisme découlent plusieurs applications :
• l’isolement qui peut être défini comme l’ensemencement effectué dans un
but de séparation, de façon à obtenir à partir des colonies nettement
séparées. L’isolement permet d’obtenir des cultures pures indispensables
à toute étude et à toute identification.
• la mise en évidence des besoins nutritifs des bactéries et des voies du
métabolisme qui permettent l’identification conventionnelle des bactéries
(la dégradation du substrat, la synthèse d’un produit final ou
l’intermédiaire du métabolisme)
I METABOLISME BACTERIEN
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 1
Les bactéries ont en général pour source d’énergie des composés organiques
suffisamment réduits pour donner des électrons, qui sont transportés jusqu’à
différents accepteurs :
- oxygène : les électrons sont transportés sur la chaîne des
cytochromes jusqu’à l’oxygène moléculaire (respiration aérobie) ;
- un substrat inorganique oxygéné comme les nitrates (respiration
nitrate), les sulfates (respiration sulfate) , les carbonates (
cytochrome dépendante) ; - un substrat organique oxygéné ou la
chaîne des cytochromes n’intervient pas (fermentation).
La plupart des voies métaboliques produisant de l’énergie par oxydation d’un
substrat organique aboutit au pyruvate ou à l’un de ses précurseurs ou dérivés. Il
s’agit donc d’une plaque tournante du métabolisme bactérien. Le glucose peut
être considéré comme le substrat énergétique type. L’oxydation du glucose peut
être réalisée par trois voies différentes qui peuvent fonctionner en parallèle : ce
sont les voies de la glycolyse, le shunt des pentoses phosphates et la voie
d’Entner Doudoroff qui est spécifique au monde microbien.
I-1 Voie d’Embden –Meyerhoff
Il s’agit de la principale voie de dégradation des glucides. La glycolyse est
l’ensemble des réactions qui oxydent le glucose en pyruvate. Cette chaîne de
réactions a lieu dans le cytosol au niveau des formations membranaires et peut
être réalisée en milieu aérobie et anaérobie.
La glycolyse se divise en deux phases :
- la phase préparatoire où le glucose est transformé en glycéaldehyde
3 P avec consommation d’énergie (phase d’activation)
- la phase de remboursement qui est une oxydoréduction couplée à la
formation d’ATP et de pyruvate.
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 2
NB La formule du glucose
6 CH2OH
5 O
4 OH .1
OH. 3 2 OH
OH
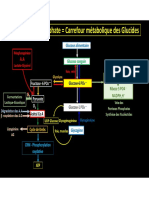
I-1-1 Les différentes étapes de la glycolyse (voir figure I)
• Phosphorylation du glucose en glucose 6 P
Cette réaction est catalysée par l’hexokinase ou le glucokinase. Elle est
irréversible et exergonique.
L’hexokinase est présente dans de nombreux tissus et n’est pas spécifique au
glucose en ce sens qu’elle peut être utilisée pour phosphoryler d’autres oses
(mannose, fructose…).
• Isomérisation du glucose 6 P en fructose 6 P par la
phosphoglucose isomérase
Page facebook ; Domaine SNV : Biologie,Agronomie,Science Alimentaire,Ecologie
Le Glucose 6 P est un carrefour métabolique, le carbone 2 est le seul à avoir un
OH en position axiale ce qui facilite son oxydation. La réaction se fait sans
changement important d’énergie interne. Elle est donc réversible.
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 3
• Phosphorylation du fructose 6 P
La phosphofructokinase catalyse la phosphorylation du fructose 6 P sur son
carbone 1. L’ATP en présence de magnésium est le coenzyme donneur
d’énergie et de phosphate. La réaction est exergonique et irréversible. On obtient
le fructose -1,6-diphosphate
La PFK est l’enzyme la plus lente de la glycolyse. Elle catalyse l’étape
d’engagement des glucides dans le métabolisme énergétique.
Elle est donc l’enzyme clé qui limite la vitesse de l’ensemble.
• Scission du fructose di P en trioses phosphate
L’aldolase, présente dans toutes les cellules, catalyse la scission du fructose 1,6
di P en trioses P.
Les carbones 4, 5 et 6 du fructose 1,6 di P ont donné le phosphoglycéraldéhyde.
Les carbones 1, 2 et 3 donnent la P di OH acétone.
• Isomérisation des trioses phosphates
Les deux trioses phosphates sont des isomères. La transformation du cétose en
aldose est faite par le triose phosphate isomérase qui, comme le phosphohexose
isomérase, catalyse une oxydoréduction interne entre les carbones 1 et 2. Dans
la suite de la glycolyse, seul le phosphoglycéraldéhyde va être utilisé : il y a
conversion de la phospho di OH acétone en 3 P glycéraldéhyde.
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 4
• Oxydation phosphorylante du 3 P glycéraldéhyde en 3 P
glycérate
La phosphoglycéraldéhyde déshydrogénase catalyse l’oxydation du 3 P
glycéraldéhyde. Son coenzyme libre est le NAD oxydé et son substrat est le 3 P
glycéraldéhyde.
En effet, l’enzyme s’attache au substrat par une liaison aldéhyde thiol qui se
trouve déshydrogénée en liaison acyl thiol riche en énergie. L’acide
phosphorique libre intervient alors pour phosphoryler cette liaison et former
l’acide diphosphorique 1, 3 glycérique. Cet acide possède un radical
phosphorique lié par une liaison riche en énergie : il peut être transféré par une
molécule d’ADP pour former une molécule d’ATP grâce à la 3 P glycérate
kinase et ce qui aboutit à l’acide 3 P glycérique.
Page facebook ; Domaine SNV : Biologie,Agronomie,Science Alimentaire,Ecologie
• Isomérisation du 3 P glycérate
La phosphoglycérate mutase transforme le 3 P glycérate en 2 P glycérate. Elle a
pour coenzyme le magnésium.
Le mécanisme est de type ping-pong : l’enzyme phosphorylée au départ
transfère son phosphate sur le 3 P glycérate qui devient 1, 3 DPG et reste lié à
l’enzyme.
Dans un 2ème temps l’enzyme déphosphorylée réagit avec le 1- 3 di P G pour
récupérer son phosphate et libérer le 2 P glycérate. La réaction est presque iso
énergétique et donc réversible.
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 5
• Déshydratation du 2 P glycérate en prosphoénol pyruvate
Cette réaction est catalysée par l’énolase qui utilise comme coenzyme le
magnésium. Elle est inhibée par les ions fluorures. La réaction est réversible.
• Formation du pyruvate
Le Phospho-énol pyruvate est riche en énergie. Le pyruvate kinase catalyse le
transfert direct du radical phosphoryle et de l’énergie sur l’ADP. La grande
quantité de chaleur libérée rend cette réaction irréversible.
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 6
GLUCOSE
ATP Glucokinase ou hexokinase
ADP magnésium
GLUCOSE -6- PHOSPHATE
Phospho-glucose isomérase
magnésium
FRUCTOSE -6- PHOSPHATE
ATP Phospho-fructokinase
ADP magnésium
FRUCTOSE 1,6 -DIPHOSPHATE
Aldolase
PHOSPHO-DIHYDROXY-ACETONE + 3 PHOSPHO-GLYCERALDEHYDE
Triose- phosphate isomérase
3 PHOSPHO-GLYCERALDEHYDE
NAD+ PO4H3
NADHH+ Phospho-glycéraldéhyde déshydrogénase
ACIDE 1,3 DIPHOSPHO-GLYCERIQUE
ADP Phosphpglycérate kinase
ATP magnésium
ACIDE 3 PHOSPHO-GLYCERIQUE
Phosphpglycérate mutase
magnésium
ACIDE 2 PHOSPHO-GLYCERIQUE
H2O Enolase
magnésium
ACIDE PHOSPHO-ENOL PYRUVIQUE
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 7
ADP Pyruvate kinase
ATP Magnésium, potassium
ACIDE PYRUVIQUE
Figure I : LES ETAPES DE LA GLYCOLYSE
I-1-2 Métabolisation de l’acide pyruvique
I-1-2-1Fermentation alcoolique
Chez certains microorganismes, de l’éthanol est formé à partir du pyruvate.
Cette fermentation se fait en 2 temps.
- 1er temps : conversion du pyruvate en acétaldéhyde grâce à la
pyruvate décarboxylase
- 2ème temps : réduction de l’acétaldéhyde en éthanol grâce à un
alcool déshydrogénase.
Pyruvate décarboxylase Alcool déshydrogénase
CH3 – CO - COOH CH3 – CHO CH3 –CH2OH
CO2 NADHH+ NAD+
Figure II : La fermentation alcoolique de l’acide pyruvique
Page facebook ; Domaine SNV : Biologie,Agronomie,Science Alimentaire,Ecologie
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 8
I-1-2-2 Formation du lactate
Le lactate est formé normalement à partir du pyruvate chez divers organismes.
Cette réaction se produit également chez les organismes supérieurs lorsque la
quantité d’O2 est limitée (exemple : travail musculaire intense).
Lactate déshydrogénase
CH3 – CO - COOH CH3 –CHOH - COOH
NADHH+ NAD+
Figure III : La formation du lactate à partir du pyruvate
I-1-2-3 Oxydation du pyruvate en acétyle coenzyme A
Dans certaines conditions aérobies le NADHH+ est réoxydé dans la chaîne
respiratoire mitochondriale. De plus lorsque suffisamment d’O 2 est disponible le
pyruvate peut être oxydé dans la mitochondrie grâce à une décarboxylation
oxydative catalysée par le complexe de la pyruvate déshydrogénase.
I-1- 2-4Transformation de l’acide pyruvate en acide oxalo
acétique
Cette réaction est catalysée par la pyruvate carboxylase
pyruvate carboxylase
CH3 – CO – COOH COOH – CH2 – CO – COOH
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 9
Figure IV: La transformation de l’acide pyruvique en acide oxaloacétique[28]
I-1-3 Bilan énergétique
• En anaérobiose
1.1 GG6P - 1 ATP
F6P F 1,6 di P - 1ATP
1,3 di P glycérate 3 P glycérate +2ATP
P énol Pyruvate pyruvate + 2ATP
Equation globale:
G + 2 NAD+ + 2 Pi + ADP 2 pyruvate + 2 NADHH+ + 2H2O + 2ATP
• En aérobiose
1 glucose + 2 ADP + 2 Pi + 2NAD
+
2 Acide pyruvique + 2 NADHH + ATP
2 NAD+ 2 NADHH+
2 Acétyl COA chaînes respiratoires
cycle de Krebs (2 + 2) x 3 =12 ATP
2 x 12 ATP =24 ATP
Ce qui fait qu’en aérobiose le bilan = 36 ATP
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 10
Le bilan énergétique final est :
1 glucose CO2 + HO2 + 38 ATP
Figure V : Bilan énergétique de la glycolyse
I-1-4 La régulation de la glycolyse
Le cas le plus spectaculaire est vu chez les micro-organismes qui sont aérobies
et anaérobies facultatifs , les levures qui sont transférées d’un milieu sans O 2 à
un milieu oxygéné ont une réduction de 75% de leur glycolyse tout en gardant
constante leur production d’ATP.
La régulation a lieu à deux niveaux :
- Au niveau fondamental : les dernières réactions sont
isergoniques, réversibles et dépendantes des concentrations en substrats
et produits. Un excès de glucose entraîne une augmentation de la
glycolyse et un excès de pyruvate entraîne une diminution de cette
glycolyse.
- Au niveau enzymatique, la régulation est réalisée en trois
étapes :
• Réaction 1 : avec la glycokinase l’excès de produits diminue
la réaction.
• Réaction 3 : la phosphofructokinase est inhibée par l’ATP et
est activée par les substrats (ADP, AMP et Pi).
• Réaction 9 : le pyruvate kinase est aussi inhibé par l’ATP et
est activée par l’ADP, l’AMP et le Pi.
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 11
I-1-5 Rôle des enzymes
Les enzymes jouent le rôle de catalyseurs et vont orienter la réaction d’une
manière bien spécifique.
Les enzymes sont caractérisées par leur rapidité leur spécificité et leur
température.
I-1-6 Rôle des cofacteurs
Les cofacteurs sont des ions inorganiques ou des coenzymes.
Il existe des cofacteurs nicotiniques comme le NAD et le NADP.
Les enzymes à NAD+ sont les accepteurs d’Hydrogène, ils sont stockés dans la
cellule sous forme oxydée par contre les enzymes à NADP + sont des donneurs
d’Hydrogène on les retrouve dans la cellule sous la forme réduite
On a les coenzymes flaviniques comme le FAD dont le rôle est de transporter
l’hydrogène qui provient du NAD sous la forme réduite ou au cours de la
réaction redox.
L’ion magnésium est un activateur qui participe à la stabilité de la structure
tertiaire Exemple : Mg / ATP
L’ATP et l’ADP interviennent dans les phénomènes de phosphorylation et de
déphosphorylation.
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 12
I-2 La voie des pentoses phosphates
C’est la voie de shunt des pentoses, voie des hexoses monophosphates ou
phosphogluconate. La voie a pour siège le foie, les tissus adipeux, la glande
mammaire en lactation et le cortex. Elle va jouer deux rôles essentiels :
- La production du NADPH, H pour la réduction du glutathion
- La production du ribose qui entre dans la constitution des acides nucléiques de
l’ATP de l’ADP et du FAD.
G 6 P + NADP + H2O ribose 5 P + 2 NADPH, H + CO 2
I-2-1 Les différentes étapes
La voie des pentoses phosphates se divise en 2 phases :
une phase oxydative irréversible
une non oxydative réversible
- La phase oxydative
Le glucose 6 phosphate subit une oxydoréduction catalysée par le glucose
6phosphate déshydrogénase pour donner une phosphogluconolactone. Cette
phosphogluconolactone va subir une hydrolyse par une gluconolactonase pour
donner l’acide 6 phosphogluconique.
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 13
Cette dernière subit une autre réaction d’oxydoréduction catalysée par une
phospho-gluconate déshydrogénase, suivie d’une décarboxylation spontanée
pour donner le ribulose 5 phosphate.
- La phase non oxydative
Isomérisation
Cette phase débute par une inter-conversion des pentoses phosphates (ribulose 5
phosphate).
Isomérase épimerase
Ribose 5 P Ribulose 5 (P) xylolose 5P
Transcétolisation
Xylulose 5 P + Ribose 5 P sous l’action de la transcétolase qui transfère un
radical dicarboné (CH2OH – CO) d’un donneur vers un accepteur, donnent le
glycéraldéhyde 3Pet le sédoheptulose 7 P.
Transaldolisation
Glycéraldéhyde 3 P + Sédoheptulose 7 P, sous l’action d’une aldolase qui
transfère un radical tricarboné d’une fonction cétonique sur une fonction
aldéhyde, donne érythrose 4 P et fructose 6 P.
Transcétolisation
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 14
Une deuxième transcétolisation, analogue à la première, catalysée par le même
transcétolase utilise l’érythrose 4 P comme accepteur d’un radical dicarboné,
d’un troisième pentose (xylulose 5 P).
Cette réaction va donner du glycéraldéhyde 3 P et du fructose 6 P.
En résumé la voie des pentoses phosphate aboutit à former donc le même triose
P que la voie glycolytique d’Emden Meyerhof.
Mais ici chaque hexose ne donne qu’un seul triose, et ce triose peut ensuite
entrer dans la voie glycolytique (transformation en acide purivique, en acétyl
coA puis oxydation par le cycle de Krebs).
Mais il peut aussi régénérer le glucose par combinaison de triose P réversible
sous l’action de l’aldolase.
2 Triose P Fructose 1,6 di P Fructose 6 P G6 P
I-2-2 Bilan
G6P + 12 NADP 6CO2 + 12 NADPH,H+ + Pi I-2-3
Intérêt de la voie des pentoses
L’intérêt de cette voie réside, en ce qu’elle est génératrice d’une part : -
de NADPHH+ indispensable aux réactions réductrices de
biosynthèse (en particulier lors de la synthèse des acides gras et des
stéroïdes)
- d’autre part de ribose 5 P : qui est le précurseur de la synthèse des
nucléotides et des acides nucléiques.
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 15
I-2-4 Régulation
La régulation sera assurée par le NADP. Cette NADP est un accepteur
d’hydrogène.
La phase non oxydative va être contrôlée par la disponibilité en substrat.
I-3 La voie d’Entner-Douroroff
Bien que la glycolyse soit la voie la plus commune pour la conversion des
hexoses en pyruvate, la voie d’Entner-Douroroff joue un rôle similaire.
Certaines bactéries utilisent cette voie pour décomposer le glucose en pyruvate
et en glycéraldéhyde P. Ces derniers pourront ensuite être transformés en
éthanol par fermentation alcoolique.
I-3-1 Les différentes étapes de cette voie
- Phosphorylation du glucose
Le glucose, en présence de l’ATP, s’acquiert d’un phosphate pour donner du
glucose P par la glucokinase.
- Formation du 6-Phosphogluconate
Le G6P sous l’action du G-6Pdéshydrogénase et en présence de NADP donne
du 6-phosphogluconate.
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 16
- Formation du 2 céto-3 désoxy phosphogluconate
Le 6- Phosphogluconate perd une molécule d’eau et conduit à la formation du
2céto-3 désoxy phosphogluconate (CDPG).
- Clivage du CDPG
Sous l’action de l’aldolase , le clivage du CDPG donne du pyruvate et du
glycéraldéhyde 3 P ; glycéraldéhyde qui sera converti en pyruvate. Mais
le pyruvate, chez les microorganismes a la particularité de subir une
fermentation pour conduire à la formation de l’éthanol.
I-3-2 Bilan énergétique
La voie d’Entner Doudoroff dégrade donc le glucose en pyruvate et produit un
ATP, un NADPH et un NADH par glucose métabolisé.
On peut avoir également le bilan suivant si le pyruvate est fermenté en éthanol.
Glucose + ADP + Pi CO2 + 2 éthanol + ATP
I-4 Cycle de Krebs
Ce cycle constitue la voie commune terminale à l’oxydation des molécules
énergétiques. Les unités dicarbonées issues de la dégradation de certains
composés organiques tels que les acides gras et les glucides vont être dégradés
au cours du cycle de Krebs.
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 17
Cette oxydation va se faire au niveau de la matrice mitochondriale. Les enzymes
intervenant sont des enzymes solubles dans l’espace matricien. Une seule
exception est la succinite désydrogénase.
I-4-1 Les différentes étapes
1ère étape : condensation irréversible de l’acétyle COA avec AOA
ACETAL- CoEnymeA citrate synthase CoA-SH
+ acide citrique acide Oxalo-
Acétique 2 HO
2ème étape : Isomérisation réversible de l’acide citrique en acide isocitrique
H2O
acide citrique acide Cis Aconitique
aconitase
H2O
Acide iso-Citrique
3ème étape : formation de l’acide α-cétoglutarique (l’isocitrate déshydrogénase est l’enzyme)
+ +
NAD NADHH
Isocitrate Acide oxalo succinique
CO2
Acide α-cetoglutarique
4ème étape : Décarboxylation oxydative de l’acide α-cétoglutarique en succinyl COA , l’enzyme est l’alpha
cétoglutarate déshydrogénase.
NAD+ NADHH+
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 18
Ac-α-cetoglutarique Succinyl COA
HSCOA CO 2
5ème étape : Formation de l’acide succinique ( l’enzyme est le succinyl thiokinase)
COASH
Succinyl COA Acide succinique
GDP +Pi GTP
ATP ADP
GDP
6ème étape : Déshydrogénation de l’acide succinique en acide fumarique
Succinate
acide succinique déshydrogénase Acide fumarique
FAD FADH2
7ème étape : Hydratation de l’acide fumarique en acide malique (l’enzyme est la fumarase)
Fumarate fumarase Malate
H2O
8ème étape : Déshydrogénation du Malate en AOA
malate déshydrogénase
Malate AOA
NAD + NADHH+
Figure VI : Le cycle de Krebs
I-4-2 Bilan et intérêt
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 19
3 NADHH 3 x 3 ATP
1 FADHH 2 ATP
1 GTP 1 ATP
12 ATP
Le cycle de Krebs permet d’obtenir 12 molécules d’ATP
I-4-3 Bilan énergétique
Acétyl CoA + 2H2O + 3 NAD + FAD + ADP + Pi CoASH + 3NADH,H+ + 2 FADH2 + 2 CO2 + ATP
3 NAD 3 x 3 ATP
FAD 2 ATP
GTP 1 ATP
12 ATP
I-4-4 Régulation
Elle est envisageable à plusieurs niveaux :
La 1ère étape catalysée par la citrate synthase à ce niveau on aura une inhibition
allostérique par l’ATP on va modifier le Km de l’enzyme par une diminution de
l’affinité donc augmentation du Km de la citrate synthase.
La 2ème étape catalysée par l’isocitrate déshydrogénase : on a ici une inhibition
par le NADH, H+.
La 3ème étape du complexe alpha-cétoglutarate déshydrogénase : on va avoir une
inhibition par le succinyl CoA aussi par le NADH,H+.
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 20
I-5 Catabolisme des disaccharides
Le catabolisme des disaccharides se fait à l’aide d’enzymes très spécifiques de la
liaison glucidique. La recherche de ces enzymes est utilisée pour l’identification
bactérienne. Les enzymes peuvent également hydrolyser les analogues des
disaccharides pour donner des produits colorés.
Exemple : ONPG lactose
Orthonito-phenyl -D galactopyranoside
Parmi les principales enzymes recherchées nous avons :
- la B-galactosidase pour le lactose
- la maltase pour le maltose
- l’invertase pour le saccharose.
Ces enzymes libèrent respectivement le glucose, le galactose et le fructose. Le
glucose sera dégradé par la glycolyse, le fructose est phosphoryle et rejoint la
glycolyse et le galactose est épimérisé en glucose et rejoint la glycolyse
I-6 Dégradation des polysaccharides
Les polysaccharides les plus utilisés sont l’amidon et la cellulose. L’amidon est
dégradé par les amylases (exoenzymes). La cellulose est dégradée par des
bactéries cellulosiques.
I-7 Anabolisme des glucides
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 21
Lorsque le développement de la bactérie est limité par une cause autre que la
source d’énergie et de carbone, la bactérie accumule le glucose sous forme d’un
polymère : le glycogène.
Glucose + ATP Glucose 6 P + ADP
Glucose 6 P + ATP (Glucose)n ADP + PP
I-8 Réduction de l’accepteur-Respiration-Fermentation
Les processus de réduction de l’accepteur final d’électrons sont fonction de
l’environnement bactérien (aérobiose ou anaérobiose), de la nature du substrat,
mais aussi de l’équipement enzymatique de chaque bactérie. Au-delà de la
formation du pyruvate plusieurs voies sont possibles.
I-8-1 Respiration aérobiose
Elle est caractérisée par la présence d’une chaîne de transport des électrons
située sur la membrane plasmatique et par la nature de l’accepteur final
d’électrons : l’oxygène de l’air.
Le pyruvate est transformé en acétyl-CoA qui entre dans le cycle de Krebs.
I-8-2Respiration anaérobiose
Chez certaines bactéries, la respiration peut exister en anaérobiose, l’accepteur
final d’électron est, soit le nitrate, soit le fumarate. Le processus est sous la
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 22
dépendance d’enzymes et de transporteurs d’électrons liés à la membrane
plasmatique.
• Respiration nitrate
Certaines bactéries sont capables de transformer le NO3 en NO2 grace à la
nitrate réductase d’autres peuvent poursuivre la réduction jusqu’au stade de N2
NO3- + 2H+ + 2è NO2- + H2O
NO3- + 2H+ + 2è NO2-H + N2
• Respiration fumarate
L’accepteur d’électrons est le fumarate qui est réduit grâce à une fumarate
réductase et un transporteur d’électrons (ménaquinone). La réduction d’une
mole de fumarate entraîne la production d’une mole d’ATP.
I-8-3 La fermentation
Dans ce processus, l’accepteur final est un composé organique. L’équipement
enzymatique des bactéries réduit le pyruvate, ou un dérivé, jusqu’à des produits
finaux caractéristique de certains groupes de bactéries. La fermentation a
toujours lieu en l’absence d’oxygène donc seules les bactéries anaérobies
strictes ou facultatives peuvent utiliser cette voie. On a la fermentation lactique,
la fermentation alcoolique, la fermentation des acides aminés et la fermentation
acides complexes.
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 23
I-9 Application à l’identification bactérienne
I-9-1 Les tests enzymatiques
o La catalase
Principe :La catalase est une enzyme qui décompose la peroxyde
d’hydrogène 3% en oxygène gazeux et en eau.
H2O2 catalase 1/2 O2+H2O
• o L’oxydase Principe : Le phényl diamine oxydase va agir sur un
substrat chromogénique incolore pour donner un composé rouge semi-
quinolone instable qui va s’oxyder pour donner un composé noirâtre.
I-9-2 Métabolisme glucidique
Bien que tous les glucides soient susceptibles d’être catabolisés, la première
étape consiste à déterminer la voie d’utilisation du glucose : voie oxydative chez
les aérobies strictes, voie fermentative chez les aéroanaérobies facultatives et
les anaérobies strictes, car les autres sucres seront utilisés selon la même voie.
• Epreuve de Hugh et Leifson
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 24
• Milieux d’études des glucides :
- eau peptonée au rouge de phénol
- milieu CTA (biomérieux)
- milieu de Kligler-Hajna
- mise en évidence des produits terminaux de la fermentation du glucose : test
de rouge de méthyle (RM) et le test de voges proskauer (VP). Le milieu
d’étude de ces deux tests est le milieu de Clark et Lubs.
I-9-3 Métabolisme protidique
Les protéines, avant d’être assimilées, sont dégradées en polypeptides qui sont
également dégradés en acides aminés.
La dégradation des protéines par des enzymes que sont les protéinases et les
peptidases précède leur assimilation.
L’étude du métabolisme protidique peut être envisagée sous plusieurs aspects :
- soit on peut faire l’étude de l’activité protéolytique (l’action des enzymes sur
les protéines)
- soit l’étude du métabolisme des acides aminés
- soit l’étude du devenir de certains dérivés de nature protéique comme l’urée
La possession des protéases
On étudiera leurs effets sur diverses substances comme la gélatine, l’œuf, le
lait, la caséine, etc.….
La possession d’hémolysines
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 25
Autres enzymes comme la tryptophanase, l’uréase , les
désaminases, les décarboxylases, les déshydrolases.
I-9-4 Métabolisme lipidique
Les lipides ne sont assimilables qu’après clivage et leur hydrolyse est assurée
par des enzymes qu’on désigne improprement sous le nom de lipase. Trois
groupes d’enzymes sont concernés.
Recherche des estérases
Principe :
On incorpore à une gélose contenant du chlorure de Ca2+, du Tween 80 qui
contient du monooléate de sorbitol.
La présence d’une estérase libérant des A.G transformés ultérieurement en sels
calciques insolubles se traduit par une opacification du milieu.
Technique
La gélose au Tween 80 est coulée en boîte de pétri et ensemencée en touches.
Après incubation à la tension de lato les souches estérases positive vont donner
un halo opaque due à la formation d’un précipite alors que les souches estérases
négatives ne donnent pas de précipité.
Recherche des lipases
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 26
Les lipases sont des enzymes capables d’hydrolyser les lipides.
La recherche se fait par l’hydrolyse d’un triacyl glycérol.
Exemple : Hydrolyse de la Tributyrine
La gélose de la tributyrine est coulée en boîte de Pétri et ensemencée en strie
radiale. Après incubation à 30°C les souches lipase positif donnent la présence
d’un halo clair.
Recherche leucithinases
Principe :
La leucithinase hydrolyse la leucithine en libérant le diglycéride et le
phosphotidyl-choline.
Technique
La gélose à base d’œuf est obtenue en ajoutant à une gélose nutritive à 10%, une
émulsion de jaune d’œuf stérile. Cette gélose est coulée en boîte de pétri et
ensemencée en strie. La présence de leucithinase va se traduire par la présence
de zone d’opacité très nette autour de la strie.
I-9-5 La respiration
La chaîne respiratoire est située au niveau de la membrane plasmatique. Elle est
constituée d’une succession d’enzymes et de coenzymes assurant le transfert
d’électrons d’un donneur vers un accepteur.
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 27
• Les enzymes respiratoires
- la cytochrome oxydase
- la catalase
- la nitrate réductase
• Le type respiratoire
L’étude du type respiratoire s’effectue en tube veillon rempli de gélose V.F.
Cette étude va permettre de classer les bactéries en 4 types respiratoires selon
leur comportement vis à vis de l’oxygène de l’air ainsi on aura :
- Les bactéries aérobies strictes qui exigent l’O 2 libre pour leur
développement
- les bactéries anaérobies strictes qui ne peuvent se développer qu’en
absence d’O2 libre
- les bactéries aérobies – anaérobies facultatifs qui peuvent se
développer avec ou sans oxygène
- les microaérophiles qui ne se développent qu’en présence d’une
faible quantité d’oxygène.
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 28
METABOLISME BACTERIEN DANS L’ISOLEMENT ET L’IDENTIFICATION 29
Vous aimerez peut-être aussi
- Glucides: Les Grands Articles d'UniversalisD'EverandGlucides: Les Grands Articles d'UniversalisPas encore d'évaluation
- Alcoolisme: Les Grands Articles d'UniversalisD'EverandAlcoolisme: Les Grands Articles d'UniversalisPas encore d'évaluation
- 01.2 GlycolyseDocument5 pages01.2 Glycolysewassimm31Pas encore d'évaluation
- Métabolisme Des GlucidesDocument22 pagesMétabolisme Des Glucideswww.rourita99Pas encore d'évaluation
- Biochimie A1Document21 pagesBiochimie A1Joseph YaoPas encore d'évaluation
- 03-Glycolyse 2021Document7 pages03-Glycolyse 2021Mery Sage100% (1)
- Catabolisme Des GlucidesDocument11 pagesCatabolisme Des Glucidesevident 2014Pas encore d'évaluation
- 01.4 Voie Des Pentoses PhosphatesDocument5 pages01.4 Voie Des Pentoses Phosphateswassimm31Pas encore d'évaluation
- Biochimie1an Glycolyse2022ferganiDocument8 pagesBiochimie1an Glycolyse2022ferganiKhelassi OussamaPas encore d'évaluation
- Chapitre Voies MétaboliquesDocument57 pagesChapitre Voies MétaboliquesMBAÏADOUM NGARGUINAM RodriguePas encore d'évaluation
- 1 GlycolyseDocument47 pages1 GlycolyseGhaid MahmoudiPas encore d'évaluation
- La NeoglucogeneseDocument2 pagesLa NeoglucogeneseBouazzi IslemmPas encore d'évaluation
- MétabolismeDocument26 pagesMétabolismeAhmedPas encore d'évaluation
- Bioch Pharm2an-Metabolisme GlucidesDocument28 pagesBioch Pharm2an-Metabolisme GlucidesmaryPas encore d'évaluation
- Chapitre III. Catabolismes Des GlucidesDocument10 pagesChapitre III. Catabolismes Des GlucidesBenzaid BatoulPas encore d'évaluation
- Chapitre 5-La Glycolyse (Voie D'embden-Meyeroff-Parnas)Document17 pagesChapitre 5-La Glycolyse (Voie D'embden-Meyeroff-Parnas)stephen njemsPas encore d'évaluation
- 001 - Cours NéoglucogenèseDocument13 pages001 - Cours NéoglucogenèseBlueskyindanPas encore d'évaluation
- Biochimie Microbienne - 3.glycolyseDocument18 pagesBiochimie Microbienne - 3.glycolyseliliPas encore d'évaluation
- Biochimie - GlucidesDocument51 pagesBiochimie - GlucidesmimiPas encore d'évaluation
- Cours 8 A GLYCOLYSEDocument15 pagesCours 8 A GLYCOLYSELina BernoussiPas encore d'évaluation
- 1 GlycolyseDocument47 pages1 GlycolyseHanane HananePas encore d'évaluation
- 8 GlycolysisDocument17 pages8 GlycolysisKarim OuzerourouPas encore d'évaluation
- Poly 03-Metabolisme Des GlucidesDocument52 pagesPoly 03-Metabolisme Des Glucidessafemind100% (1)
- La Voie Des Pentoses PhosphateDocument20 pagesLa Voie Des Pentoses PhosphateMehdi Nabil Zidour100% (2)
- La Voie Des Pentoses PhosphatesDocument10 pagesLa Voie Des Pentoses PhosphatesGeorges RandriamampandryPas encore d'évaluation
- Glycolyse - Wikipédia PDFDocument8 pagesGlycolyse - Wikipédia PDFwxcvbnnbvcxwPas encore d'évaluation
- Metabolisme Des Glucides PR SAADI OUISLIM A.SDocument13 pagesMetabolisme Des Glucides PR SAADI OUISLIM A.SDemba Tahirou DIOPPas encore d'évaluation
- 1 GlycolyseDocument56 pages1 Glycolysesoubin kimPas encore d'évaluation
- GlycolyseDocument45 pagesGlycolysecepPas encore d'évaluation
- Biochimie Approfondie Cours 4Document16 pagesBiochimie Approfondie Cours 4Alhassane BahPas encore d'évaluation
- 1.métabolisme Des Glucides GlycolyseDocument39 pages1.métabolisme Des Glucides GlycolyseboubouothnielPas encore d'évaluation
- Glycol YseDocument35 pagesGlycol YseMoussa DiaPas encore d'évaluation
- Fichier Produit 1945Document64 pagesFichier Produit 1945Antz DanielPas encore d'évaluation
- NEOGLUCOGENEDocument7 pagesNEOGLUCOGENEMira45Pas encore d'évaluation
- Microsoft Word - NeoglucogeneseDocument8 pagesMicrosoft Word - NeoglucogeneseDaniel PardejoPas encore d'évaluation
- A/ Glycolyse (Ou Voie d'Embden-Meyerhof) : A) Les Différentes Étapes de La GlycolyseDocument6 pagesA/ Glycolyse (Ou Voie d'Embden-Meyerhof) : A) Les Différentes Étapes de La GlycolysemaryPas encore d'évaluation
- Cours NéoglucogenèseDocument8 pagesCours NéoglucogenèseaxelPas encore d'évaluation
- Chap 11Document18 pagesChap 11glovingimbi62Pas encore d'évaluation
- Biochimie2an-Voies Pentoses Phosphate2019kouiderDocument7 pagesBiochimie2an-Voies Pentoses Phosphate2019kouiderlisteriamonocytogenes36Pas encore d'évaluation
- 3 Voie Des Pentoses PhosphatesDocument13 pages3 Voie Des Pentoses Phosphatesnouralc.2005Pas encore d'évaluation
- Chapitre 8Document9 pagesChapitre 8yvesPas encore d'évaluation
- Métabolisme Des Glucides Suite 02Document34 pagesMétabolisme Des Glucides Suite 02Khã WlaPas encore d'évaluation
- Vue Générale Du Métabolisme Des GlucidesDocument18 pagesVue Générale Du Métabolisme Des GlucidesKargamel PeyoPas encore d'évaluation
- Métabolisme Des GlucidesDocument6 pagesMétabolisme Des GlucidesHouda SoniaPas encore d'évaluation
- 1 - Métabolisme Des GlucidesDocument20 pages1 - Métabolisme Des GlucidesFulbert AyenaPas encore d'évaluation
- Metabo Partie2Document6 pagesMetabo Partie2la biochimiste100% (2)
- La Voie Des Pentoses Phosphate-1Document20 pagesLa Voie Des Pentoses Phosphate-1Mohammed Idriss LatrochPas encore d'évaluation
- La LactatemieDocument20 pagesLa LactatemieDø LLÿPas encore d'évaluation
- La Glycolyse 1Document29 pagesLa Glycolyse 1Zakaria MftPas encore d'évaluation
- TDN10 PDFDocument5 pagesTDN10 PDFJules TiyoumPas encore d'évaluation
- Biochimie MetaboliqueDocument32 pagesBiochimie Metabolique[AE]88% (8)
- 1 M - Tabolisme - Du - GRDocument19 pages1 M - Tabolisme - Du - GRtimPas encore d'évaluation
- NEOGLUCOGENESEDocument10 pagesNEOGLUCOGENESEZack EmyPas encore d'évaluation
- Biochimie NeoglucogeneseDocument5 pagesBiochimie NeoglucogeneseHind BerradiPas encore d'évaluation
- SVI - S4 - Biochimie Métabolique - HAJJAJDocument62 pagesSVI - S4 - Biochimie Métabolique - HAJJAJLinda KoundziPas encore d'évaluation
- Genie BiochimieDocument41 pagesGenie Biochimieddiouk2Pas encore d'évaluation
- EnzymeDocument8 pagesEnzymefifi fifiPas encore d'évaluation
- Resume Sciences Bilogique Pour L'ingenieurDocument37 pagesResume Sciences Bilogique Pour L'ingenieurSara AdPas encore d'évaluation
- La Méthode de la Déesse du Glucose : Votre Guide Complet pour une Santé Métabolique OptimaleD'EverandLa Méthode de la Déesse du Glucose : Votre Guide Complet pour une Santé Métabolique OptimalePas encore d'évaluation
- Une vie sans Magnésium ? Impossible !: Ou comment prendre soin de soi naturellementD'EverandUne vie sans Magnésium ? Impossible !: Ou comment prendre soin de soi naturellementPas encore d'évaluation
- TC - Examen - Emd 2 6728Document13 pagesTC - Examen - Emd 2 6728Ha NahPas encore d'évaluation
- Cours N - 1 Partie 1Document33 pagesCours N - 1 Partie 1sino spagoPas encore d'évaluation
- MT1-cours 03 Bibliographie Références BibliographiquesDocument33 pagesMT1-cours 03 Bibliographie Références Bibliographiqueskim namjoonPas encore d'évaluation
- Cours N - 1 Partie 2Document17 pagesCours N - 1 Partie 2sino spagoPas encore d'évaluation
- Cour 1Document25 pagesCour 1sino spagoPas encore d'évaluation
- Biochimie Microbienne - Métabolisme & BioénergétiqueDocument37 pagesBiochimie Microbienne - Métabolisme & BioénergétiqueRo ChdiPas encore d'évaluation
- Cour 1Document25 pagesCour 1sino spagoPas encore d'évaluation
- Cours N - 1 Partie 3Document18 pagesCours N - 1 Partie 3sino spagoPas encore d'évaluation
- Cours TCE 3 TerminologieDocument27 pagesCours TCE 3 Terminologiesino spagoPas encore d'évaluation
- Cour 4Document20 pagesCour 4sino spagoPas encore d'évaluation
- MT1-cours 03 Bibliographie Références BibliographiquesDocument33 pagesMT1-cours 03 Bibliographie Références Bibliographiqueskim namjoonPas encore d'évaluation
- Cours MDF Approfondie - Chap 2Document7 pagesCours MDF Approfondie - Chap 2sino spagoPas encore d'évaluation
- Cour 5Document16 pagesCour 5sino spagoPas encore d'évaluation
- CoursDocument54 pagesCourssino spago100% (1)
- Tous Les Cours Math 4Document63 pagesTous Les Cours Math 4Aissa Djazari100% (2)
- Alg 4 CoursDocument60 pagesAlg 4 CoursMohammed BouabidPas encore d'évaluation
- Sujet Et Corrigé Ex-Remp Physique1Document4 pagesSujet Et Corrigé Ex-Remp Physique1sino spagoPas encore d'évaluation
- Corrigé Examen-Phys1-16-17Document3 pagesCorrigé Examen-Phys1-16-17Yanis DiabloPas encore d'évaluation
- TD 2 TM 1Document3 pagesTD 2 TM 1sino spagoPas encore d'évaluation
- Cours de Maths 4 (Résumé)Document16 pagesCours de Maths 4 (Résumé)Akroun MohandPas encore d'évaluation
- 20 PolyDocument5 pages20 PolyAya KhadherPas encore d'évaluation
- Sujet Et Corrigé Ex Math2Document5 pagesSujet Et Corrigé Ex Math2sino spagoPas encore d'évaluation
- Sujet Et Corrigé Ex de Physique 1Document3 pagesSujet Et Corrigé Ex de Physique 1sino spagoPas encore d'évaluation
- Série D'exercices N°1 TURBOMACHINE1Document4 pagesSérie D'exercices N°1 TURBOMACHINE1sino spagoPas encore d'évaluation
- CRYO Chapitre III - Suite Et FinDocument10 pagesCRYO Chapitre III - Suite Et Finsino spagoPas encore d'évaluation
- CRYO Chapitre III-partie1Document14 pagesCRYO Chapitre III-partie1sino spagoPas encore d'évaluation
- Exercice #3:: Ainsi Que La Vitesse Absolue VDocument4 pagesExercice #3:: Ainsi Que La Vitesse Absolue Vsino spagoPas encore d'évaluation
- TDTM 1 SupDocument3 pagesTDTM 1 Supsino spagoPas encore d'évaluation
- CRYO Chapitre III - Rectification DiscontinueDocument9 pagesCRYO Chapitre III - Rectification Discontinuesino spagoPas encore d'évaluation
- 12 Bactéries Lactiques Et Métabolismes Fermentaires PDFDocument5 pages12 Bactéries Lactiques Et Métabolismes Fermentaires PDFFahroudinePas encore d'évaluation
- Métabolmisme Des GlucidesDocument28 pagesMétabolmisme Des GlucidesHASNAE EL-JABBOURYPas encore d'évaluation
- AH Constituonnelles EnzymatiqueDocument9 pagesAH Constituonnelles EnzymatiqueMiledPas encore d'évaluation
- Anabolisme Glucides Et LipidesDocument6 pagesAnabolisme Glucides Et Lipidesbeauty queensPas encore d'évaluation
- Le Transport de L'oxygène Par Le SangDocument90 pagesLe Transport de L'oxygène Par Le SangSimion MehedintiPas encore d'évaluation
- MicrobiologieDocument64 pagesMicrobiologieZineb DahmaniPas encore d'évaluation
- DM 2011-2012 - CorrectionDocument1 pageDM 2011-2012 - CorrectionHadrien De GreefPas encore d'évaluation
- 5 Metabolisme 2011-12 PDFDocument19 pages5 Metabolisme 2011-12 PDFsadqiPas encore d'évaluation
- Sequence 2 Cours Svteehb Tle D 2023Document49 pagesSequence 2 Cours Svteehb Tle D 2023Brice ONKELPas encore d'évaluation
- La MembraneDocument23 pagesLa MembraneFanny GrouxPas encore d'évaluation
- 1 Introduction A L'etude Des Enzymes 2018Document51 pages1 Introduction A L'etude Des Enzymes 2018Rim BenabdennourPas encore d'évaluation
- Biochimie Metabolique Les Glucides CoursDocument20 pagesBiochimie Metabolique Les Glucides CoursmaryPas encore d'évaluation
- Theme 3 2 Type B Exercice 7Document2 pagesTheme 3 2 Type B Exercice 7coulibalyismaels804Pas encore d'évaluation
- Devoir 1 - Unité 1 (BS) 2023Document8 pagesDevoir 1 - Unité 1 (BS) 2023Cassandra MaaloufPas encore d'évaluation
- Unite1-cours1-Réactions Responsables de La Libération de L Energie - ATPDocument10 pagesUnite1-cours1-Réactions Responsables de La Libération de L Energie - ATPFatima MisriPas encore d'évaluation
- Histologie GeneraleDocument203 pagesHistologie GeneraleAnou Kalenga100% (1)
- QSM BiochimieDocument25 pagesQSM BiochimieLGGPRONEPas encore d'évaluation
- Chapitre 1 Glucides 20232024Document18 pagesChapitre 1 Glucides 20232024yousraghanem23Pas encore d'évaluation
- Liberation de L Energie Emmagasinee Dans La Matiere Organique Cours 1 1Document23 pagesLiberation de L Energie Emmagasinee Dans La Matiere Organique Cours 1 1Hajar OumnasPas encore d'évaluation
- Etat Rassis: Phase de La Maturation: Comment Ce Fait ??Document3 pagesEtat Rassis: Phase de La Maturation: Comment Ce Fait ??Amina Belaid100% (1)
- 12 Anabolisme Des Acides Gras Et Des Triglycerides1Document7 pages12 Anabolisme Des Acides Gras Et Des Triglycerides1Moise NdiayePas encore d'évaluation
- COURS BC - PlasteDocument23 pagesCOURS BC - PlasteMohammed El MachmoulPas encore d'évaluation
- Livre de Biologie TSExp Mali-1-1 PDF Respiration Cellulaire CytoplasmeDocument1 pageLivre de Biologie TSExp Mali-1-1 PDF Respiration Cellulaire CytoplasmeHalima Mint75% (4)
- 01.6 Métabolisme Du GlycogèneDocument7 pages01.6 Métabolisme Du Glycogènewassimm31Pas encore d'évaluation
- Les Acides Nucléiques Cours 1Document22 pagesLes Acides Nucléiques Cours 1AmaFenKiPas encore d'évaluation
- Auxine 1 Cours S4 Cours de Physiologie Végétale S4Document21 pagesAuxine 1 Cours S4 Cours de Physiologie Végétale S4Ahmed InPas encore d'évaluation
- Encéphalomyopathies MitochondrialesDocument13 pagesEncéphalomyopathies MitochondrialesaissaPas encore d'évaluation
- LipidegradDocument10 pagesLipidegradsamiPas encore d'évaluation
- La Cellule, Les Tissus, La PeauDocument59 pagesLa Cellule, Les Tissus, La PeauRahal karimPas encore d'évaluation
- Définition de ATPDocument2 pagesDéfinition de ATPmohbio_869948847Pas encore d'évaluation