Académique Documents
Professionnel Documents
Culture Documents
TD Chapitre 16 Redox
TD Chapitre 16 Redox
Transféré par
samsam100098Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
TD Chapitre 16 Redox
TD Chapitre 16 Redox
Transféré par
samsam100098Droits d'auteur :
Formats disponibles
Chapitre
16 : Equilibres d’oxydoréduction Lefèvre 2014-‐2015
TD CHAPITRE 16 : EQUILIBRES D’OXYDOREDUCTION
Ce qu’il faut savoir :
Définitions : oxydant, réducteur, demi-‐pile, pile, force électromotrice, potentiel d’électrode, potentiel standard.
Formule de Nernst
Electrodes de références : ESH, ECS.
Ce qu’il faut savoir faire :
Ecrire le bilan d’une réaction d’oxydoréduction.
Déterminer le nombre d’oxydation d’un élément dans une espèce chimique.
Prévoir les valeurs extrêmes du nombre d’oxydation d’un élément connaissant sa position dans la classification périodique.
Trouver le sens de fonctionnement d’une pile en calculant les potentiels.
Déterminer la capacité d’une pile.
Déterminer la constante d’équilibre d’une réaction d’oxydoréduction.
Utiliser des piles pour déterminer des constantes thermodynamique (complexation, précipitation…)
Savoir appliquer le cours…
Exercice 1 : Tester ses connaissances
Indiquer parmi les affirmations suivantes celles qui sont vraies.
1) Oxydoréduction 4) Piles
¨ Un réducteur capte des électrons ¨ Le pont salin permet d’assurer le passage du courant entre
¨ Une oxydation est une perte d’électron les deux ½ piles
¨ Les électrons n’existent pas en solution ¨ Des électrons passent par le pont salin
aqueuse Soit une pile Daniel dont les électrolytes des deux ½ piles ont
2+ -‐1
¨ Zn est l’oxydant du couple Zn/Zn pour volume V=100mL et pour concentration C=0,1 mol.L
2+ 2+
(respectivement en ions Cu et en ion Zn ).
2+
¨ La demi-‐pile contentant le couple Cu /Cu est la cathode.
2) Nombre d’oxydation : définition ¨ La capacité de cette pile est de 0,5 A.h.
¨ Un nombre d’oxydation peut être négatif 2+ 2+
Données : E°(Zn /Zn)=-‐0,77V ; E°(Cu /Cu)=0,34V ; F=96500 C.mol
-‐1
¨ Le nombre d’oxydation maximum d’un
élément est son nombre d’électrons de 5) Réaction d’oxydoréduction
valence +
Soit la réaction d’oxydation du Zn par les ions Ag .
¨ Le nombre d’oxydation est toujours un entier ¨ La constante d’équilibre de cette réaction vaut K°=10
26
¨ Un
nombre
d’oxydation
de
+II
signifie
que
¨ Dans
un
système
contenant
initialement
de
l’argent
Ag(s)
l’élément
à
deux
électrons
de
plus
que
son
+
en
excès,
du
zinc
Zn(s),
des
ions
Ag et
Zn
en
2+
nombre d’électrons de valence. -‐1
concentration C=0,1mol.L la réaction écrite ci-‐dessus se
3) Nombre d’oxydation : calcul déroulera dans le sens direct.
2+
¨ Le n.o. de Mn dans Mn est +II +
¨ A l’équilibre, le potentiel redox du couple Ag /Ag sera plus
-‐
¨ Le n.o. de Mn dans MnO4 est –I faible que celui du couple Zn /Zn
2+
¨ Le
n.o.
de
H
dans
HCl
est
+I
¨
Le
potentiel
redox
final
sera
proche
de
-‐0,80V.
-‐
¨ Le
n.o.
de
Cl
dans
ClO
est
+II
2+ +
Données
:
E°(Zn /Zn)=-‐0,77V
E°(
Ag /Ag)=0,80V
Exercice
2
:
Relation
de
Nernst
Donner
la
relation
de
Nernst
permettant
de
calculer
le
potentiel
redox
pour
tous
les
couples
suivants
:
-‐ 2+ -‐
a. IO3
/
I2
c. MnO2(s)
/
Mn
e. NO3
/
NO(g)
2-‐ 3+ 2+
b. Cr2O7
/
Cr
d. Hg
/
Hg(l)
Exercice 3 : Constantes d’équilibre
Calculer la constante des équilibres suivants (données page suivante) :
2+ + + 2+
a. Cu + 2Ag(s) = Cu(s) + 2Ag b. 2H + Sn(s) = H2(g) + Sn
-‐ + 2+
c. 2 MnO4 + 6H = 2 Mn + 5/2 O2(g) + 3H2O
1
Chapitre 16 : Equilibres d’oxydoréduction Lefèvre 2014-‐2015
Exercice 4 : Etude d’une pile
On réalise une pile constituée des éléments suivants : Couple E°(V)
-‐ 2+
-‐ plaque d’argent pur trempant dans 100mL d’une solution aqueuse de MnO4 /Mn 1,51
+ + -‐1
concentration initiale en ions Ag : [Ag ]=0,20mol.L ; O2(g)/H2O 1,23
-‐ plaque de zinc pur trempant dans 100mL d’une solution aqueuse de +
Ag /Ag(s) 0,80
2+ 2+ -‐1
concentration initiale en ions Zn : [Zn ]=0,10mol.L ; 2+
Cu /Cu(s) 0,34
-‐ pont salin au nitrate de potassium +
3 H /H2(g) 0
Le volume des plaques métalliques est V=10cm . 2+
Sn /Sn(s) -‐0,14
I. Sens d’évolution spontané du système
1. Déterminer la polarité de la pile et sa fem.
2. Ecrire les réactions aux électrodes, ainsi que le bilan de la réaction de fonctionnement.
3. Déterminer la constante d’équilibre de la réaction de fonctionnement. Que peut on en conclure sur la composition de
la pile lorsqu’elle sera usée ?
4. Donner la représentation schématique de la pile.
II. Pile en fonctionnement
1. Faire un schéma de la pile en indiquant le sens de parcours du courant électrique et celui des électrons
2. Lorsque l’on court-‐circuite la pile, on mesure un courant d’intensité I=15mA. En déduire la valeur de la résistance
interne de la pile.
III. Quantité d’électricité disponible
Cette pile alimente un dispositif résistif. Elle débite alors une intensité de 10mA.
1. Ecrire une relation liant la quantité d’électricité ayant circulé à l’avancement ξ de la réaction.
2. Calculer la quantité d’électricité Q ayant traversé le circuit au bout de 5,0h de fonctionnement.
3. Déterminer alors les concentrations des espèces en solution dans chaque compartiment au bout de 5h.
4. Combien de temps la pile pourra-‐t-‐elle alimenter le dispositif si l’on compte une déperdition de 5% de la quantité
d’électricité ?
-‐1 -‐1
Données : Masses molaires atomiques : M(Zn)=65,4g.mol ; M(Ag)=107,9g.mol
Densités : d(Zn)=7,11 ; d(Ag)=10,5
-‐3
Masse volumique de l’eau : 1,0 g.cm
-‐1
Valeur absolue de la charge d’une mole d’électrons : F=96500 C.mol .
Exercice 5 : Détermination de la composition d’un système à l’équilibre : comparaison de deux méthodes.
On considère un système de composition initiale suivante :
2+ -‐1 4+ -‐1 2+ -‐1 3+ -‐1
[Pb ]i=0,1 mol.L ; [Pb ]i=0,2 mol.L ; [Co ]i=0,1 mol.L ; [Co ]i=0,3 mol.L
1) Utilisation de la relation de Guldberg et Waage.
a) En comparant les potentiels standard, écrire la réaction redox entre les deux couples dans le sens le plus favorable.
b) Calculer le quotient réactionnel initial et montrer que la réaction se déroule spontanément dans le sens direct.
c) A l’aide de la relation de Guldberg et Waage, déterminer la composition finale (précise) du système.
2) Utilisation des potentiels :
a) En utilisant les potentiels d’électrode des deux couples, indiquer le sens spontané d’évolution du système.
b) En écrivant l’égalité des potentiels à l’équilibre, déterminer l’avancement final de cette réaction. En déduire la
composition finale (précise) du système.
3+ 2+ 4+ 2+
Données : E°(Co /Co ) = 1,82 V ; E°(Pb /Pb ) = 1,69 V.
Pour aller plus loin…
Exercice 6 : Dismutation de l’eau oxygénée
1) On considère une solution aqueuse de peroxyde d’hydrogène, en équilibre avec le dioxygène de l’air.
Puisque H2O, O2 et H2O2 sont présents, le potentiel d’électrode de cette solution peut être calculé à l’aide de la formule de
Nernst appliquée au couple O2/H2O2, au couple O2/H2O ou bien au couple H2O2/H2O. En déduire la valeur du potentiel standard
E°(H2O2/H2O).
2) En plaçant les couples O2/H2O2 et H2O2/H2O sur un axe en potentiel standard, montrer que le peroxyde d’hydrogène
H2O2 est une espèce instable qui se dismute. Ecrire l’équation de sa dismutation et calculer sa constante d’équilibre.
Commenter le fait que l’on puisse tout de même conserver plusieurs mois une solution de peroxyde d’hydrogène.
2
Chapitre 16 : Equilibres d’oxydoréduction Lefèvre 2014-‐2015
-‐1
3) On considère 1L d’une solution de peroxyde d’hydrogène de concentration C=0,1mol.L . On appelle « titre » d’une eau
oxygénée le volume de dioxygène gazeux (mesuré en litre) que peut dégager 1 L d'eau oxygénée par dismutation, dans
les conditions standard de température et pression (0°C ; 1bar). Quel est le titre de cette eau oxygénée ?
Données : E°(O2/H2O2)=0,68V ; E°(O2/H2O)=1,23V ; R=8,314 S.I.
Exercice 7 : Calculs de potentiels
Quel est la valeur du potentiel que prend…
1) …une électrode d’argent dans une solution saturée de chlorure d’argent ?
-‐2 -‐1 2+
2) …une électrode de platine plongeant dans une solution équimolaires (C0=1,0.10 mol.L ) de nitrate ferreux (Fe ) et de
3+ ’ -‐1
nitrate ferrique (Fe ) en présence d’acide sulfurique qui fixe la concentration en ions sulfate à C0 =1,0 mol.L .
+
Données à 25°C : E°(Ag /Ag) = 0,80 V ; pKS(AgCl)=9,7 ;
3+ 2+ 2+ 2-‐ 2,6 3+ 2-‐ + 4,1
E°(Fe /Fe )=0,77V ; Fe + SO4 = [Fe(SO4)] β=10 ; Fe + SO4 = [Fe(SO4)] β’=10
Exercice 8 : Pile de concentration
Considérons la pile formée par l’association de deux demi-‐piles constituées toutes deux d’un fil de cuivre plongeant dans une
-‐1
solution de sulfate de cuivre, l’une dans un volume V1=50mL à c1=0,100mol.L (demi-‐pile 1), l’autre dans un volume V2=100mL à
-‐1
c2=0,010mol.L (demi-‐pile 2). Une solution de nitrate d’ammonium gélifié assure la jonction interne entre les deux demi-‐piles. Le
métal cuivre est en excès dans chacune des demi-‐piles.
1) Faire un schéma de cette pile.
2) Déterminer la polarité de la pile, les équations des réactions se déroulant dans chaque demi-‐pile et la réaction globale
de fonctionnement de la pile.
3) Déterminer les concentrations finales dans chaque bécher lorsque la pile cesse de débiter ainsi que le potentiel de
chaque couple à l’équilibre. En déduire la quantité d’électricité qui a traversé le circuit.
2+
Données : E°(Cu /Cu)=0,34V.
Exercice 9 : Influence de la complexation : application à la détermination d’une constante de formation
On réalise une pile en associant une électrode standard à hydrogène (demi-‐pile 1) à une demi-‐pile constituée d’un fil de cuivre
-‐2 -‐1
plongeant dans un volume V=40,0mL d’une solution de sulfate de cuivre (II) à C=1,00.10 mol.L à laquelle on ajoute V’=10,0mL
-‐1
d’ammoniac à C’=0,50mol.L (demi-‐pile 2)
2+ +
On admet qu’il ne se forme que le complexe [Cu(NH3)4] et que la concentration des ions NH4 est négligeable devant celle de
2+
NH3. On cherche à déterminer β4, constante de formation globale du complexe [Cu(NH3)4] .
On mesure une fem de 0,02V, l’ESH étant le pôle +.
1) Déterminer la valeur de β4.
2+
2) Calculer E°([Cu(NH3)4] /Cu). Commenter.
2+
Données : E°(Cu /Cu)=0,34V.
Exercice 10 : Influence de la précipitation : application à la détermination d’un produit de solubilité
Voir TP
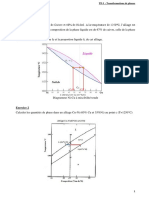
Exercice 11 : Détermination d’un produit de solubilité par potentiométrie
On veut vérifier la teneur en ions chlorure d’un sérum physiologique. Pour cela, on ajoute progressivement une
solution de nitrate d’argent de concentration C = 0,100 mol.L-‐1 à un volume V0 = 50,0 mL d’une solution S préparée
en diluant cinq fois le sérum étudié. On note l’apparition du précipité AgCl(s) dès les premières gouttes de solution
versée. On suit l’évolution de la différence de potentiel ΔE entre une électrode d’argent et une électrode au calomel
saturé (notée E.C.S.). La courbe obtenue est donnée ci-‐après.
Données : à 25°C : E°(Ag+/Ag)=0,80V ; E(ECS)=0,25V ; M(NaCl) = 58,5 g.mol-‐1 ; d(sérum)=1
1. Donner l’expression du potentiel d’oxydoréduction de l’E.C.S.. Pourquoi est-‐il constant à température
constante ?
2. Quelle précaution faut-‐il prendre avec l’électrode au calomel lorsqu’on réalise un tel dosage ?
3. Expliquer pourquoi l’utilisation d’une électrode d’argent permet-‐elle de suivre la concentration en ion argent
au cours du titrage.
3
Chapitre 16 : Equilibres d’oxydoréduction Lefèvre 2014-‐2015
ΔE (V)
4. Déterminer la concentration des ions chlorure dans la solution S
puis dans le sérum.
5. Comparer à l’indication portée sur l’étiquette du sérum : 0,9 %
en masse de chlorure de sodium.
6. A l’aide de la courbe, déterminer le produit de solubilité Ks du
chlorure d’argent.
V (mL)
A rendre : Exercice 12 : Détermination du produit de solubilité de l’hydroxyde de cobalt (II)
L’élaboration de piles et la mesure de force électromotrice permettent de déterminer certaines constantes d’équilibre. L’étude qui
va suivre se propose d’utiliser une pile pour déterminer le produit de solubilité de l’hydroxyde de cobalt (II).
3
Dans un bécher (noté 1), on verse 100 cm d’une solution de nitrate d’argent AgNO3 (sel totalement soluble dans l’eau) de
-‐1 3
concentration molaire c1=0,1 mol.L , puis on y plonge une électrode d’argent. Dans un second bécher (noté 2), on verse 100 cm
-‐1
d’une solution de chlorure de cobalt CoCl2 (sel totalement soluble dans l’eau) de concentration molaire c2 = 0,1 mol.L , puis on y
plonge une électrode de cobalt.
On relie les deux béchers par un pont salin contenant du nitrate d’ammonium NH4NO3. On mesure alors une force
électromotrice, notée e, aux bornes de la pile ainsi constituée. L’expérience donne : e = 1,05 V à une température de 25 °C.
1. Schématisation de la pile.
1.1. Effectuer un schéma de la pile.
1.2. Indiquer le rôle du pont salin.
1.3. Expliquer pourquoi on ne peut-‐on pas utiliser un pont contenant du chlorure de potassium.
2+
2. Détermination du potentiel standard du couple Co (aq)/Co(s)
2.1. Ecrire l’équation de la réaction ayant lieu dans la pile quand celle-‐ci débite sachant que l’électrode d’argent constitue le pôle
positif de la pile.
2.2. A l’aide des relations de Nernst, donner l’expression littérale de la force électromotrice de la pile au début de l’expérience.
2+
2.3. En déduire, dans les conditions de l’expérience, la valeur du potentiel standard du couple Co (aq)/Co(s).
2.4. Donner la valeur de la constante d’équilibre de la réaction de fonctionnement de la pile (on démontrera l’expression de la
constante d’équilibre en fonction des potentiels standard).
2.5. Déterminer la composition de la pile lorsque celle-‐ci sera usée, c'est-‐à-‐dire ne débite plus (les deux métaux sont en excès).
2.6. Déterminer la capacité de cette pile.
3. Détermination du produit de solubilité de l’hydroxyde de cobalt (II) Co(OH)2 (s).
2+
On ajoute dans le bécher 2, contenant des ions Co en solution aqueuse, une pastille d’hydroxyde de sodium NaOH(s).
L’hydroxyde de cobalt Co(OH)2(s) précipite. On mesure alors la force électromotrice de la pile ainsi constituée et on obtient une
valeur e’ = 1,18 V. La mesure du pH donne une valeur de 9,5.
2+
3.1. A l’aide de la mesure de e’, déterminer la valeur de la concentration molaire des ions Co dans le bécher 2.
3.2. En déduire la valeur du produit de solubilité de l’hydroxyde de cobalt (II).
3.3. Calculer la valeur du potentiel standard du couple : Co(OH)2(s) /Co(s) (attention, il faut écrire la demi-‐équation en milieu acide
pour pouvoir utiliser la formule de Nernst). Commenter.
Données à 298 K :
-‐14
• Produit ionique de l’eau : Ke = 10
-‐1
• Constante de Faraday : F=96500 C.mol
§ Potentiels standard à 25°C/ESH
+
§ Potentiel standard du couple Ag /Ag : E°=0,80 V.
4
Vous aimerez peut-être aussi
- Commander Le MatinDocument46 pagesCommander Le MatinDavid Konan91% (22)
- TD.1 Mecanique PDFDocument2 pagesTD.1 Mecanique PDFDavid Konan100% (3)
- Dissertation Correction PDFDocument1 pageDissertation Correction PDFDavid KonanPas encore d'évaluation
- Lactologia TecnicaDocument77 pagesLactologia TecnicaRUBEN EDWIN OLAYA RUIZPas encore d'évaluation
- Correction Epreuve de Chimie Des Electrolytes 2014 2015 2Document5 pagesCorrection Epreuve de Chimie Des Electrolytes 2014 2015 2Chimiste ChimistePas encore d'évaluation
- Electrochimie ChafouDocument12 pagesElectrochimie ChafouSamah SoltanePas encore d'évaluation
- Chapitre VDocument4 pagesChapitre VBelinda Dancheu100% (1)
- Corrosion Et ProtectionDocument3 pagesCorrosion Et ProtectionMariam ZouhairPas encore d'évaluation
- TD Thermodynamique Des ÉquilibresDocument19 pagesTD Thermodynamique Des Équilibresbrahimza61Pas encore d'évaluation
- L'électrochimieDocument46 pagesL'électrochimieSeçil ÖzdemirPas encore d'évaluation
- TP Soha - rtf2Document12 pagesTP Soha - rtf2Zakariae BennacerPas encore d'évaluation
- Serie 3correctionDocument7 pagesSerie 3correctionkiritosunny30100% (1)
- Exo Redox CompletDocument10 pagesExo Redox CompletMira insaf MekkiPas encore d'évaluation
- Chapitre III Cinétique Réactions Parallèles 2021 L3 Section BDocument33 pagesChapitre III Cinétique Réactions Parallèles 2021 L3 Section BLi NaPas encore d'évaluation
- Correction Epreuve de Chimie Des Electrolytes 2014 20152Document5 pagesCorrection Epreuve de Chimie Des Electrolytes 2014 20152Abdelhakim BailalPas encore d'évaluation
- Electrolyse Exercices Corriges 03Document6 pagesElectrolyse Exercices Corriges 03znidi mohaPas encore d'évaluation
- TD 4Document2 pagesTD 4ismail100% (1)
- L SMC S4 M43 113 1 PDFDocument19 pagesL SMC S4 M43 113 1 PDFŘachida LkPas encore d'évaluation
- Courbesintensite 2015 CoursDocument30 pagesCourbesintensite 2015 CourscherniPas encore d'évaluation
- R Acteur Fiche N2 TD Avec Solution - TextMarkDocument7 pagesR Acteur Fiche N2 TD Avec Solution - TextMarkRay CharlesPas encore d'évaluation
- 1année S2 Chimie II OxydoréductionDocument9 pages1année S2 Chimie II OxydoréductionDenis KaldjobPas encore d'évaluation
- Thermochimie 1Document2 pagesThermochimie 1Imane GhanouPas encore d'évaluation
- Cours Potentiel Demi-VagueDocument15 pagesCours Potentiel Demi-VagueLise LangPas encore d'évaluation
- Corrige Examen Smc3 2016 17 NormalDocument3 pagesCorrige Examen Smc3 2016 17 Normalayyoub dhbPas encore d'évaluation
- Partie Pratique TP 01Document4 pagesPartie Pratique TP 01Hadjer zitPas encore d'évaluation
- TD1 - CorrectionDocument8 pagesTD1 - Correctionmm72c48gbgPas encore d'évaluation
- TP 2 CinetiqueDocument23 pagesTP 2 CinetiqueIlham ElfaykPas encore d'évaluation
- Calcul Des Reacteurs Chimiques HomogeneDocument16 pagesCalcul Des Reacteurs Chimiques HomogeneجعدبندرهمPas encore d'évaluation
- TD N°2 2020Document2 pagesTD N°2 2020Ñar ĎjesPas encore d'évaluation
- Cours Diagrammes Binaires Liquide-Vapeur-1Document71 pagesCours Diagrammes Binaires Liquide-Vapeur-1MOHAMED MAZOUARIPas encore d'évaluation
- TD - Chapitre 1Document6 pagesTD - Chapitre 1CharlesPas encore d'évaluation
- 5351 Entrainement TSDocument6 pages5351 Entrainement TSmohammed laadili100% (1)
- Courbes Courant-PotentielDocument12 pagesCourbes Courant-PotentielYoussef ChePas encore d'évaluation
- Correction Epreuve de Chimie Des Electrolytes 2014 2015Document5 pagesCorrection Epreuve de Chimie Des Electrolytes 2014 2015Imene GhmrPas encore d'évaluation
- Physique Nucléaire TD Corr 01Document5 pagesPhysique Nucléaire TD Corr 01bouzerarPas encore d'évaluation
- Phenomene de Surface Série 03 Avec CorrigéDocument6 pagesPhenomene de Surface Série 03 Avec CorrigéLilà ØūkhPas encore d'évaluation
- Controle Dosage1sDocument2 pagesControle Dosage1sKhalid khalid100% (1)
- TP ThermoDocument7 pagesTP Thermosofia safaaPas encore d'évaluation
- Diagramme de FrostDocument19 pagesDiagramme de FrostmehdiPas encore d'évaluation
- COURSDocument32 pagesCOURSthomas yapiPas encore d'évaluation
- Cin Exo PDFDocument10 pagesCin Exo PDFImed SeghierPas encore d'évaluation
- Chapitre 1Document4 pagesChapitre 1Amina BadaouiPas encore d'évaluation
- TD - Cpgo - 2023-2024 - Cinetique ChimiqueDocument4 pagesTD - Cpgo - 2023-2024 - Cinetique Chimiquedieudonnepooda71Pas encore d'évaluation
- TD 2 Opu Skikda 2019-20Document7 pagesTD 2 Opu Skikda 2019-20mahi mahiPas encore d'évaluation
- Chapitre IDocument12 pagesChapitre INak awadPas encore d'évaluation
- CF Chimie Des Solutions SMPC2 Ratrappage 2016Document4 pagesCF Chimie Des Solutions SMPC2 Ratrappage 2016Hamza m'rabet100% (3)
- Méthodes Electrochimiques (Partie 2)Document12 pagesMéthodes Electrochimiques (Partie 2)Lina BahazPas encore d'évaluation
- Exos CH 05Document2 pagesExos CH 05lol testPas encore d'évaluation
- TD ElectrochimieDocument4 pagesTD ElectrochimieRaja RajouPas encore d'évaluation
- Serie 2 Electrochimie Avec CorrectionDocument22 pagesSerie 2 Electrochimie Avec Correctionimad sahliPas encore d'évaluation
- Introduction A La Science PolitiqueDocument8 pagesIntroduction A La Science PolitiqueAs NordinePas encore d'évaluation
- CHAPITRE III La SolubilitéDocument9 pagesCHAPITRE III La Solubilitéfullhd qatkaPas encore d'évaluation
- TD R.CDocument12 pagesTD R.CPRAIIIZ FouPas encore d'évaluation
- Polycope TP-TMDocument4 pagesPolycope TP-TMamiour krimo100% (1)
- Chapitre IIDocument8 pagesChapitre IIZakaria BelmouloudPas encore d'évaluation
- Eq Entre Phases Binaires 2019-2020 PDFDocument34 pagesEq Entre Phases Binaires 2019-2020 PDFبن الصغير البشيرPas encore d'évaluation
- Examen Chimie-2 Blida 2011Document4 pagesExamen Chimie-2 Blida 2011Feriel ZekriPas encore d'évaluation
- Chimie Des Électrolytes MergeDocument3 pagesChimie Des Électrolytes MergeŘachida Lk100% (2)
- Aimf2 2 2011Document24 pagesAimf2 2 2011oumayma afdhalPas encore d'évaluation
- 3-Le Second Principe de La ThermodynamiqueDocument12 pages3-Le Second Principe de La ThermodynamiqueAntes de Partir, A.C.Pas encore d'évaluation
- OS Corrige RedoxDocument31 pagesOS Corrige RedoxMahdiNaani100% (2)
- Chapitre 3 Solubilité CoursDocument6 pagesChapitre 3 Solubilité CoursAlex LakhPas encore d'évaluation
- RedoxDocument4 pagesRedoxCidss CssPas encore d'évaluation
- 26 Electrolyse Td-CorrigeDocument10 pages26 Electrolyse Td-CorrigeChiboubPas encore d'évaluation
- Corrige de TD de Mecanique Quantique 1 PDFDocument26 pagesCorrige de TD de Mecanique Quantique 1 PDFDavid Konan67% (3)
- Travaux Diriges de Mecanique Quantique PDFDocument6 pagesTravaux Diriges de Mecanique Quantique PDFDavid Konan100% (1)
- Mise en Œuvre Pratique Des Lois de Coulomb PDFDocument1 pageMise en Œuvre Pratique Des Lois de Coulomb PDFDavid KonanPas encore d'évaluation
- Decrement Logarithmique PDFDocument2 pagesDecrement Logarithmique PDFDavid Konan67% (3)
- Approche Documentaire Microscope À Effet TunnelDocument3 pagesApproche Documentaire Microscope À Effet TunnelDavid KonanPas encore d'évaluation
- Approche Documentaire Sur La Radioactivité PDFDocument4 pagesApproche Documentaire Sur La Radioactivité PDFDavid KonanPas encore d'évaluation
- Chap 1 Changement de RéférentielDocument18 pagesChap 1 Changement de RéférentielDavid Konan100% (1)
- TD 3 Mecanique PDFDocument2 pagesTD 3 Mecanique PDFDavid KonanPas encore d'évaluation
- 038 - Etude D'une Equation Fonctionnelle 2Document2 pages038 - Etude D'une Equation Fonctionnelle 2David KonanPas encore d'évaluation
- Feuilletage PDFDocument14 pagesFeuilletage PDFDavid KonanPas encore d'évaluation
- xmp2016 Enonce PDFDocument6 pagesxmp2016 Enonce PDFDavid KonanPas encore d'évaluation
- Chap 3 Lois de Frottement PDFDocument12 pagesChap 3 Lois de Frottement PDFDavid Konan100% (1)
- Hymne de La Flamme Linguistique Corrigé PDFDocument1 pageHymne de La Flamme Linguistique Corrigé PDFDavid KonanPas encore d'évaluation
- DM Mpsi Une Famille de Fonctions PDFDocument12 pagesDM Mpsi Une Famille de Fonctions PDFDavid KonanPas encore d'évaluation
- Corro TD - Continuite - Des - Fonctions - A - Valeurs - Reelles - Ou - Complexes PDFDocument15 pagesCorro TD - Continuite - Des - Fonctions - A - Valeurs - Reelles - Ou - Complexes PDFDavid Konan100% (1)
- Devoir Sur Table - Suites, Arithmetique Et Structures Algebr PDFDocument2 pagesDevoir Sur Table - Suites, Arithmetique Et Structures Algebr PDFDavid KonanPas encore d'évaluation
- DM Mpsi Quatre Etudes Fonctions PDFDocument10 pagesDM Mpsi Quatre Etudes Fonctions PDFDavid KonanPas encore d'évaluation
- DIAGRAMME E - PH PDFDocument6 pagesDIAGRAMME E - PH PDFDavid KonanPas encore d'évaluation
- Devoir Surveille PDFDocument5 pagesDevoir Surveille PDFDavid Konan100% (1)
- Signaux Physiques - Chapitre 4-Circuits Lineaires Du Second Ordre PDFDocument45 pagesSignaux Physiques - Chapitre 4-Circuits Lineaires Du Second Ordre PDFDavid Konan100% (1)
- Correction TD SuitesDocument15 pagesCorrection TD SuitesDavid KonanPas encore d'évaluation
- Corrige Devoir Surveille - 2 PDFDocument6 pagesCorrige Devoir Surveille - 2 PDFDavid KonanPas encore d'évaluation
- Signaux Physiques - Chapitre 3-Circuits Lineaires Du Premier Ordre PDFDocument46 pagesSignaux Physiques - Chapitre 3-Circuits Lineaires Du Premier Ordre PDFDavid KonanPas encore d'évaluation
- CorrectionIrrationaliteE PDFDocument3 pagesCorrectionIrrationaliteE PDFDavid KonanPas encore d'évaluation
- Devoir Maison 8Document1 pageDevoir Maison 8David KonanPas encore d'évaluation
- Signaux Physiques - Chapitre 3-Circuits Lineaires Du Premier Ordre PDFDocument58 pagesSignaux Physiques - Chapitre 3-Circuits Lineaires Du Premier Ordre PDFDavid Konan100% (1)
- Signaux Physiques - Chapitre 2-Theoremes de Bases D'analyses de Circuits Electriques-1 PDFDocument38 pagesSignaux Physiques - Chapitre 2-Theoremes de Bases D'analyses de Circuits Electriques-1 PDFDavid Konan100% (2)
- 2nd C - C9 Tests Didentification de Quelques IonsDocument8 pages2nd C - C9 Tests Didentification de Quelques IonsSoroPas encore d'évaluation
- Chapitre 1 Bio Molecule 22-23 PolyDocument15 pagesChapitre 1 Bio Molecule 22-23 PolyAyyûb BûhâfrâPas encore d'évaluation
- Chapitre 7 Actions Des Solutions Acides Et Basiques Sur Quelques MetauxDocument2 pagesChapitre 7 Actions Des Solutions Acides Et Basiques Sur Quelques Metauxmohamed aouby100% (2)
- Les Especes Chimiques Cours 1Document3 pagesLes Especes Chimiques Cours 1Oussama EljaafariPas encore d'évaluation
- PC & D Fiche Du 23 Fevrier 2019Document2 pagesPC & D Fiche Du 23 Fevrier 2019LeNantais SonderangebotePas encore d'évaluation
- Partie Expérimentale I ChlorationDocument4 pagesPartie Expérimentale I ChlorationYa CinPas encore d'évaluation
- Controle 1 - S1 3AC Prof - Es-Saoudi (WWW - Pc1.ma)Document1 pageControle 1 - S1 3AC Prof - Es-Saoudi (WWW - Pc1.ma)bobomomoPas encore d'évaluation
- La Concentration Et Les Solutions Electrolytiques Resume de Cours 2 4Document4 pagesLa Concentration Et Les Solutions Electrolytiques Resume de Cours 2 4Mustâphã NbâhëddáPas encore d'évaluation
- Chimie PDFDocument94 pagesChimie PDFDON DEVATTIPas encore d'évaluation
- Acide Base 2023 2014 (Mtarrab Badr) (Douz)Document2 pagesAcide Base 2023 2014 (Mtarrab Badr) (Douz)siwar kadhiPas encore d'évaluation
- 2 - Les Acides Et Les BasesDocument21 pages2 - Les Acides Et Les BasesAmine CompanPas encore d'évaluation
- Nettoyage Des Monnaies Et Objets DiversDocument12 pagesNettoyage Des Monnaies Et Objets DiversHumbertoPas encore d'évaluation
- Cours Le PH d' Une SolutionDocument5 pagesCours Le PH d' Une SolutionTom AndlerPas encore d'évaluation
- Diagramme D'elinghameDocument10 pagesDiagramme D'elinghameHassan Ba-haddouPas encore d'évaluation
- Vannes Papillon PDFDocument47 pagesVannes Papillon PDFBourtima TayebPas encore d'évaluation
- Chapiter 1Document5 pagesChapiter 1Nak awadPas encore d'évaluation
- Arar LaidDocument72 pagesArar LaidMoone MessPas encore d'évaluation
- Chimie Organique Fiche CoursDocument10 pagesChimie Organique Fiche CoursgajonePas encore d'évaluation
- Dosage-2 PDFDocument3 pagesDosage-2 PDFEya Mallouli100% (1)
- TeaserDocument9 pagesTeasermehdi hennousPas encore d'évaluation
- Bimepox Noir 2Document1 pageBimepox Noir 2Abdou SebtiPas encore d'évaluation
- 2009 Lyon Nebois Alcynes ExosDocument4 pages2009 Lyon Nebois Alcynes ExosAriel DongbaPas encore d'évaluation
- Chimie AnalytiqueDocument71 pagesChimie Analytiquemejri amalPas encore d'évaluation
- Samedi, Le 18 Juin 2022 Faculte Des Sciences Biologie Physiologie Animal Departement de Biochimie Année-Scolaire: 2021-2022Document12 pagesSamedi, Le 18 Juin 2022 Faculte Des Sciences Biologie Physiologie Animal Departement de Biochimie Année-Scolaire: 2021-2022Kokou AliPas encore d'évaluation
- Separation Et Identification Des CationsDocument1 pageSeparation Et Identification Des CationsNadiPas encore d'évaluation
- Co O 23 EsterificationDocument2 pagesCo O 23 Esterificationbassilchloe9Pas encore d'évaluation
- Compte Rendu TP N°1: Ph-Métrie Dosage Acide Benzoïque Par NAOHDocument8 pagesCompte Rendu TP N°1: Ph-Métrie Dosage Acide Benzoïque Par NAOHhidayatmazar996100% (1)
- TP Spectro Manip 2 Hicham NedDocument4 pagesTP Spectro Manip 2 Hicham NedMohamed NkPas encore d'évaluation
- Savons Et DétergentsDocument21 pagesSavons Et DétergentscabeaureyPas encore d'évaluation