Académique Documents
Professionnel Documents
Culture Documents
Revision PDF
Revision PDF
Transféré par
Chimiste ChimisteTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Revision PDF
Revision PDF
Transféré par
Chimiste ChimisteDroits d'auteur :
Formats disponibles
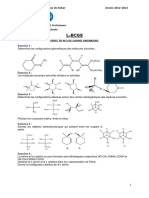
EXERCICES de RÉVISION
Synthèse de la vitamine E
CH3
HO
H CH3 H CH3
H3C O
CH3
On condense une partie aromatique A et la chaîne latérale B.
CH3
HO
O O H CH3 H CH3
C
O 4 8
H3C CH3 H
CH3 A B
I-1- Donner la configuration de tous les carbones asymétriques de A et B.
2- Le composé B est synthétisé à partir de la molécule C. On passe d’abord de C à I suivant
le schéma :
H3C CH3 H3C CH2
O O
1-O3
E + HCOOH
O 2-H2O
D
C CH3 H3C H3C Br
CH3
OH
NaBH4 Δ,H3O NaBH4 ?
E F G C9H14O
puis H2O puis H2O
H I
CH3 CH3
C. Viel – Lyc. D’Arsonval – St Maur / RNChimie 1/10
a- On protège la fonction carbonyle de C en formant le composé D. Simultanément
on observe la migration de la double liaison éthylénique. Quel est le réactif
nécessaire pour réaliser la protection du carbonyle ? Donner uniquement le
mécanisme de cette réaction en précisant les conditions opératoires.
b- Donner les structures des composés E et F.
c- Le passage de F à G se fait en deux étapes. La première est la déprotection de la
fonction carbonyle. Préciser la seconde en donnant la formule de G ainsi que son
mécanisme de formation.
d- Imaginer une suite de réactions, en précisant les conditions opératoires, pour passer
de H à I.
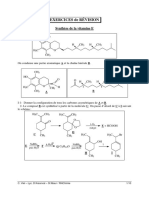
II-La fin de la synthèse du composé B est donnée dans le schéma suivant :
O O
1-EtONa/EtOH
COOEt K
2-composé I + CO2 + EtO
J L
CH3
O
O
M B
COOH
CH3
1- Donner, en précisant les conditions expérimentales, le mécanisme de formation du
dérivé J à partir du 3-méthylbutanoate d’éthyle et de l’éthanoate d’éthyle.
2- Donner la structure de K.
3- Préciser les conditions opératoires des transformations :
K→ L L→M M→B
4- De quel isomère de la pulégone C doit-on partir pour obtenir la configuration
souhaitée du carbone 4 dans le composé B ? Justifier.
III- Détailler le passage de A et B à la vitamine E.
C. Viel – Lyc. D’Arsonval – St Maur / RNChimie 2/10
Synthèse d’un inhibiteur d’enzyme
A- On envisage la synthèse d’un inhibiteur de la D-Alanine ligase X de formule :
H OH
H3C CH2
H2N N
O H
Désigner les carbones asymétriques de X. Donner leur configuration absolue.
B- La synthèse de X nécessite la préparation de C, un amino aldéhyde de configuration R,
protégé sur la fonction amine par un groupement protecteur P (Boc)? C est obtenu à
partir de A suivant le schéma réactionnel ci-dessous :
O
CH3OH,H ?
P-NH-CH-CO2H B P-NH-CH-C
A CH3 C CH3 H
1- Comment appelle-t-on la réaction de passage de A à B ? Donner la formule et
le mécanisme de formation de B.
2- Proposer un (ou des) réactif(s) pour réaliser le passage de B à C en une ou
plusieurs étapes.
3- Donner la configuration de l’amino-acide protégé de départ A ; Justifier.
C- Le composé C est transformé en G par la suite des réactions suivantes :
O
KCN H2
P-NH-CH-C D E
(H ) cat
CH3 H
O
O
anhydride ?
E F P-NH-CH-C-CH2- N
phtalique
G
CH3
O
1- Donner la formule développée plane et le mécanisme de formation de D.
2- Donner la formule de E.
3- Donner la formule et le mécanisme de formation de F.
4- Proposer un réactif de passage de F à G.
C. Viel – Lyc. D’Arsonval – St Maur / RNChimie 3/10
D- Le composé G conduit à l’inhibiteur X par le schéma réactionnel décrit ci-dessous :
O
O
KCN
P-NH-CH-C-CH2- N H HClcc I
(H ) Δ
G
CH3
O
I
CH3OH,H
J
hydrolyse par
K Δ L
CF3CO2H
hydrate d'hydrazine
X
dioxane
1- Le traitement de G par le cyanure de potassium, en milieu acide, conduit à H
sous forme d’un mélange de deux stéréoisomères. Donner la formule plane de
H. Désigner les carbones asymétriques. Quelle est leur relation de
stéréoisomérie ?
2- H est hydrolysé en milieu acide pour conduire à I. Donner la formule de I et
proposer un mécanisme pour cette hydrolyse.
3- Donner la formule de J puis celle de K.
4- Donner le mécanisme de formation de L à partir de K.
5- A partir de quel stéréoisomère de H faut-il partir pour accéder à X ? Justifier.
C. Viel – Lyc. D’Arsonval – St Maur / RNChimie 4/10
A propos d’un dérivé de l’anisole
Les parties I et II de ce problème permettent de déterminer la formule structurale d’un
composé A.
La partie III traite de réactions à partir de dérivés de A.
La partie IV s’intéresse à la synthèse de A.
La partie V consiste à identifier un isomère de A à l’aide de spectres R.M.N.
Partie I
L’analyse pondérale du composé organique A de formule CxHyOz a donné les résultats
suivants :
C : 80,4 % H : 7,6 %
Ces nombres sont entachés d’une certaine erreur expérimentale.
Une cryoscopie dans l’acide éthanoïque donne pour masse molaire 139 à 10% près.
Quelle est la formule de A.
Partie II
Pour établir sa formule développée on procède à une analyse fonctionnelle, d’ailleurs
surabondante. Expliquer à chaque fois ce qu’apportent les renseignements fournis.
1- Le spectre I.R. de A présente, entre autres, une bande nette vers 1635 cm-1.
2- A décolore à froid le dibrome à raison d’une mole par mole, et le résultat de
cette action , B , soumis à l’action de la potasse alcoolique concentrée et
bouillante, conduit à la formation d’un composé C qui précipite en jaune le
chlorure cuivreux ammoniacal.
3- L’hydrogénation catalytique ménagée de A, 25°C et 1 bar, à raison de mole
de dihydrogène par mole de A, le transforme en un composé D .
Celui-ci sous l’action de HI aqueux et concentré, à l’autoclave à 150°C, est
scindé en iodométhane et en un composé E, peu soluble dans l’eau, soluble
dans la potasse aqueuse , et colorant intensément une solution de chlorure
de fer(III).
4- A, sous l’action modérée de l’ozone, puis d’une hydrolyse réductrice,
fournit à côté de méthanal, un composé F, caractérisé en I.R. par une très
forte bande vers 1700 cm-1 et en R.M.N. du proton par un signal à 9,5 ppm.
Sur F, on fait réagir la potasse concentrée ; il en résulte un composé
C8H10O2, peu soluble dans l’eau et qui se sépare. La phase aqueuse, traitée
par un léger excès de HCl, laisse déposer un autre composé C8H8O3. Les
deux composés C8H10O2 et C8H8O3 prennent naissance en quantités
équimolaires.
5- E est soumis à l’hydrogénation catalytique en présence de nickel vers
280°C. Dans d’autres conditions, il pourrait fixer « moles de dihydrogène
par mole, mais, dans celles précisées, il n’en fixe que 2. Le composé G
obtenu (C8H14O) présente une large bande en I.R. vers 1715 cm-1.
6- G est soumis à une oxydation permanganique assez poussée ; il en résulte
la formation compétitive de deux isomères de position H et I (C8H14O4).
Montrer que ces données sont largement suffisantes pour établir sans
ambiguïté la formule développée de E, donc celle de A.
7- Établir un tableau pour donner toutes les formules développées de A à I .
C. Viel – Lyc. D’Arsonval – St Maur / RNChimie 5/10
Partie III
H et I sont, séparément, portés à une longue ébullition avec un excès d’éthanol en présence de
traces d’acide fort, ce qui les transforme respectivement en H’ et I’.
H’, sous l’influence de l’éthylate de sodium, conduit concurremment à deux composés
isomères J et K, de formule brute C10H16O3.
J et K sont saponifiés avec précautions ; repris en milieu acide, ils sont ensuite chauffés à
haute température, 130°C, et l’on observe un dégagement gazeux qui trouble l’eau de chaux.
Ils conduisent ainsi, l’un et l’autre, à un même composé L.
Les mêmes opérations sont effectuées sur I’. Par l’intermédiaire de deux isomères M et N,
isomères de J et K mais différents de J et K, elles conduisent finalement à un même composé
P, isomère de L.
1- Quelle est la réaction qui transforme H’ en J et K ?
2- Donner le mécanisme de formation de J et K.
3- Donner aussi le mécanisme de transformation de J et K en L.
4- Faire un tableau pour donner toutes les formules de H’ et I’ jusqu’à P.
Partie IV
Proposer une synthèse de A faisant appel, au départ, au benzène, à des composés organiques
courants (ne dépassant pas 2 atomes de carbone) et à tout réactif minéral jugé nécessaire.
Partie V
Identifier le composé dont les spectres R.M.N. du proton et du carbone 13 sont donnés ci-
dessous , ce composé étant un isomère de A.
SPECTRES R.M.N. de l’isomère de A
C. Viel – Lyc. D’Arsonval – St Maur / RNChimie 6/10
Synthèse de l’Ellipticine
L’ellipticine est un alcaloïde naturel extrait d’une plante qui pousse en Nouvelle Calédonie.
Ce composé possède des propriétés anticancéreuses et
l’un des ses dérivés est sur le marché sous le nom de CH3
CELIPTIUM® (1).
On se propose d’étudier une méthode d’accès au N
squelette de base de ces dérivés en prenant comme
modèle l’ellipticine (2) de formule ci-contre : N
H CH3
On donnera les formules des composés représentés par
des numéros et on répondra aux questions.
Dans un premier temps on effectue la monobromation du paraxylène (ou 1,4-
diméthylbenzène) en présence de FeBr3. On obtient (3).
On réalise ensuite la séquence suivante :
(3) + Mg éther (4)
éther
(4)+ H-COOC2H5 (5) après hydrolyse
- 60°C
Le spectre I.R de (5) présente une forte absorption vers 1700 cm-1. Si l’on avait opéré à
température ambiante et avec un excès du composé (4) on aurait obtenu un composé (6) à la
place de (5). On donnera les mécanismes d’obtention de (5) et (6).
L’action du mélange sulfonitrique sur (5) conduit à un mélange de trois composés. La
synthèse continue après avoir isolé le produit le plus encombré (7). Quels sont les deux autres
isomères formés?
Le composé (7) est traité par l’hydroxylamine pour former (8) qui est déshydraté en milieu
acide pour conduire à (9).
L’action du dihydrogène sous 10 bar , à 25°C et en présence de nickel, permet la formation de
(10) qui subit alors les réactions suivantes :
HCl CuCl
(10) + NaNO2 (11) (12)
0°C
Préciser le mécanisme (10)→ (11).
L’action du mélange sulfonitrique sur (12) conduit à (13).Une CH3
hydrogénation catalytique conduit à (14) avec formation de (14)
chlorure d’hydrogène et d’eau.
Justifier l’orientation de la réaction (12)→ (13).
(14) est soumis à l’action du nitrite de sodium en milieu acide
H2N CN
chlorhydrique et à 0°C. On obtient (15) qui, toujours en milieu
chlorhydrique, est opposé au chlorure d’étain(II) à froid. Il se CH3
forme (16) après retour en milieu légèrement basique.
C. Viel – Lyc. D’Arsonval – St Maur / RNChimie 7/10
(16) est alors condensé sur la cyclohexanone à pH=6 selon
(18) CH3 un mécanisme que l’on précisera pour donner un composé
(17) qui subit un réarrangement complexe et former (18).
(18) subit alors la série de transformations suivantes :
N CN H
(18) + 2 H2O (19) + NH4
H CH3
H
(19) + CH3OH (20) + H2O
(20) est alors déshydrogéné à chaud en présence de sélénium pour former (21), lequel subit
l’action du tétrahydruroaluminate de lithium dans l’éther puis une hydrolyse pour aboutir à
(22). Ce dernier par action du trioxyde de chrome dans la pyridine fournit (23).
Cette méthode pour passer de (18) à (23) est assez ancienne. Comment pourrait-on effectuer
cette transformation beaucoup plus rapidement aujourd’hui ?
Le composé (23) se condense mole à mole avec le nitrométhane en milieu basique pour
former (24) et de l’eau. Détailler la mécanisme de cette réaction en justifiant la mobilité des
hydrogènes du nitrométhane et en faisant une analogie avec une réaction des dérivés
carbonylés.
(24) est réduit en (25) pour former un groupement éthylamino. Préciser les conditions
expérimentales.
(25) est soumis à l’action de l’acide méthanoïque mole à mole, à chaud. On forme (26) .
Justifier la plus grande réactivité d’une fonction amine sur l’autre.
Deux réactions, cyclisation et oxydation , permettent enfin de former l’Ellipticine (2).
C. Viel – Lyc. D’Arsonval – St Maur / RNChimie 8/10
Synthèse d’une phéromone sexuelle
Le grandisol A est la phéromone sexuelle de l’Anthonomus grandis, insecte provoquant des
dégâts importants dans les champs de coton. Pour lutter contre ce fléau de nombreux groupes
de recherche ont entrepris sa synthèse totale. Cet exercice s’appuie sur l’une des nombreuses
voies de synthèses proposées.
Formule du grandisol :
OH
1- L’acide chloroéthanoïque opposé à du cyanure de potassium en excès donne B
(C3H3NO2) après acidification prudente.
a- Ecrire l’équation bilan et proposer un mécanisme pour cette transformation.
b- Pourquoi doit-on opérer prudemment ?
c- Le composé B, en milieu éthanol-éthanolate de sodium, conduit au dianion B’.
développer une structure de Lewis de ce dernier et justifier sa formation.
2- Le traitement du p-aminophénol par le nitrite de sodium en milieu acide vers 5°C,
suivi de l’addition de KBr en présence de Cu2Br2 conduit à C.
a- Quel est le composé formé lors de la première réaction ?
b- Écrire la formule semi-développée de C.
c- En milieu basique aqueux (pH=10), la réaction de C avec le bromométhane
fournit majoritairement un éther-oxyde D. Quel rôle joue le milieu basique
dans cette réaction ? Quelle est la formule semi-développée de D ?
Un autre produit, minoritaire, se forme dans cette réaction par C-alkylation.
Quel est cet autre produit ? Justifier par un mécanisme.
3- L’organomagnésien issu de D est traité par la carboglace, puis le milieu est hydrolysé
par une solution aqueuse acide. On sépare E qui, par une suite de deux réactions, est
transformé en F. F donne un test positif à la 2,4-DNPH et à la liqueur de Fehling.
a- Écrire le mécanisme d’action du magnésien sur la carboglace.
b- Quel critère thermodynamique doit-on utiliser pour fixer l’ordre de grandeur
du pH de l’hydrolyse ?
c- Lors de cette dernière réaction on observe un abondant dégagement gazeux.
Quelles sont sa nature et son origine ?
d- Expliquer les renseignements fournis par les deux tests positifs de F.
e- Quelle est la suite de deux réactions transformant E en F ?
f- Les spectres R.M.N. du proton et I.R. de F sont donnés en annexe :les
commenter.
4- L’addition de B’ sur F conduit par formation d’une nouvelle liaison carbone-carbone à
G (après hydrolyse) dont la déshydratation acido-catalysée fournit H (C11H9NO3). Une
C. Viel – Lyc. D’Arsonval – St Maur / RNChimie 9/10
hydrogénation en présence de nickel de Raney à 25°C et sous 1 bar permet de
transformer H en I. La décarboxylation de I conduit à J.
a- Donner les formules semi-développées de G à J.
b- Écrire le mécanisme cyclique à 6 centres de la décarboxylation de I.
c- Le traitement de J par le dibrome en solution dans l’acide éthanoïque et en
présence de AlBr3 permet d’obtenir K. Donner la formule semi-développée de
K et justifier l’orientation de cette réaction.
5- Une suite de réactions non décrites permet de transformer K en L de formule :
H3C
O
H
L’addition d’un excès d’iodure de méthylmagnésium sur L fournit après hydrolyse
acide deux produits isomères M et M’. M’ possède une bande de vibration en I.R. à
1740 cm-1 que ne présente pas M.
a- Justifier la formule de M’ et donner la formule semi-développée de M.
b- Comment pourrait-on favoriser la formation de M’ ? la formation de M ?
6- L’ozonation de M’, suivie d’une hydrolyse en milieu réducteur permet d’isoler N qui
présente le même squelette carboné que le grandisol. Proposer une structure pour N en
envisageant la participation d’une forme isomère de M’ dont on justifiera la présence
dans le milieu réactionnel.
7- Le traitement de N par le méthanol en léger excès et en milieu acide fournit O. Par
action de NaBH4 en solution hydroalcoolique, O est transformé en P. Le chauffage en
milieu sulfurique de P donne Q dont la réduction permet d’obtenir le grandisol A.
a- Donner les formules semi-développées de O, P et Q.
b- Pourquoi utilise-t-on NaBH4 dans la transformation de O en P ?
c- Quel est le réactif permettant de transformer Q et d’obtenir le grandisol ?
d- Préciser les configurations absolues des atomes de carbone asymétriques du
grandisol.
spectres R.M.N. du proton et I.R. de F
C. Viel – Lyc. D’Arsonval – St Maur / RNChimie 10/10
Vous aimerez peut-être aussi
- 2009 Lyon Walchshofer Radix StrucMolOrgaCours PDFDocument19 pages2009 Lyon Walchshofer Radix StrucMolOrgaCours PDFAbdessamed GherbaouiPas encore d'évaluation
- Examen Correction L1 Chimie Organique 2006 2Document7 pagesExamen Correction L1 Chimie Organique 2006 2med madPas encore d'évaluation
- Série 3 SMC4Document5 pagesSérie 3 SMC4anwar jakriPas encore d'évaluation
- Examen Corrigé Hydro Smc4 by - Chimist ChimistDocument5 pagesExamen Corrigé Hydro Smc4 by - Chimist ChimistYc YacinePas encore d'évaluation
- Orga - 23 SN1 ET SN2Document7 pagesOrga - 23 SN1 ET SN2زيد بخليفةPas encore d'évaluation
- 2 AlcenesDocument8 pages2 Alcenesam47Pas encore d'évaluation
- Td11chim2019 2020Document3 pagesTd11chim2019 2020Med Stu DentPas encore d'évaluation
- Corrige Session 2 2015 16Document7 pagesCorrige Session 2 2015 16Khalid ZegPas encore d'évaluation
- UntitledDocument3 pagesUntitledAbdeldjalil MayachePas encore d'évaluation
- Serie TD 2 L2BCGS 2022 - 2023-5Document2 pagesSerie TD 2 L2BCGS 2022 - 2023-5Daour NdiayePas encore d'évaluation
- HydroborationDocument2 pagesHydroborationIsmail ZitouniPas encore d'évaluation
- A 3 CompetitionDocument3 pagesA 3 CompetitionEmilie BoubinetPas encore d'évaluation
- TD Orga3 L3 S5Document2 pagesTD Orga3 L3 S5DialloPas encore d'évaluation
- Video 53Document10 pagesVideo 53Dr VerdasPas encore d'évaluation
- SMC4 Examen Juin 2013Document5 pagesSMC4 Examen Juin 2013Yc YacinePas encore d'évaluation
- Chap 4 DiènesDocument16 pagesChap 4 DiènesWahab HoubadPas encore d'évaluation
- 0 C 40 F 13 A 769 Aef 3 Ca 505Document4 pages0 C 40 F 13 A 769 Aef 3 Ca 505api-497754935Pas encore d'évaluation
- Aldehydes CetonesDocument29 pagesAldehydes CetonesAhmad Elhamri100% (1)
- Chapitre3 Caracterisation de Quelques IonsDocument7 pagesChapitre3 Caracterisation de Quelques IonsAlhou Inabigue HarounaPas encore d'évaluation
- Série 5Document1 pageSérie 5simo Gri100% (1)
- Chimie Orga 1Document61 pagesChimie Orga 1Badr ZemmouriPas encore d'évaluation
- ExercicesDocument5 pagesExercicesSARAHPas encore d'évaluation
- HEI Chimie-Organique 2002 CHIMIEDocument3 pagesHEI Chimie-Organique 2002 CHIMIESalma SellamiPas encore d'évaluation
- Chap2 Aldéhydes Et CétonesDocument34 pagesChap2 Aldéhydes Et CétonesEssemlali Abde SamadPas encore d'évaluation
- Chimie-Organique Exo1Document1 pageChimie-Organique Exo1Bouhamey TraorePas encore d'évaluation
- TD Atomistique2Document3 pagesTD Atomistique2pitter PitkethlyPas encore d'évaluation
- Corrige Examen Session NormaleDocument6 pagesCorrige Examen Session NormaleKhlidPas encore d'évaluation
- TD Nomenclature Corrigé12goodprepa PDFDocument3 pagesTD Nomenclature Corrigé12goodprepa PDFNour EddinePas encore d'évaluation
- TD1-Complèmentaire-Corps PurDocument5 pagesTD1-Complèmentaire-Corps PurmennanesalaheddinePas encore d'évaluation
- Diagrammes Potentiel-PhDocument7 pagesDiagrammes Potentiel-Phaymane el hachimiPas encore d'évaluation
- TD 3Document7 pagesTD 3Abdou HajjajiPas encore d'évaluation
- Exam-Corrige Chimie PDFDocument4 pagesExam-Corrige Chimie PDFNassimaPas encore d'évaluation
- TD4 Et Solution - S4 - Word-1Document9 pagesTD4 Et Solution - S4 - Word-1MohamedPas encore d'évaluation
- 15209cours Orga M1 CMS Reactions PericycliquesDocument33 pages15209cours Orga M1 CMS Reactions PericycliquesLaura DijouxPas encore d'évaluation
- Examen Cin Et Cat Avec Correction de Ratt 2017-2018Document6 pagesExamen Cin Et Cat Avec Correction de Ratt 2017-2018Chai MaePas encore d'évaluation
- Corrige Exercices RMN ProtonsDocument2 pagesCorrige Exercices RMN ProtonssouPas encore d'évaluation
- TD Chapitre 8 SNDocument4 pagesTD Chapitre 8 SNزيد بخليفةPas encore d'évaluation
- A 1 3 Mecanisme sn2Document5 pagesA 1 3 Mecanisme sn2Yc YacinePas encore d'évaluation
- SMC4 Cristallo - Rattrapage 2015Document1 pageSMC4 Cristallo - Rattrapage 2015ayyoub dhbPas encore d'évaluation
- Corrig ® Des Exercices Suppl ®mentaires S3-Isom ®rie-St ®R ®oisom ®rieDocument11 pagesCorrig ® Des Exercices Suppl ®mentaires S3-Isom ®rie-St ®R ®oisom ®rieMOHAMED MAZOUARIPas encore d'évaluation
- Nomenclature Des Composés OrganiquesDocument16 pagesNomenclature Des Composés OrganiquesRuroniPas encore d'évaluation
- Chapitre V Cours SMC4 HYDROCARBURES ET FONCTIONS MONOVALENTESDocument5 pagesChapitre V Cours SMC4 HYDROCARBURES ET FONCTIONS MONOVALENTESanwar jakriPas encore d'évaluation
- TD Chap 1-2Document8 pagesTD Chap 1-2Aris MpomePas encore d'évaluation
- Exercices de Cinétique ChimiqueDocument2 pagesExercices de Cinétique ChimiqueLatrOch AbdelmalekPas encore d'évaluation
- Al CoolsDocument13 pagesAl Coolsbmm2Pas encore d'évaluation
- Corriges Materiaux Polymeres OrganiquesDocument4 pagesCorriges Materiaux Polymeres OrganiquesHind Lebridia ghazyPas encore d'évaluation
- Correction de L Examen smc4 2015 2016Document4 pagesCorrection de L Examen smc4 2015 2016api-497754935Pas encore d'évaluation
- AminesDocument21 pagesAminesAhmad ElhamriPas encore d'évaluation
- Exam I 7Document3 pagesExam I 7Dlimi MohamedPas encore d'évaluation
- Liste de Réactions en Chimie Organique PCSIDocument3 pagesListe de Réactions en Chimie Organique PCSIlebananistPas encore d'évaluation
- Chapitre 2 BiophysiqueDocument7 pagesChapitre 2 Biophysiqueha deel100% (1)
- Exam IIDocument3 pagesExam IIBaya HalitimPas encore d'évaluation
- Corrige TD1Document7 pagesCorrige TD1Mariam Ben AbdelouahabPas encore d'évaluation
- Thermo Stat PBDocument61 pagesThermo Stat PBabdelkanPas encore d'évaluation
- LPro Spectro Picquet PDFDocument173 pagesLPro Spectro Picquet PDFJunior MbatepPas encore d'évaluation
- Substitution Nucleophile 1Document2 pagesSubstitution Nucleophile 1niniPas encore d'évaluation
- Car Bony Les Alpha-Beta InsaturesDocument7 pagesCar Bony Les Alpha-Beta InsaturesJean-François Abena100% (2)
- Session 1 2016Document7 pagesSession 1 2016Yc YacinePas encore d'évaluation
- Serie de TD ChimieDocument5 pagesSerie de TD Chimieraouf teach 04Pas encore d'évaluation
- Série 2 Isomérie 2020-2021Document3 pagesSérie 2 Isomérie 2020-2021Ayoub HmPas encore d'évaluation
- 205 Chapitre 3Document12 pages205 Chapitre 3Chimiste Chimiste100% (1)
- 04 03 Nomenclature ComplexesDocument2 pages04 03 Nomenclature ComplexesChimiste Chimiste100% (1)
- 04 03 Nomenclature ComplexesDocument2 pages04 03 Nomenclature ComplexesChimiste Chimiste100% (1)
- TP-Duret de L EauDocument2 pagesTP-Duret de L Eaubouhafes100% (4)
- Page de Garde1Document2 pagesPage de Garde1Chimiste ChimistePas encore d'évaluation
- Imp PDFDocument13 pagesImp PDFChimiste ChimistePas encore d'évaluation
- Attestation Affectation Master KhalilDocument1 pageAttestation Affectation Master KhalilChimiste ChimistePas encore d'évaluation
- Heterocycles AromatiquesDocument5 pagesHeterocycles AromatiquesJean-François Abena88% (8)
- Exam SR Elem2 2011Document2 pagesExam SR Elem2 2011Chimiste Chimiste100% (1)
- Chapitre 19-Oxydoreduction en Chimie OrganiqueDocument11 pagesChapitre 19-Oxydoreduction en Chimie OrganiqueChimiste ChimistePas encore d'évaluation
- Attestation Affectation Master KarimDocument1 pageAttestation Affectation Master KarimChimiste ChimistePas encore d'évaluation
- Correction Epreuve de Chimie Des Electrolytes 2013 2014Document5 pagesCorrection Epreuve de Chimie Des Electrolytes 2013 2014Chimiste Chimiste100% (1)
- 6 S4 Corrige S1Document4 pages6 S4 Corrige S1Chimiste ChimistePas encore d'évaluation
- TD Orbitales MoléculairesDocument6 pagesTD Orbitales MoléculairesChimiste Chimiste0% (2)
- RevisionDocument10 pagesRevisionChimiste ChimistePas encore d'évaluation
- 39 12Document5 pages39 12Lilia SouiadePas encore d'évaluation
- Klubprepa Extrait 6358Document6 pagesKlubprepa Extrait 6358Chimiste ChimistePas encore d'évaluation
- Cours WittigDocument14 pagesCours WittigChimiste ChimistePas encore d'évaluation
- TD Orbitales MoléculairesDocument6 pagesTD Orbitales MoléculairesChimiste Chimiste0% (2)
- Cours WittigDocument14 pagesCours WittigChimiste ChimistePas encore d'évaluation
- Exercice 01Document2 pagesExercice 01Chimiste ChimistePas encore d'évaluation
- Exercice 01Document2 pagesExercice 01Chimiste ChimistePas encore d'évaluation
- Fiche 4Document1 pageFiche 4Chimiste ChimistePas encore d'évaluation
- EGS 22 1 2206 77 100 FardeauDocument24 pagesEGS 22 1 2206 77 100 FardeauMourad TaibiPas encore d'évaluation
- Bouziane BoutalkhoukhteDocument48 pagesBouziane BoutalkhoukhteMãr Yãm ELPas encore d'évaluation
- Cours de Résistance Des Matériaux (RDM) PDFDocument12 pagesCours de Résistance Des Matériaux (RDM) PDFamr_akram_2Pas encore d'évaluation
- Fiche Sur Loi Daction de Masse Conditions Dévolution Spontanée 1Document4 pagesFiche Sur Loi Daction de Masse Conditions Dévolution Spontanée 1chadaPas encore d'évaluation
- Trillat-Berdal Valentin-Bs08 - Simulation de Lefficacit NergtiqueDocument8 pagesTrillat-Berdal Valentin-Bs08 - Simulation de Lefficacit NergtiqueHAMZA ISKSIOUIPas encore d'évaluation
- Capteurs Electrochim C 2004Document62 pagesCapteurs Electrochim C 2004nour angéla100% (1)
- Acide Base PDFDocument2 pagesAcide Base PDFabdelkrim salemPas encore d'évaluation
- BWT AquasilDocument1 pageBWT AquasilakroudPas encore d'évaluation
- CP01 AlcosoyDocument2 pagesCP01 AlcosoyBertin BakariPas encore d'évaluation
- 2021 - 22questions TD de BiologieDocument14 pages2021 - 22questions TD de BiologieIssouf BerthePas encore d'évaluation
- Cours RDM 4 FlexionDocument7 pagesCours RDM 4 Flexionyassine maktalPas encore d'évaluation
- الامتحان الوطني في مادة الفيزياء والكيمياء 2015 علوم فيزيائية ترجمة فرنسية الدورة الاستدراكيةDocument7 pagesالامتحان الوطني في مادة الفيزياء والكيمياء 2015 علوم فيزيائية ترجمة فرنسية الدورة الاستدراكيةjouaitiPas encore d'évaluation
- CitralDocument5 pagesCitralDes PamelaPas encore d'évaluation
- TP de MateriauDocument24 pagesTP de Materiaubourabah100% (1)
- BEPC BLANC Vo-Centre 21-22Document8 pagesBEPC BLANC Vo-Centre 21-22Pomeyi Kossi Eguedim100% (4)
- Applications Charbon ActifDocument3 pagesApplications Charbon ActifKhaoula ZefanePas encore d'évaluation
- Desorm SonDocument5 pagesDesorm SonGueye OusmanePas encore d'évaluation
- PDF FileDocument5 pagesPDF FileDolex MalanPas encore d'évaluation
- Developpement de Nouvelles Techniques D'Extraction Des Lipides À Partir Des Micro Algues en Vue de Leur Valorisation en BiocarburantDocument213 pagesDeveloppement de Nouvelles Techniques D'Extraction Des Lipides À Partir Des Micro Algues en Vue de Leur Valorisation en BiocarburantJimmy Hend KhratPas encore d'évaluation
- B-KA 08.19 Boehler Kaltarbeit WEBDocument40 pagesB-KA 08.19 Boehler Kaltarbeit WEBWalid Ben AmirPas encore d'évaluation
- Chap - 10 Exos Proprietes Electriques Des Materiaux CorrigeDocument7 pagesChap - 10 Exos Proprietes Electriques Des Materiaux CorrigeCharles KouaméPas encore d'évaluation
- RamanDocument6 pagesRamanuyuyiuiuiPas encore d'évaluation
- Additifs AlimentairesDocument8 pagesAdditifs AlimentairesaminegalaxyproPas encore d'évaluation
- Grandeurs Caractéristique en ChromatographieDocument15 pagesGrandeurs Caractéristique en ChromatographieAicha NsrPas encore d'évaluation
- Thermo Chimi Ex CorrigesDocument89 pagesThermo Chimi Ex CorrigesBebana Mohamed LeminPas encore d'évaluation
- Cours 3. Le Besoin en ProtéinesDocument18 pagesCours 3. Le Besoin en ProtéinesNadiane TchoualPas encore d'évaluation
- 2018-Thèse LE LOUET ViolaineDocument245 pages2018-Thèse LE LOUET ViolaineNdoumouPas encore d'évaluation
- Corrigés Exercices - Spectres RMNDocument16 pagesCorrigés Exercices - Spectres RMNsana sanaPas encore d'évaluation
- F Technique RigwashDocument3 pagesF Technique RigwasharbiPas encore d'évaluation
- Le Moteur A Eau Est Il Une Arnaque - Générateur HHODocument5 pagesLe Moteur A Eau Est Il Une Arnaque - Générateur HHOFlorine RazaiarimalalaPas encore d'évaluation