Académique Documents
Professionnel Documents
Culture Documents
Neutralidation Acide Base 2021 2022
Transféré par
ZogoCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Neutralidation Acide Base 2021 2022
Transféré par
ZogoDroits d'auteur :
Formats disponibles
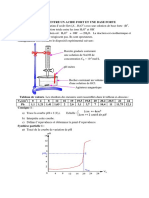
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
REATIONS DE NEUTRALISATION ACIDES-BASES
I. DEFINITION DE LA NEUTRALISATION
La neutralisation acido-basique consiste à mettre en présence des quantités équivalentes de l’acide
(AH) et de la base (B) quelque soit le solvant.
C’est une opération fondamentale en analyse quantitative afin de déterminer le titre de l’acide ou de
la base.
Fig1: exemple d’un protocole d’un titrage volumétrique acido-basique
II. EQUIVALENCE
αA+βB→ δC+D
Le point d’équivalence (PE) correspond au moment pour lequel la substance à doser et le réactif
titrant sont mélangés en proportions stœchiométriques.
Pour qu’un titrage acido-basique soit expérimentalement possible, il faut pouvoir observer un
changement à l’équivalence, en utilisant :
1. Soit un indicateur coloré ; un changement de couleur de la solution est observé.
2. Soit un pH-mètre ; une variation du pH de la solution est observée.
3. Soit un conductimètre ; une variation de la conductivité de la solution est observée.
III. LES COURBES DE NEUTRALISATION
Ce sont des graphiques où le volume de réactif étant en abscisse et une fonction de la concentration
de l’analyte ou du réactif en ordonnée.
Le plus souvent, le logarithme de la concentration est porté en ordonnée
On distingue deux types de courbes de neutralisation :
1. COURBES SIGMOÏDALES
C'est le type de représentation le plus souvent utilisé.
Des variations importantes s’observent dans une petite
région entourant le point d’équivalence
Fig 2: courbe de titrage sigmoïdale
2e année Pharmacie 2021-2022 Page 1
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
2. COURBES A SEGMENT LINEAIRE
Fig 3: courbe de titrage à segment linéaire
IV. NEUTRALISATION D’UN ACIDE FORT PAR UNE BASE FORTE
IV.1. VARIATION DU pH
1.1. Au départ
Soit HA, un acide fort totalement dissocié de concentration « CA » , HA + H2O → A- + H3O+
[H3O+]= CA pH = - log CA
1.2. AVANT LE POINT D’EQUIVALENCE
HA + H2O → A- + H3O+ B + H2O → BH + + OH-
HA + B → BH+,A-
Le mélange consiste en une solution d’acide HA non encore neutralisée et de sel(BH)A provenant de
l’acide neutralisé .
Le pH du mélange est celui de l’acide HA dont la concentration diminue au fur et à mesure du titrage
1.3. AU POINT D’EQUIVALENCE
HA + B → BH+,A-
Le mélange obtenu est une solution de sel neutre (BH)A d’un acide fort(AH) et d’une base forte (B).
[H3O+]= [OH-]= 10-7 pH = 7
1.4. APRES LE POINT D’EQUIVALENCE
B + H2O → BH + + OH-
Le mélange consiste en un excès de la solution de base forte (B) .
pH = 14 + log CB
2e année Pharmacie 2021-2022 Page 2
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
Tab 1: exemple relatif à la neutralisation de 100 cm3 de HCl N par NaOH N.
Fig 4: Exemple d’une courbe de neutralisation de 50 cm3 de HCl N par NaOH N.
IV.2. INFLUENCE DE LA CONCENTRATION EN ACIDE
Fig 5: Exemple d’une courbe courbe de neutralisation de 50 cm3 de HCl
(concentration C) par NaOH (concentration C).
V. NEUTRALISATION D’UN BASE FORTE PAR UN ACIDE FORT
V.1. VARIATION DU pH
1.1. AU DEPART pH = 14 + log CB
1.2. AU POINT D’EQUIVALENCE pH = 7
1.3. APRES LE POINT D’EQUIVALENCE pH = - log CA
2e année Pharmacie 2021-2022 Page 3
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
Fig 6 : exemple de courbe(1) de neutralisation de 50 cm3 de HCl 1 N par NaOH 1 N
Exemple de courbe(2) de neutralisation de 50 cm3 de NaOH 1 N par HCl 1 N
VI. NEUTRALISATION D’UN ACIDE FAIBLE PAR UNE BASE FORTE
VI.1. VARIATION DU pH
1.1. AU DEPART
Soit Ha, un acide faible partiellement dissocié de concentration « Ca » ,Ha + H2O ⇆ a - + H3O+
pH = ½ ( pKa - logCa)
1.2. AVANT LE POINT D’EQUIVALENCE
Ha + H2O ⇆ a - + H3O+ B + H2O → BH + + OH-
Ha + B → BH+,a-
Le mélange est constitué d’une solution d’acide « Ha » non encore neutralisée et de sel(BH)a
provenant de l’acide neutralisé .
pH= pKa+ log [a-] / [Ha]
1.2.1. Calcul de la concentration de «a- »
BH+,a- → BH+ + a-
a - + H2O ⇆ Ha + OH-
Ha + H2O ⇆ a - + H3O+
Bilan d’électroneutralité : [BH+] + [H3O+ ] = [a-] + [OH-]
Si [H3O+ ] et [OH-] sont négligeables : [a-] ≈ [BH+] et donc [a-] = [B]
1.2.2. Calcul de la concentration de «Ha »
Les molécules d'acide « Ha » initialement introduites dans la solution à la concentration « Ca »se
retrouvent, à un moment quelconque du titrage, sous forme soit d'ions « a- », soit de molécules
« Ha » .
Ca =[Ha] + [a-] donc [Ha]=[Ca]- [a-]
1.2.3. Calcul du pH
pH= pKa+ log [a-] / [Ha] pH= pKa+ log [B] /[Ca]-[B]
2e année Pharmacie 2021-2022 Page 4
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
Au moment où [B] = Ca /2, c'est-à-dire la moitié de l'acide « Ha » a été neutralisée, le pH est appelé
pH de demi-neutralisation : pH = pKa
1.3. AU POINT D’EQUIVALENCE
Ha + B → BH+,a-
Le mélange obtenu est une solution de sel (BH)a se comportant comme une solution de base
conjuguée « a- »et le pH est
pH =7+ ½ pKa + ½ log Ca-
1.4. APRES LE POINT D’EQUIVALENCE
B + H2O → BH + + OH-
Le mélange consiste en un excès de la solution de base forte (B) . pH = 14 + log CB
Fig 8 : exemple de courbe de neutralisation de (V ) de CH3COOH (pKa = 4,76)0,1N par
NaOH 0,1 N
VI.2. INFLUENCE DE LA CONCENTRATION EN ACIDE
Fig9 : Exemple de courbe de neutralisation de 50 cm3 de CH3COOH (concentration C) par
NaOH (concentration C)
VI.3. INFLUENCE DE LA NATURE DE L’ACIDE FAIBLE
2e année Pharmacie 2021-2022 Page 5
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
Fig 10 : Courbe de neutralisation de 50 cm3 d’un acide « Ha » 1Npar NaOH 1N
VII. NEUTRALISATION D’UNE BASE FAIBLE PAR UN ACIDE FORT
VII.1. VARIATION DU pH
1.1. AU DEPART : pH =7+ ½ pKa + ½ log Cb
1.2. A LA DEMI-NEUTRALISATION : pH= pKa
1.3. AU POINT D’EQUIVALENCE : pH = ½ ( pKa – logCbH+)
1.4. APRES LE POINT D’EQUIVALENCE : pH =- log CHA
Fig 11 : Exemple de courbe(1) de neutralisation de 50 cm3 de CH3COOH 0,1 N par NaOH 0,1 N
Exemple de courbe(2) de neutralisation de 50 cm3 de NH3 (pKa=9,24) 0,1 N par HCl 0,1N
VIII. NEUTRALISATION D’UN ACIDE FAIBLE PAR UNE BASE FAIBLE
VIII.1. VARIATION DU pH
1.1. AU DEPART
Soit « Ca » la concentration initiale de l’acide faible (Ha) partiellement dissocié
Ha + H2O ⇆ a - + H3O+
pH = ½ ( pKa - logCa)
1.2. AU POINT D’EQUIVALENCE
Le mélange est constitué d’une solution de sel (bH)a , Ha + b → bH+,a-
pH = ½ pKa + ½ pKbH+
2e année Pharmacie 2021-2022 Page 6
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
1.3. AU COURS DU TITRAGE
La variation est peu différente de celle correspondant à la neutralisation d’un acide faible par une
base forte
Point d’inflexion
Fig 13 : Exemple de courbe de neutralisation de 100 cm3 de CH3COOH (pKa=4,76) 0,1N
par NH3 (pKa NH4+ = 9,24) 0,1N
IX. NEUTRALISATION D’UN MELANGE D’ACIDE FORT ET D’ACIDE FAIBLE PAR
UNE BASE FORTE
Le pKa du couple (Ha/a-)doit être compris entre (5 et 14).
Fig 14 : exemple de courbe de neutralisation de 50 mL d’HCl (0,1M) et de CH3COOH
(0,2M) par NaOH (0,1M)
Lorsque l’acide faible est trop fort ( pKa < 5), le titrage séquentiel n’est plus possible .
Fig15: courbes de titrages de 25 mL d’un mélange d’HCl (0,12M) et acide faible (0,08M)
par NaOH 0,1 M.
2e année Pharmacie 2021-2022 Page 7
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
X. CAS DES POLYACIDES ET DES POLYBASES
X.1. Les acidités (ou basicités) sont fortes
La courbe de titrage d’un polyacide (poly base) fort (e) est identique à celle obtenue avec un
monoacide (monobase) fort (e).
X.2. Les acidités (ou basicités) sont faibles et de force différente
Exemple :
Neutralisation d’une solution d’acide phosphorique (H3PO4) 0,1M par une solution d’hydroxyde de
potassium (KOH) 0,1M (en négligeant la dilution)
H3PO4 + H2O ⇆ H2PO4- + H3O+ pKa1 = 2,1
H2PO4- + H2O ⇆ HPO4 2- + H3O+ pKa2 = 7,2 (pKa2 - pKa1 = 5,1 )
HPO42- + H2O ⇆ PO43- + H3O+ pKa3 = 12,4 (pKa3 – pKa2 = 5,2 )
1. AU DEPART
H3PO4 + H2O ⇆ H2PO4- + H3O+ pKa1 = 2,1
pH = ½ ( pKa1 – log C0) = 1,55
2. A LA DEMI-NEUTRALISATION DE LA 1ere ACIDITE
H3PO4 + OH- → H2PO4- + H2O
Au cours du titrage, le mélange est formé de H3PO4 / H2PO4- .
A la demi- neutralisation de la 1e acidité : pH = pKa1 = 2,1
3. AU 1er POINT D’EQUIVALENCE
Le mélange est assimilé à une solution de l’ampholyte (H2PO4- ). La 3eme acidité, plus faible, est
negligeable.
pH = ½ ( pKa1 – pKa2) = 4,65
4. A LA DEMI-NEUTRALISATION DE LA 2eme ACIDITE
H2PO4- + OH- → HPO42- + H2O
Au cours du titrage de la 2e acidité ,le mélange est formé de H2PO4- / HPO42- .
A la demi- neutralisation de la 2e acidité : pH = pKa2 = 7,2
5. AU 2er POINT D’EQUIVALENCE
Le mélange est assimilé à une solution de l’ampholyte (HPO42- ).
pH = ½ ( pKa2 – pKa3) = 9,8
6. A LA DEMI-NEUTRALISATION DE LA 3eme ACIDITE
HPO42- + OH- → PO43- + H2O
Au cours du titrage de la 3e acidité ,le mélange est formé de HPO42- / PO43- .
2e année Pharmacie 2021-2022 Page 8
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
A la demi- neutralisation de la 3e acidité : pH = pKa3 = 12,4
7. AU 3er POINT D’EQUIVALENCE
Le mélange est assimilé à une solution de la base conjuguée faible (PO43- ).
pH = 7 + ½ pKa3 + ½ log C = 12,7
Fig 16 : courbe de neutralisation de H3PO4 0,1M par KOH 0,1M
X.3. Les acidités (ou basicités) sont faibles et de pka (pkb) voisins
Exemple:
Neutralisation d’une solution d’acide tartrique (C2H6O6) 0,1M par une solution d’hydroxyde de
potassium (KOH) 0,1M (en négligeant la dilution)
C2H6O6 + H2O ⇆ C2H5O6 - + H3O+ pKa1 = 2,5
C2H5O6 - + H2O ⇆ C2H4O6 - 2- + H3O+ pKa2 = 4,2
Tab2:les valeurs du pH correspondant à la neutralisation de l’acide tartrique par KOH
XI. INETRETS DES COURBES DE NEUTRALISATION
1. Appréciation de la force des acides ou des bases
2. Détermination des pka
3. Repérage du point d’équivalence
2e année Pharmacie 2021-2022 Page 9
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
3.1. A partir de la courbe pH=f(V)
3.1.1. Méthode des tangentes
Une 3e droite parallèle aux
De part et d’autre du PE, tangentes et équidistante
deux tangentes à la de ces deux dernières
courbe, parallèles entre coupe la courbe au point
elles. équivalence.
Fig 17 : Détermination du point équivalent par la méthode des tangentes.
3.1.2. Méthode de la courbe dérivée
Figure 18: Détermination du point équivalent par la méthode de la dérivée.
3.2. A partir de la courbe conductivité σ =f(V)
Figure 19: Détermination du point équivalent à partir de la courbe σ = f(V).
2e année Pharmacie 2021-2022 Page 10
Vous aimerez peut-être aussi
- Cours Titrage Acide Base 2ème AnnnéeDocument12 pagesCours Titrage Acide Base 2ème AnnnéeSabah AmrPas encore d'évaluation
- 6129e58d84154reactions Acide Base Solutions Tampons Chimie TermDocument7 pages6129e58d84154reactions Acide Base Solutions Tampons Chimie TermPrince Informaticien GamesPas encore d'évaluation
- Corrige - Examen de Chimie Des Solutions (SMPC - s2) Session Normale-1Document7 pagesCorrige - Examen de Chimie Des Solutions (SMPC - s2) Session Normale-1charki zakariaPas encore d'évaluation
- ActivitesDocument4 pagesActivitesMamadou DembaPas encore d'évaluation
- TleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsDocument21 pagesTleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsHamadi DialloPas encore d'évaluation
- Présentation Cours N°6Document13 pagesPrésentation Cours N°6inessPas encore d'évaluation
- Chemical Engineering LabDocument15 pagesChemical Engineering LabOmairPas encore d'évaluation
- DERNIERE PARTIE ''Equilibres Acido-Basiques en Solution Aqueuse'' 2023Document28 pagesDERNIERE PARTIE ''Equilibres Acido-Basiques en Solution Aqueuse'' 2023Malak elPas encore d'évaluation
- Micro MDocument28 pagesMicro Ml3bsectionbPas encore d'évaluation
- Cma 3Document11 pagesCma 3Abdou SaiPas encore d'évaluation
- Calcul Du PH Des Solutions AqueusesDocument5 pagesCalcul Du PH Des Solutions AqueusesHassen JinyorPas encore d'évaluation
- Abdelali AhDocument33 pagesAbdelali Ahcerveaumental80Pas encore d'évaluation
- Chapitre VI Réaction ABDocument6 pagesChapitre VI Réaction ABSarah DiomandePas encore d'évaluation
- Cours Chimie IIDocument37 pagesCours Chimie IINesrine Kaddouri100% (1)
- Laboratoire 3 DÉTERMINATION DE LA CONCENTRATIONDocument11 pagesLaboratoire 3 DÉTERMINATION DE LA CONCENTRATIONKhalil OukebdanePas encore d'évaluation
- TAT Équilibre Acido-BasiqueDocument17 pagesTAT Équilibre Acido-Basiquedrakox.fortnitePas encore d'évaluation
- Série 3: Acides Et BasesDocument30 pagesSérie 3: Acides Et BaseschakiircherfPas encore d'évaluation
- Cours Dosage Acide BaseDocument9 pagesCours Dosage Acide BaseBoussetta ZouhaierPas encore d'évaluation
- Chapitre II-Partie 2Document12 pagesChapitre II-Partie 2amiira bouzouadaPas encore d'évaluation
- Chapitre-5-Les Transformations Liées Par Des Réactions Acido-Basique - DosageDocument13 pagesChapitre-5-Les Transformations Liées Par Des Réactions Acido-Basique - Dosagea houssPas encore d'évaluation
- Cours Dosage Acide Base 3Document8 pagesCours Dosage Acide Base 3Boussetta ZouhaierPas encore d'évaluation
- PH Des Solutions AqueusesDocument5 pagesPH Des Solutions AqueusesMoulham KhalidPas encore d'évaluation
- Bac Blanc (Chimie) GSFADocument3 pagesBac Blanc (Chimie) GSFAahmed amilPas encore d'évaluation
- TP I Analyse de Problèmes Réels Chi Analytique SOLUTION TAMPON CORRIGEEDocument7 pagesTP I Analyse de Problèmes Réels Chi Analytique SOLUTION TAMPON CORRIGEEbouaiedanissa61Pas encore d'évaluation
- Le PH 6. Le Dosage Des Solutions Dacides Et Des Bases Faibles - Theorie - 2014Document15 pagesLe PH 6. Le Dosage Des Solutions Dacides Et Des Bases Faibles - Theorie - 2014RachidaPas encore d'évaluation
- TSP2SP1Ch18T11-TP10 Corrige Destop AspirineDocument5 pagesTSP2SP1Ch18T11-TP10 Corrige Destop AspirineAyoub AinanePas encore d'évaluation
- PH Et SolubilitéDocument34 pagesPH Et SolubilitésafemindPas encore d'évaluation
- Séance 9Document13 pagesSéance 9SantamitoPas encore d'évaluation
- TitrationDocument3 pagesTitrationbounegab100% (1)
- Cours III Acides - Bases-A. BENAMARDocument60 pagesCours III Acides - Bases-A. BENAMARMed Seghir YounesPas encore d'évaluation
- ABdosageDocument5 pagesABdosageslamtrezaPas encore d'évaluation
- CHAPITRE I - Chimie en SolutionDocument3 pagesCHAPITRE I - Chimie en SolutionNikabou Napo TCHANDIKOUPas encore d'évaluation
- 08 TS Chimie Cours - Reactions Acido-Basiques-2Document4 pages08 TS Chimie Cours - Reactions Acido-Basiques-2foufoudoudouPas encore d'évaluation
- Correction TD2 - Calculs de PH (Exos 4,5,6,7,8) V2Document9 pagesCorrection TD2 - Calculs de PH (Exos 4,5,6,7,8) V2Amir NadeauPas encore d'évaluation
- Acide Carboxylique InconnuDocument6 pagesAcide Carboxylique Inconnuaya.rim.riahiPas encore d'évaluation
- Cours 5 C TRAFI 2BACDocument18 pagesCours 5 C TRAFI 2BACEnidroun OutPas encore d'évaluation
- Cg2 Acides Bases AlbourineDocument17 pagesCg2 Acides Bases AlbourineAyoub Elfarwah100% (1)
- Chapitre IV 1Document37 pagesChapitre IV 1sidiPas encore d'évaluation
- Acides Et Bases PCDocument15 pagesAcides Et Bases PCrkibi.khadija2006Pas encore d'évaluation
- DS2 Tspé 2020-2021-5Document5 pagesDS2 Tspé 2020-2021-5hanaemaaroufPas encore d'évaluation
- Partie 4 - Exercices Sur L'équilibre Acido-Basique: Acides Et Bases de Bronsted-Lowry (Couples Conjugués)Document3 pagesPartie 4 - Exercices Sur L'équilibre Acido-Basique: Acides Et Bases de Bronsted-Lowry (Couples Conjugués)Samuel FleuryPas encore d'évaluation
- ExtraitDocument9 pagesExtraitSteeven VillagePas encore d'évaluation
- Cours3 - Acides Et Bases 2Document25 pagesCours3 - Acides Et Bases 2BONNEHPas encore d'évaluation
- Chimie: - Chimie en Solution AqueuseDocument35 pagesChimie: - Chimie en Solution AqueuseAyoub Maverick100% (1)
- Traveaux Dirigés 2Document6 pagesTraveaux Dirigés 2Aymen BaccouchePas encore d'évaluation
- 5.applications À Des Titrages Mettant en Jeu Des Réactions Acido-Basiques PDFDocument5 pages5.applications À Des Titrages Mettant en Jeu Des Réactions Acido-Basiques PDFkimmikPas encore d'évaluation
- C6Chim - Titrages - Exos - Ph&conduct&color PDFDocument9 pagesC6Chim - Titrages - Exos - Ph&conduct&color PDFAzizElheniPas encore d'évaluation
- Titrage Acido BasiqueDocument50 pagesTitrage Acido Basiquebadj47Pas encore d'évaluation
- Dosage Acido BasiqueDocument33 pagesDosage Acido Basiquemed100% (1)
- 09 Bcbaf 28 Fe 05735 FeDocument11 pages09 Bcbaf 28 Fe 05735 FeLindorPas encore d'évaluation
- Chap.I Chimie Analytique II - 2021-2022Document17 pagesChap.I Chimie Analytique II - 2021-2022Mira MslPas encore d'évaluation
- Serie 7 8 Acides Faibles Bases Faibles Solutions TamponsDocument10 pagesSerie 7 8 Acides Faibles Bases Faibles Solutions TamponsBrahim DahaiPas encore d'évaluation
- 2eme Partie Du Cours Chimie en Solution 2023 ''ENSA''Document32 pages2eme Partie Du Cours Chimie en Solution 2023 ''ENSA''Malak elPas encore d'évaluation
- Chimie B Chap8 Titrage - Acidobasique PDFDocument6 pagesChimie B Chap8 Titrage - Acidobasique PDFMouloud IssaadPas encore d'évaluation
- Exercices Et Problèmes de ConcoursDocument12 pagesExercices Et Problèmes de ConcoursSa LimPas encore d'évaluation
- ERC 18 Chapitre 7BDocument7 pagesERC 18 Chapitre 7Bبدر الذهابيPas encore d'évaluation
- Cours Chimie 02Document3 pagesCours Chimie 02imen dimessiPas encore d'évaluation
- 4les Transformations Liees A Des Reactions Acide Base Resume de CoursDocument2 pages4les Transformations Liees A Des Reactions Acide Base Resume de Coursilyas yoPas encore d'évaluation
- S7 Chapitre 03 Reaction Acide Base DosageDocument16 pagesS7 Chapitre 03 Reaction Acide Base DosageRADWAN100% (2)
- Solubilité Et PrécipitationDocument7 pagesSolubilité Et PrécipitationZogoPas encore d'évaluation
- MiniSessionMathsTleD 01 11 23Document2 pagesMiniSessionMathsTleD 01 11 23ZogoPas encore d'évaluation
- td5 Mat 321 23-24Document2 pagestd5 Mat 321 23-24ZogoPas encore d'évaluation
- MiniSessionMathsTleD 01 11 23Document2 pagesMiniSessionMathsTleD 01 11 23ZogoPas encore d'évaluation
- Exercices de Cinétique Chimique Avec Solutions: Pr. Malika TRIDANEDocument24 pagesExercices de Cinétique Chimique Avec Solutions: Pr. Malika TRIDANEMariam Ben AbdelouahabPas encore d'évaluation
- 4 Fonction de TransfertDocument18 pages4 Fonction de TransfertAna SmaalPas encore d'évaluation
- Fiche Academique FS 22L2336 2023Document1 pageFiche Academique FS 22L2336 2023Daniel KenmogePas encore d'évaluation
- TP Réacteur oDocument10 pagesTP Réacteur oTarik Migano Boucif100% (5)
- Loi NormaleDocument39 pagesLoi NormaleProost N'guessanPas encore d'évaluation
- No14 21 Nov 2023Document2 pagesNo14 21 Nov 2023ZogoPas encore d'évaluation
- Cours4 SeriesDocument6 pagesCours4 SeriesBrayann DiePas encore d'évaluation
- TD Physique Première C D Octobre N°1Document2 pagesTD Physique Première C D Octobre N°1ZogoPas encore d'évaluation
- Sequence 4 5ieme Mathematiques FinalDocument2 pagesSequence 4 5ieme Mathematiques FinalZogoPas encore d'évaluation
- No1 2nd 28 Fev 2023 Sujetexa - ComDocument2 pagesNo1 2nd 28 Fev 2023 Sujetexa - ComZogoPas encore d'évaluation
- Geometrie Analytique EspaceDocument23 pagesGeometrie Analytique EspaceZogoPas encore d'évaluation
- Mathematique - Lucem Collège - 3ème - Sequence 2 CamerounDocument2 pagesMathematique - Lucem Collège - 3ème - Sequence 2 CamerounChamberlin MoyiwouoPas encore d'évaluation
- sortieWW 2Document2 pagessortieWW 2ZogoPas encore d'évaluation
- 1ère ESGDocument7 pages1ère ESGZogoPas encore d'évaluation
- Sequence 4 5ieme Mathematiques FinalDocument2 pagesSequence 4 5ieme Mathematiques FinalZogoPas encore d'évaluation
- No1 2nd 28 Fev 2023 Sujetexa - ComDocument2 pagesNo1 2nd 28 Fev 2023 Sujetexa - ComZogoPas encore d'évaluation
- td1 Mat 321 23-24Document2 pagestd1 Mat 321 23-24ZogoPas encore d'évaluation
- Bacc Blanc n2 Maths.Document2 pagesBacc Blanc n2 Maths.ZogoPas encore d'évaluation
- 1ère ESGDocument7 pages1ère ESGZogoPas encore d'évaluation
- Guide PédagogiqueDocument44 pagesGuide PédagogiqueElla KabongoPas encore d'évaluation
- Evaluation Sommative de Fin Du Troisieme Trimestre: IntelligentsiaDocument4 pagesEvaluation Sommative de Fin Du Troisieme Trimestre: IntelligentsiaZogoPas encore d'évaluation
- EXERCICE 1: Vérification Des Savoirs (8points)Document3 pagesEXERCICE 1: Vérification Des Savoirs (8points)ZogoPas encore d'évaluation
- Evaluation Sommative de Fin Du Troisieme TrimestreDocument3 pagesEvaluation Sommative de Fin Du Troisieme TrimestreZogoPas encore d'évaluation
- Evaluation Sommative de Fin Du Troisieme Trimestre: IntelligentsiaDocument4 pagesEvaluation Sommative de Fin Du Troisieme Trimestre: IntelligentsiaZogoPas encore d'évaluation
- Guela Kamdem Pierre PLEG Mathématiques: Etes-Vous Capable de ?Document4 pagesGuela Kamdem Pierre PLEG Mathématiques: Etes-Vous Capable de ?ZogoPas encore d'évaluation
- Guela Kamdem Pierre PLEG Mathématiques: Etes-Vous Capable de ?Document3 pagesGuela Kamdem Pierre PLEG Mathématiques: Etes-Vous Capable de ?ZogoPas encore d'évaluation
- Thèse Étude de La Détonation Dans Un Jet DiphasiqueDocument258 pagesThèse Étude de La Détonation Dans Un Jet DiphasiqueBenmoussa AliPas encore d'évaluation
- TD Chap 5 Transferts ThermiquesDocument4 pagesTD Chap 5 Transferts Thermiquessamueldebavelaere2018Pas encore d'évaluation
- Série 1Document2 pagesSérie 1héma tologiePas encore d'évaluation
- Ecoulement Incompressible Autour Obstacle2Document7 pagesEcoulement Incompressible Autour Obstacle2Celine GrasPas encore d'évaluation
- TD Optique CoherenteDocument13 pagesTD Optique CoherenteAnonymous 73gEYyEtLPas encore d'évaluation
- Mesu PSCDocument10 pagesMesu PSCAjay MahatoPas encore d'évaluation
- Sondes Et FaisceauxDocument55 pagesSondes Et Faisceauxyacine26Pas encore d'évaluation
- Chapitre 4Document25 pagesChapitre 4Mourad GcvPas encore d'évaluation
- Conception Des Liaisons Mecaniques - Mec PDFDocument217 pagesConception Des Liaisons Mecaniques - Mec PDFAhmed SELLAMIPas encore d'évaluation
- Examen Quantique L2Document2 pagesExamen Quantique L2badroboudraa810Pas encore d'évaluation
- Chap 5 RDM 1Document8 pagesChap 5 RDM 1ALIOUI ABDELHADIPas encore d'évaluation
- 6-Planchers Et Toitures Prefabriques PDFDocument25 pages6-Planchers Et Toitures Prefabriques PDFBenharzallah KrobbaPas encore d'évaluation
- TD N de NivellementDocument2 pagesTD N de NivellementRomaissae LarhbaliPas encore d'évaluation
- Agrifarm Utto MP - V04 - 06 - 2022Document2 pagesAgrifarm Utto MP - V04 - 06 - 2022Sebastien WerlePas encore d'évaluation
- TP3 - Physique Des Solide M1-S2 - DjelfaDocument5 pagesTP3 - Physique Des Solide M1-S2 - Djelfamerrouche.mohamed99Pas encore d'évaluation
- Cours N°2 Assemblages Complexes Sous M, N, VDocument105 pagesCours N°2 Assemblages Complexes Sous M, N, Vtidus00_3Pas encore d'évaluation
- TD2 - Enoncé PDFDocument8 pagesTD2 - Enoncé PDFLemallemPas encore d'évaluation
- La Corrosion Des Structures Métalliques en MerDocument11 pagesLa Corrosion Des Structures Métalliques en Meripman99Pas encore d'évaluation
- Controle 2 - 4 S1 1AC InterDocument1 pageControle 2 - 4 S1 1AC Intermohmed elbacha100% (1)
- TD Serie1Document1 pageTD Serie1Nowe AhmadePas encore d'évaluation
- Lacoustique de Lhabitat PDFDocument123 pagesLacoustique de Lhabitat PDFzzcamePas encore d'évaluation
- IND UT-113 - Fiche ExplicativeDocument5 pagesIND UT-113 - Fiche ExplicativeSamuel MazetPas encore d'évaluation
- Bael 91Document199 pagesBael 91walidPas encore d'évaluation
- Wa0015.Document4 pagesWa0015.zouhair mejdalPas encore d'évaluation
- Les Pompes AtelierDocument13 pagesLes Pompes AtelierNãřímäñ KŁayPas encore d'évaluation
- Turbomachines CM Master2-ConvertiDocument8 pagesTurbomachines CM Master2-ConvertiAicha DahmaniPas encore d'évaluation
- Génie Énergétique - Exercices Et Problèmes de Thermodynamique - Des Principes Aux Applications Aux Machines - Niveau BDocument9 pagesGénie Énergétique - Exercices Et Problèmes de Thermodynamique - Des Principes Aux Applications Aux Machines - Niveau Bياسين بوعيشي0% (1)
- Caractéristiques Techniques F200K ... / F200K ... Ex-II ... / F200K ... ExDocument5 pagesCaractéristiques Techniques F200K ... / F200K ... Ex-II ... / F200K ... Exإبراهيم الزايدي الكيحلPas encore d'évaluation
- Cpi1-Revision-Ex VS Cor - LentilleDocument9 pagesCpi1-Revision-Ex VS Cor - LentilleHassanHajjiPas encore d'évaluation
- Fascicule TP 2010-2011Document62 pagesFascicule TP 2010-2011أم يسرPas encore d'évaluation
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Géobiologie de l'habitat et Géobiologie sacrée: Pour un lieu sainD'EverandGéobiologie de l'habitat et Géobiologie sacrée: Pour un lieu sainÉvaluation : 4.5 sur 5 étoiles4.5/5 (2)
- Manuel pour les débutants Fabriquez des savons naturelsD'EverandManuel pour les débutants Fabriquez des savons naturelsÉvaluation : 3 sur 5 étoiles3/5 (2)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Technologie automobile: Les Grands Articles d'UniversalisD'EverandTechnologie automobile: Les Grands Articles d'UniversalisPas encore d'évaluation
- Conception & Modélisation CAO: Le guide ultime du débutantD'EverandConception & Modélisation CAO: Le guide ultime du débutantPas encore d'évaluation
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Anatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursD'EverandAnatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursPas encore d'évaluation
- Le B.A.-Ba de la communication: Comment convaincre, informer, séduire ?D'EverandLe B.A.-Ba de la communication: Comment convaincre, informer, séduire ?Évaluation : 3 sur 5 étoiles3/5 (1)
- L'Ombre à l'Univers: La structure des particules élémentaires XIIfD'EverandL'Ombre à l'Univers: La structure des particules élémentaires XIIfPas encore d'évaluation
- Histoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsD'EverandHistoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsPas encore d'évaluation
- Géologie de l'Amérique: Les Grands Articles d'UniversalisD'EverandGéologie de l'Amérique: Les Grands Articles d'UniversalisPas encore d'évaluation
- Jus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTD'EverandJus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTPas encore d'évaluation
- Enseigner une Langue Etrangère Par l’Apprentissage HybrideD'EverandEnseigner une Langue Etrangère Par l’Apprentissage HybridePas encore d'évaluation
- 500 secrets pour avoir un potager merveilleuxD'Everand500 secrets pour avoir un potager merveilleuxÉvaluation : 2 sur 5 étoiles2/5 (1)
- 160 ressources pour se lancer dans la vidéo quand on n’y connait rienD'Everand160 ressources pour se lancer dans la vidéo quand on n’y connait rienPas encore d'évaluation