Académique Documents
Professionnel Documents
Culture Documents
AE1 Alcanes Et Alcools
Transféré par
ColeTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
AE1 Alcanes Et Alcools
Transféré par
ColeDroits d'auteur :
Formats disponibles
1ère Spé Chapitre 15 :
Partie Les transports Conversion de l’énergie stockée dans la matière organique
Constitution et transformations
Activité 1 : Alcanes et alcools, des combustibles usuels
de la matière
- Justifier le nom associé à la formule semi-développée de molécules simples possédant un seul
Objectifs :
groupe caractéristique et inversement.
- Utiliser des modèles moléculaires ou des logiciels pour visualiser la géométrie de molécules
organiques.
- Citer des exemples de combustibles usuels.
- Modélisation d’une combustion par une réaction d’oxydoréduction.
- Écrire l’équation de réaction de combustion complète d’un alcane et d’un alcool.
Les combustions sont des réactions chimiques entre un combustible et un comburant. La plupart du temps, le
comburant est le dioxygène de l’air. Les alcanes et les alcools sont les combustibles les plus couramment utilisés.
1. PRESENTATION DES ALCANES ET DES ALCOOLS, NOMENCLATURE
Document 1 : Les alcanes
Les alcanes sont des hydrocarbures saturés : ils ne contiennent donc que les éléments carbone
et hydrogène, et ne possèdent que des liaisons simples C-C.
On appelle chaine carbonée l’enchaînement des atomes de carbone liés entre eux par des
liaisons covalentes : une chaîne carbonée peut être linéaire, ramifiée ou cyclique.
Document 2 : Nomenclature des alcanes
• Le nom d'un alcane non-ramifié de formule brute générale CnH2n+2 est constitué d’un préfixe qui indique le nombre
d’atomes de carbone de la chaine carbonée, suivi de la terminaison – ane.
n 1 2 3 4 5 6 7 8
préfixe méth éth prop but pent hex hept oct
• Pour les alcanes cycliques, appelés cyclanes (ou cycloalcanes), on ajoute le préfixe cyclo- au nom de l'alcane linéaire
ayant le même nombre d'atomes de carbone, leur formule brute générale est CnH2n.
• pour nommer un alcane ramifié, il faut :
1. Rechercher la chaîne principale, c'est-à-dire la chaîne carbonée la plus longue présente dans la molécule, et
la nommer comme pour les alcanes non ramifiés.
2. Repérer les ramifications : elles constituent les substituants de la chaîne principale. Ce sont des groupes
alkyles. La plupart du temps, ce sont des chaînes méthyle (CH3-) ou éthyle (CH3-CH2-).
3. Numéroter la chaîne carbonée de telle sorte que les atomes de carbone porteurs des substituants aient les
numéros les plus faibles possibles.
4. Classer les substituants par ordre alphabétique, sans tenir compte des préfixes multiplicatifs éventuels.
Placés avant le nom de la chaîne principale sans le -e final, ils sont
précédés du chiffre indiquant leur position dans la chaîne principale.
Lorsque le même substituant apparaît à plusieurs reprises, on utilise les
préfixes di- (pour 2), tri- (pour 3), tétra- (pour 4) que l'on fait précéder
des chiffres indiquant chacune des positions des substituants.
Document 3 : Les alcools
Les alcools sont des composés organiques dans lesquels un groupe hydroxyle –OH est fixé sur un atome de carbone
tétraédrique (qui fait 4 liaisons simples). La structure d'un alcool est celle d'un alcane dont un atome d'hydrogène a
été remplacé par un groupe hydroxyle : il existe donc des alcools linéaires, ramifiés ou cycliques.
Document 4 : Nomenclature des alcools
Le nom d’un alcool dérive de celui de l’alcane de même chaîne carbonée en
remplaçant le « e » final par la terminaison « ol », précédée, si nécessaire, de
l’indice de position du groupe hydroxyle dans la chaîne carbonée principale.
Compte rendu :
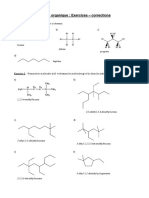
1) Nommer les alcanes suivants :
2) Représenter les formules semi-développées et topologiques des alcanes suivants :
a) cyclopentane ; b) 2,3-diméthylbutane ; c) 3-éthylpentane ; d) 3-éthyl-3,4-diméthylhexane.
3) Le terme « alcool » dans la vie courante fait référence à l'éthanol. Donner sa formule développée.
4) Nommer les alcools suivants :
5) Représenter les formules semi-développées et topologiques des alcools suivants :
a) butan-2-ol ; b) 2-méthylpropan-1-ol ; c) 3,3-diméthyl butan-2-ol.
6) Nommer les molécules ci-dessous :
2. MODELISER UNE REACTION DE COMBUSTION
Au cours d’une combustion, un échange d’électrons a lieu entre le combustible et le comburant. Les atomes du
combustible se combinent avec ceux du comburant et conduisent à la formation de produits.
Comment faire le lien entre combustion et oxydoréduction ?
Document 5 : les combustions au quotidien Document 6 : Modélisation de la
combustion
Document 7 : Matériel disponible 8 :
Bougie, tube à essais avec bouchon, porte-tubes, pince en bois, eau de
chaux
Compte rendu :
1) Rappeler les noms des deux espèces chimiques produites lors d’une combustion.
2) Proposer un protocole expérimental permettant de mettre en évidence les produits formés lors de la
combustion de la paraffine d’une bougie.
Travail à effectuer : Après accord du professeur, mettre en œuvre le protocole et noter les observations.
3) Identifier le combustible/réducteur et le comburant/oxydant de la combustion du butane.
4) Ecrire la réaction modélisant la combustion du butane.
5) Ecrire la réaction modélisant la combustion du méthane, du propane et de l’éthanol.
6) A l’aide du modèle de la réaction d’oxydoréduction, interpréter la combustion de l’éthanol dans l’air en
rappelant les rôles joués par chaque substance.
Vous aimerez peut-être aussi
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Chimie Organique 1année MedecineDocument217 pagesChimie Organique 1année MedecineSomah DOUMBIA100% (1)
- QCM CytosqueletteDocument24 pagesQCM CytosqueletteFarouk Ali100% (1)
- Pedologie 1 PDFDocument81 pagesPedologie 1 PDFKafana CoulibalyPas encore d'évaluation
- Acides nucléiques: Les Grands Articles d'UniversalisD'EverandAcides nucléiques: Les Grands Articles d'UniversalisPas encore d'évaluation
- Glucides: Les Grands Articles d'UniversalisD'EverandGlucides: Les Grands Articles d'UniversalisPas encore d'évaluation
- Cours Chimie Organique 2009-2010Document179 pagesCours Chimie Organique 2009-2010AlvaroEnriqueQuinterosPas encore d'évaluation
- Chapitre I.2 - Alcènes-Alcynes - B. MESSAOUDI - 14-02-2022Document50 pagesChapitre I.2 - Alcènes-Alcynes - B. MESSAOUDI - 14-02-2022Abderrahmane AEPas encore d'évaluation
- Mini ProjetDocument66 pagesMini ProjetYassine ChouikhPas encore d'évaluation
- Mémoire Fin D'étudeDocument73 pagesMémoire Fin D'étudeabishk12Pas encore d'évaluation
- Cours de Sciences Physiques 4ADocument71 pagesCours de Sciences Physiques 4AAdrien JulienPas encore d'évaluation
- Chap 2Document4 pagesChap 2Ouehnia tynaPas encore d'évaluation
- Fiche NomenclatureDocument6 pagesFiche Nomenclaturedridri.drawzPas encore d'évaluation
- 1S Chapitre X Alcanes Et AlcoolsDocument10 pages1S Chapitre X Alcanes Et AlcoolsSoumia ElouaourtiPas encore d'évaluation
- CH ORG Chapitre NomenclatureDocument24 pagesCH ORG Chapitre NomenclatureRochdi BAATIPas encore d'évaluation
- Cours 5 Nomenclature SNV L1 2020 2021Document30 pagesCours 5 Nomenclature SNV L1 2020 2021Mohamed DjaniPas encore d'évaluation
- Chimie Organique Chap2Document20 pagesChimie Organique Chap2Mira MaroPas encore d'évaluation
- PC 1ère CD-C6 Quelques Composés Oxygénés PDFDocument11 pagesPC 1ère CD-C6 Quelques Composés Oxygénés PDFZanaple CoulibalyPas encore d'évaluation
- Chapitre 2 Chimie Organique 2024Document12 pagesChapitre 2 Chimie Organique 2024anie KheliliPas encore d'évaluation
- Cours de Chimie Organique Chapitre 1 CTA1Document76 pagesCours de Chimie Organique Chapitre 1 CTA1MohamedBelhoudaPas encore d'évaluation
- Cours Esiba - Chimie OrgaDocument41 pagesCours Esiba - Chimie OrgaKoffi Toyo AGBEKPONOUPas encore d'évaluation
- Chapitre 9 Réaction DDocument13 pagesChapitre 9 Réaction DAbdeljalil LoudainiPas encore d'évaluation
- Chimie Organique. 1.annéeDocument199 pagesChimie Organique. 1.annéeWesh Loup MaïgaPas encore d'évaluation
- Chap 2a Les Hydrocarbures Saturés Et InsaturésDocument12 pagesChap 2a Les Hydrocarbures Saturés Et InsaturésYves Patrick AngoPas encore d'évaluation
- CH Organique NomenclatureDocument7 pagesCH Organique NomenclaturestefanPas encore d'évaluation
- Activité Doc 1 CH C9Document9 pagesActivité Doc 1 CH C9noamhamou2Pas encore d'évaluation
- 1ère A - APC - Les AlcanesDocument5 pages1ère A - APC - Les AlcanesLAWSON NICOLASPas encore d'évaluation
- Pdf&rendition 1Document60 pagesPdf&rendition 1othmane boubarad100% (1)
- Cours de Chimie OrganiqueDocument75 pagesCours de Chimie OrganiqueMohamadsfPas encore d'évaluation
- 1ère CD - APC - Quelques Composés OxygénésDocument5 pages1ère CD - APC - Quelques Composés OxygénésLAWSON NICOLASPas encore d'évaluation
- Chimie OrganiqueDocument28 pagesChimie OrganiqueNaru NamuPas encore d'évaluation
- Chapitre 1 Alcanes Et Alcenes EssentielsDocument6 pagesChapitre 1 Alcanes Et Alcenes Essentielsboussad1Pas encore d'évaluation
- SVI (S2) 2019-2020 Chimie II Chimie Organique Pr. Oussaid Adyl1Document80 pagesSVI (S2) 2019-2020 Chimie II Chimie Organique Pr. Oussaid Adyl1abb32214Pas encore d'évaluation
- Chimie Premiere CdeDocument30 pagesChimie Premiere CdeHans René Nkwinga NgokoPas encore d'évaluation
- c8 Les AlcanesDocument6 pagesc8 Les AlcanestotoafifiPas encore d'évaluation
- Molecules Organiques Et Squelettes Carbones Modification Du Squelette Carbone Cours 2 4Document5 pagesMolecules Organiques Et Squelettes Carbones Modification Du Squelette Carbone Cours 2 4Ossama SariaPas encore d'évaluation
- COURS - Formules Et Nomenclature en Chimie OrganiqueDocument5 pagesCOURS - Formules Et Nomenclature en Chimie OrganiqueLucas Ric0% (1)
- Chapitre I - Chimie4Document5 pagesChapitre I - Chimie4evilievPas encore d'évaluation
- 2 BAC NomencalatureDocument2 pages2 BAC NomencalatureHou ChanPas encore d'évaluation
- PC Chimie Organique LeconDocument3 pagesPC Chimie Organique LeconEmilie KlmPas encore d'évaluation
- Ch1-cours-HR - RappelNomenclatureDocument9 pagesCh1-cours-HR - RappelNomenclatureETIENNEPas encore d'évaluation
- 4 6030641967761721271Document58 pages4 6030641967761721271Joseph Rodrigue NDOMO0% (2)
- Chap 01 NomenclatureDocument9 pagesChap 01 NomenclatureAyoub DoumirPas encore d'évaluation
- Cours Chimie Organique BEP ProfDocument10 pagesCours Chimie Organique BEP ProfOtaku 4 LifePas encore d'évaluation
- Nomenclature Des Composes OrganiquesDocument7 pagesNomenclature Des Composes OrganiquesRania BelliliPas encore d'évaluation
- Le Squelette Carboné Des Molécules OrganiquesDocument4 pagesLe Squelette Carboné Des Molécules OrganiquesSonia Sadek100% (1)
- Chap 3 2020Document24 pagesChap 3 2020JakePas encore d'évaluation
- 1S Chimie ChapDocument9 pages1S Chimie ChapHadia DjeltiPas encore d'évaluation
- Generalites OrganiqueDocument11 pagesGeneralites OrganiqueOumarou KontaPas encore d'évaluation
- Cours HydrocarburesDocument6 pagesCours HydrocarburesPrince Abdoo100% (2)
- c3 Les Acide Carboxyliques Et DerivesDocument12 pagesc3 Les Acide Carboxyliques Et DerivesComan SakoPas encore d'évaluation
- Généralités Sur La Chimie Des HydrocarburesDocument19 pagesGénéralités Sur La Chimie Des Hydrocarburesfarouk federerPas encore d'évaluation
- PRATIQDocument29 pagesPRATIQYavo Vivas AKEPas encore d'évaluation
- Cours de Chimie Organique Chapitre IIDocument15 pagesCours de Chimie Organique Chapitre IIzahramathlouthi127Pas encore d'évaluation
- BTS Chimie 2 Chimie OrganiqueDocument7 pagesBTS Chimie 2 Chimie Organiquekarpla69Pas encore d'évaluation
- COURS de Chimie Organique G-Nerale 2022-2023Document85 pagesCOURS de Chimie Organique G-Nerale 2022-2023essam.elrhaziPas encore d'évaluation
- Chapitre 5 Nomenclature SystematiqueDocument92 pagesChapitre 5 Nomenclature SystematiqueNatacha N'GUESSANPas encore d'évaluation
- Chap. 2 Les AlcanesDocument12 pagesChap. 2 Les AlcanesNguettia Yao jean Daniel Adou100% (2)
- Chap 02 NomenclatureDocument9 pagesChap 02 NomenclatureCendrey Grace KoutoumaPas encore d'évaluation
- Chapitre VIII Les Composés Oxygénés PremièreDocument5 pagesChapitre VIII Les Composés Oxygénés Premièremadomano1971Pas encore d'évaluation
- UE1 - Chimie Organique - 24/08/2017Document64 pagesUE1 - Chimie Organique - 24/08/2017John BasicPas encore d'évaluation
- Chapitre VII Les Réactions D'estérificationDocument11 pagesChapitre VII Les Réactions D'estérificationRenolga MountekelaPas encore d'évaluation
- Chimie OrganiqueDocument29 pagesChimie OrganiqueHamza SidhoumPas encore d'évaluation
- S4 Combustion Des Matériaux Dans L'airDocument2 pagesS4 Combustion Des Matériaux Dans L'airAgnaou MohamedPas encore d'évaluation
- Reactions Chimie OrgaDocument47 pagesReactions Chimie OrgafluiddynamicPas encore d'évaluation
- Fiche Reactions - Fischer TropschDocument2 pagesFiche Reactions - Fischer TropschAndré NlendPas encore d'évaluation
- 2019 - Biocomposite Lin AutomobileDocument54 pages2019 - Biocomposite Lin AutomobileFisso Ben BenPas encore d'évaluation
- Cours Sur Les Non TMMMMMMMDocument44 pagesCours Sur Les Non TMMMMMMMleprinceeustacheadaPas encore d'évaluation
- Biochimie 02 - Acides Aminés - PeptidesDocument22 pagesBiochimie 02 - Acides Aminés - PeptidesNathan CohenPas encore d'évaluation
- MCOT Biblio CommentéDocument1 pageMCOT Biblio Commentéjathavan inthirarajahPas encore d'évaluation
- Analyse Et Controle de Qualite - Naima ELAMIRI - 4752 PDFDocument38 pagesAnalyse Et Controle de Qualite - Naima ELAMIRI - 4752 PDFBüyüleyici GözlerPas encore d'évaluation
- Annalyse BiochemieDocument6 pagesAnnalyse BiochemieAsMaâ AsoumPas encore d'évaluation
- TD Chimie Termrnale C D Octobre N°1Document2 pagesTD Chimie Termrnale C D Octobre N°1Antoine Eba ZehPas encore d'évaluation
- Expose PCM Frittage AluminothermieDocument34 pagesExpose PCM Frittage AluminothermieAboubacar Sidiki TangaraPas encore d'évaluation
- Astm D974 2014Document7 pagesAstm D974 2014Anonh Adiko100% (1)
- Chapitre I Nature Des CanalisationsDocument12 pagesChapitre I Nature Des Canalisationsjust ANDROIDPas encore d'évaluation
- FR20 LerecyclagedesplastiquesDocument20 pagesFR20 LerecyclagedesplastiquesYS OthmPas encore d'évaluation
- Corrige: Brevet de Technicien Superieur Traitements Des MateriauxDocument6 pagesCorrige: Brevet de Technicien Superieur Traitements Des Materiauxpedro66Pas encore d'évaluation
- Exercices 1transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseDocument1 pageExercices 1transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseAyoub ShaitPas encore d'évaluation
- Chap1 Structure CristallineDocument13 pagesChap1 Structure CristallineHachi AbdelazizPas encore d'évaluation
- Activité 1 SUIVIDocument5 pagesActivité 1 SUIVIAmine ElPas encore d'évaluation
- Fds - AdblueDocument12 pagesFds - AdblueAchbi noureddinePas encore d'évaluation
- LES Moles: 6.02x10 MolDocument1 pageLES Moles: 6.02x10 MolboustakatbPas encore d'évaluation
- La Chimie de L'Échelle de Teintes: Contexte Du SujetDocument5 pagesLa Chimie de L'Échelle de Teintes: Contexte Du SujetŚà Ĺãh ĎķłPas encore d'évaluation
- Glucides GrenobleDocument88 pagesGlucides GrenobleAli RymePas encore d'évaluation
- Generalites Sur Les Materiaux CompositesDocument49 pagesGeneralites Sur Les Materiaux CompositesSami BERRAISPas encore d'évaluation
- Géométrie Des Molécules Géométrie Des MoléculesDocument39 pagesGéométrie Des Molécules Géométrie Des MoléculesAbdoulaye DraméPas encore d'évaluation
- Untitled PDFDocument66 pagesUntitled PDFamer dehebPas encore d'évaluation
- Chimie Organique Exercices Corr 01 - CompressedDocument11 pagesChimie Organique Exercices Corr 01 - CompressedAdilsonPas encore d'évaluation