Académique Documents
Professionnel Documents
Culture Documents
Fibrillation Auriculaire Arce 2013
Transféré par
nemeyechrisbelCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Fibrillation Auriculaire Arce 2013
Transféré par
nemeyechrisbelDroits d'auteur :
Formats disponibles
Département de médecine communautaire,
de premier recours et des urgences
Service de médecine de premier recours
FIBRILLATION AURICULAIRE
P. Nardo, D. Shah, H. Burri, Ph. Meyer
Service de médecine de premier recours, HUG
Service de cardiologie, HUG
Avril 2013
LES POINTS À RETENIR
• Le risque thromboembolique de la FA paroxystique est similaire à la FA chronique
• L’approche la plus recommandée est le contrôle de la fréquence cardiaque
• Chez les patients avec une FA non valvulaire, le score de CHADS-VASC peut être
utilisé pour stratifier le risque d’AVC et déterminer le type de traitement anticoagulant
tout en tenant compte du contexte clinique du patient
Fibrillation auriculaire – HUG – DMCPRU – Service de médecine de premier recours - 2013
Algorithme 1 : prise en charge d’une FA de découverte récente
Instabilité
hemodynamique
oui non
Anticoagulation + contrôle
Anticoagulation + de fréquence si rapide
Cardioversion electrique
Selon durée de FA, symptomatologie, âge, niveau
d’activité (et aussi taille OG, fonction VG) choix de
contrôle du rythme vs. contrôle de la fréquence
Contrôle du rythme :
Soit attente 12‐24 h pour CV
spontanée et ensuite CV
pharmaco vs. Electrique si
nécessaire soit CV pharmaco vs.
Electrique d’emblée
Contrôle de la fréquence
Anticoagulation a maintenir; Bilan
cardiaque ultérieur
Fibrillation auriculaire – HUG – DMCPRU – Service de médecine de premier recours - 2013
FIBRILLATION AURICULAIRE
1. INTRODUCTION
1.1 Définition
La Fibrillation auriculaire (FA), est une arythmie supraventriculaire caractérisée par une
activité atriale non coordonnée et très rapide avec comme conséquence la détérioration
de la fonction mécanique de l’oreillette.
La fibrillation auriculaire (FA) est l’arythmie la plus fréquente et sa prévalence augmente
avec l’âge. Elle affecte 4% des personnes âgées de plus de 60 ans et 6% (selon certai-
nes séries > 8%) de celles de plus de 80 ans1. La prévalence de FA augmente en pré-
sence d’une insuffisance cardiaque et de valvulopathies2. Moins fréquemment, la FA sur-
vient chez des patients de moins de 60 ans, sans évidence clinique ou échocardiogra-
phique de cardiopathie structurelle ou d’hypertension artérielle. On parle alors de FA sur
cœur sain (lone atrial fibrillation).
L’incidence annuelle d’accident vasculaire cérébral (AVC) d’un patient en FA est estimée
à 5%, soit de 2 à 7 fois plus élevée que dans la population normale. Lorsque la FA est
associée à une cardiopathie rhumatismale, ce risque augmente de 5 fois en comparaison
avec une présentant une FA d’origine non rhumatismale ou 17 fois en comparaison avec
une population témoin. Selon l’étude de Framingham, la FA est associée à une augmen-
tation de la mortalité de 1.5 à 1.9% ceci en lien essentiellement avec les complications
thromboemboliques3.
1.2 Physiopathologie
La FA est une arythmie supraventriculaire caractérisée par une dépolarisation anarchique
(très rapide et complètement irrégulière) du myocarde atrial. La physiopathologie de la
FA est complexe et semble être due à la coexistence de foyers ectopiques rapides (au
niveau des veines pulmonaires) et d’un tissu atrial anormal capable de maintenir
l’arythmie (multiple wavelets). Le remodelage atrial, les variations du système nerveux
autonome et l’inflammation semblent également contribuer à l’initiation et au maintien de
l’arythmie. L’hypertrophie des fibres auriculaires avec une micro-fibrose a été décrite
comme la principale anomalie histologique.
Du point de vu hémodynamique la perte de la contraction auriculaire et la fréquence
ventriculaire mal contrôlée entrainent une réduction du débit cardiaque et une augmenta-
tion de la pression capillaire pulmonaire ce qui peut provoquer ou décompenser une in-
suffisance cardiaque. La FA rapide chronique peut aussi entrainer une dysfonction ventri-
culaire gauche (tachycardia-mediated cardiomyopathy), réalisant un tableau
d’insuffisance cardiaque généralement réversible après le contrôle de la fréquence ven-
triculaire.
La perte de la contractilité auriculaire s’associe à la formation de thrombus intra auriculai-
re qui peut induire une embolisation systémique.
2. DEFINITION/CLASSIFICATION
Cette classification (tableau 1) qui est commune pour les sociétés américaines et euro-
péennes de cardiologie s’applique aux épisodes de FA qui durent plus de 30 secondes et
en l’absence de toute cause réversible : chirurgie cardiaque ou pulmonaire (complica-
Fibrillation auriculaire – HUG – DMCPRU – Service de médecine de premier recours - 2013
tion précoce fréquente), péricardite, myocardite, infarctus du myocarde (associé à un
mauvais pronostique), hyperthyroïdisme, embolie pulmonaire ou d’autres maladies pul-
monaires, éthylisme (holiday heart syndrome).
FA paroxystique: se terminant spontanément entre 24 h à 7 jours
FA persistante : durée de >7 jours (pouvant se terminer spontanément ou après cardio-
version)
FA permanente: FA acceptée : durée prolongée (au moins persistante) mais une cardio-
version n’a pas été tentée ou a échoué
Lone atrial fibrillation: paroxystique, persistante ou permanente chez un patients de <60
ans sans évidence clinique ou échocardiographique de maladie cardio-pulmonaire y com-
pris l’HTA.
Tableau 1: Classification de la FA
3. MANIFESTATIONS CLINIQUES
3.1 Anamnèse
Afin de caractériser la présence et la nature des symptômes: palpitations, douleur thora-
cique, dyspnée, fatigue, syncope (le plus souvent dans le contexte d’une maladie de
l’oreillette ou chez les patients avec une cardiopathie hypertrophique obstructive ou une
sténose aortique significative ou en présence d’un faisceau accessoire). Un événement
thromboembolique (AVC) peut être parfois la 1ère manifestation
3.2 Status
Auscultation cardiaque : souffle ?, recherche de signes d’insuffisance cardiaque
4. DIAGNOSTIC
4.1 ECG
Pour poser le diagnostic de FA et identifier des renseignements supplémentaires sur
l’étiologie (ATCD d’infarctus, hypertrophie ventriculaire gauche, préexcitation, bloc de
branche)
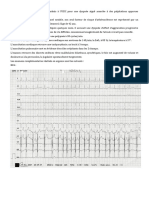
A l’ECG, (figure 1) les ondes P sinusales ne sont pas visible et parfois remplacées par
des ondes F (souvent bien visible en V1), irrégulières en amplitude et variables en mor-
phologie, à une fréquence de 400 à 600/min, donnant à la ligne de base un aspect trému-
lant. Si les ondes F ne sont pas visibles, on se base alors surtout sur l'irrégularité des
intervalles R-R. (cave: souvent régulier transitoirement en cas de fréquence ventriculaire
rapide ou en cas de bloc de conduction atrioventriculaire important).
Fibrillation auriculaire – HUG – DMCPRU – Service de médecine de premier recours - 2013
Figure 1: la réponse ventriculaire varie de 130-168/min. Le rythme est irrégulièrement
irrégulier. Pas d’onde P visible
4.2 Echocardiographie transthoracique (TT) afin d’identifier :
- une maladie valvulaire
- la taille des oreillettes
- la taille et fraction d’éjection du VG
- mesurer la pression pulmonaire (HTAP)
- une hypertrophie du ventricule gauche
- chercher un thrombus de l’oreillette gauche (mais l’écho TT est de faible sensibilité)
- une atteinte péricardique
4.3 Laboratoire :
TSH, FSC, électrolytes, fonction rénale et hépatique
4.4 Examens complémentaires
Il s’agit d’examens optionnels, dont l’indication dépend de la clinique (tableau 3).
• Test de marche de 6 mn : mesurer la FC à l’effort.
• Test d’effort dans le but : d’évaluer le contrôle de la FC à l’effort sous traitement, de
reproduire éventuellement une FA induite par l’effort, de chercher une cardiopathie is-
chémique si elle est suspectée ou avant d’introduire un ttt antiarythmique classe IC.
Fibrillation auriculaire – HUG – DMCPRU – Service de médecine de premier recours - 2013
• Holter à la recherche d’une FA paroxystique et afin d’évaluer le contrôle de la FC.
• Echographie trans-œsophagienne : surtout pour exclure un thrombus dans l’OG avant
une cardioversion (exclure thrombus intra-auriculaire gauche).
• Rx thorax : surtout pour évaluer le parenchyme pulmonaire et la vascularisation si
l’examen clinique suggère une anomalie.
Tableau 2: examens complémentaires facultatifs en cas de FA (selon clinique)
5. PRISE EN CHARGE
Les stratégies de la prise en charge de la FA ont pour but de :
• restaurer et maintenir le rythme sinusal : rhythm control
• contrôler la réponse ventriculaire : rate control
• prévention du thrombo-embolisme : anticoagulation
5.1 Restaurer et maintenir le rythme sinusal : rhythm control
Bien que la stratégie du rate control soit plus recommandée que le rythme control ce der-
nier doit être considéré essentiellement dans 4 situations :
• Symptômes persistants (palpitation, dyspnée, angor, syncope) malgré FC contrôlée
• FA avec une insuffisance cardiaque
• Contrôle difficile de la FC
• Jeune âge, niveau d’activité physique élevé
Le rétablissement du rythme sinusal par une cardioversion médicamenteuse ou électri-
que est souvent fait en électif et peut être associé à un risque thromboembolique élevé.
• Cardioversion médicamenteuse
La cardioversion médicamenteuse est la plus employée. L’introduction d’un traitement
anti-arythmique (tableau 3) se fait souvent en milieu hospitalier et sous monitoring car-
diaque. Les complications les plus fréquentes sont une bradycardie et une proarythmie
ventriculaire. D’autres événements sont possibles (prolongation du QT, torsades des
pointes et fibrillation ventriculaire, insuffisance cardiaque, réponse ventriculaire rapide,
hypotension). Ces risques sont à redouter les premières 24 h et au décours d’un infarctus
de myocarde.
Selon les guidelines de l’ESC (2010), certains anti-arythmiques (flecainide ou propafeno-
ne) peuvent être utilisés en milieu ambulatoire chez des patients bien sélectionnés (ab-
sence de dysfonction ventriculaire et maladie cardiaque structurelle, QT normal, pas de
bradycardie, pas de dysfonction du nœud sinusal ou AV) apres avoir les essayer au
moins une fois dans des conditions hospitalisé ou monitoré. L’amiodarone peut être in-
troduite en ambulatoire, si les conditions précédentes sont remplies et en l’absence
d’autres risques de torsade de pointe (hypokaliémie, hypomagnésiémie). Dans ces situa-
tions, il est conseiller d’effectuer des ECG de contrôle périodiquement: à 48-72 h, à 7
jours et parfois aussi à 15 jours.
Les patients porteurs d’un défibrillateur implantable, permettant de les protéger de brady-
cardie ou tachyarythmie, peuvent aussi bénéficier d’un traitement ambulatoire.
Un traitement bloquant le nœud atrioventriculaire est souvent associé avec certains mé-
dicaments anti-arythmiques (p.ex. flecainide) chez les patients ayant une FA à réponse
Fibrillation auriculaire – HUG – DMCPRU – Service de médecine de premier recours - 2013
ventriculaire moyenne à rapide. Par contre des anti-arythmiques comme le sotalol et
l’amiodarone peuvent être utilisés touts seuls la plupart des temps à cause de leur effet
dromotrope négatif.
Il faut mentionner qu’il n’y a pas de grandes études disponibles qui ont testé la stratégie
du contrôle du rythme par des approches électrophysiologiques non médicamenteuses.
Médicament Dose usuelle Contre in- Taux de cardi- Délai de
dication oversion conversion
Amiodarone IV: 150-300 mg en 30 bradycardie 40-90% 8-24h
(Cordarone®) sec suivi de 1.2-1.8 g/j
IV continu ou en dose
fractionnée PO jusqu’à
une dose totale 10 g
PO (ambulatoire) :
600-800 mg/j dose
fractionne jusqu’à
dose totale 10 g, en-
suite 200 à 400 mg/j
Flécaïnide (Tam- IV : 2mg/kg en 10-20’ Dysfonction 70-90% 1-8 h
bocor®) PO: 2x 50 mg/j au VG, isché-
maximum2x 150mg/j mie aiguë,
hypertrophie
ventriculaire
gauche
Propafénone IV : 1.5-2 mg/kg en Dysfonction 40-75% 3-8 h
(Rytmonorm®) 10-20 sec VG
PO : 3x 150mg à 2x
300mg/
Ibutilide (Cor- IV 1 mg en 10 sec à 30-70% 1 h pas
vert®) répéter si nécessaire disponible
Agit en env 20 min aux HUG
Cave : proarythmique
(TDP)
Vernakalant 3mg/kg en 10 min ;
CI : instabili- 50% 15-30 min
(Brinavess) suivi si necessaire par
te hemody-
un autre dose de
namique,
2mg/kg 15min apres.
d’autres anti-
arrhythmi-
que 4h au-
tour ; brady,
QT prolongé
Tableau 3 : Médicaments utilisés pour la cardioversion médicamenteuse
• Cardioversion électrique externe (CEE)
La CEE consiste à délivrer un choc électrique externe (commencer avec une faible éner-
gie initiale à 100 J) synchronisé aux QRS (afin d’éviter d’induire une arythmie ventriculai-
re par un choc sur l’onde T)
Fibrillation auriculaire – HUG – DMCPRU – Service de médecine de premier recours - 2013
Les patients porteurs d’un pacemaker ou d’un défibrillateur, peuvent bénéficier d’une
cardioversion électrique en cas de FA. Un contrôle du pacemaker ou du défibrillateur
après cardioversion s’impose.
Indications de la CEE:
- en cas de fréquence ventriculaire rapide non contrôlable par les antiarythmiques
notamment chez les patients avec une ischémie myocardique, hypotension symp-
tomatique, angor ou insuffisance cardiaque chez les patients avec une pré-
excitation (WPW: Wolff-Parkinson-White syndrome) avec tachycardie très rapide
et instabilité hémodynamique Maintien du rythme sinusal et prévention de la re-
chute
Le choix de l’anti arythmique afin de maintenir le rythme sinusal dépend du rapport ris-
que/efficacité qui doit être évalué en fonction de l’âge, de la présence ou non de maladie
cardiaque, de la sévérité des symptômes et la présence des troubles de conduction à
l’ECG (tableau 4).
L’amiodarone ne doit pas être systématiquement prescrit comme traitement de 1ère li-
gne, bien que selon les études il semble plus efficace que le sotalol et les antiarythmique
de classe I.
Une alternative pour maintenir le rythme sinusal serait la Dronédarone (Multaq®) un
nouvel agent non iodé réduisant le risque de thyrotoxicité. La dronédarone est un blo-
queur de multiples canaux et a des propriétés électrophysiologiques semblables à
l’amiodarone. Toutefois, son efficacité relativement faible, sa contre-indication en cas
d’insuffisance cardiaque (avec risque d’augmentation de la mortalité) et les risques
d’hépatotoxicité imposant un suivi trimestriel des transaminases font que ce médicament
est peu prescrit. La dronédarone est principalement métabolisée par le CYP 3A4, elle est
un inhibiteur modéré du CYP 3A4 et léger du CYP 2D6. De ce fait des interactions sont
attendues et la prudence s’impose lors de l’administration concomitante avec des inhibi-
teurs ou des inducteurs du CYP 3A4.
Chez les patients avec une maladie coronarienne sans signe d’insuffisance cardia-
que, le sotalol peut être prescrit comme traitement de 1ère ligne ainsi que l’amiodarone,
mais les antiarythmiques de classe I (flécainide) sont proscrits.
A noter que le sotalol et les médicaments de classe Ic (flecainide et propafenone) ont une
élimination rénale, et doivent être utilisés avec précaution dans ce contexte. et ne doivent
pas être prescrit chez les patients avec une HVG en raison du risque de proarythmies.
Chez les patients sans dysfonction du ventricule gauche, le flécainide ou la propafé-
none peut être une option de 1er ligne mais associé à un traitement bêtabloquant.
Médicaments Dose quotidienne Indications Contre-Indications
Amiodarone 200 mg/j Insuffisance cardia-
que
Flécaïnide 150-300 mg/j Dysfonction ventricu-
laire post-infarctus,
Propafenone 450-600mg/j hypertrophie ventri-
culaire gauche
Sotalol 160-320 mg/j (la dose doit
être ajustée en fonction de la
fonction rénale et l’intervalle
QT)
Dronédarone Histoire récente de IC congestive
400 mg 2x/j (au repas matin et FA ou FA actuelle cl NYHA IV ou cl
Fibrillation auriculaire – HUG – DMCPRU – Service de médecine de premier recours - 2013
soir). NYHA II-III avec une
décompensation
récente ayant
conduit à une hospi-
talisation
Tableau 4 : Médicaments pour maintenir le rythme sinusal
• Autres traitements
- Ablation chirurgicale
L’ablation par un bistouri électrique ou cryoenergie (moins fréquemment avec une lame
suivi par des points sutures) dans les deux oreillettes élimine la FA chez plus de 60 %
des patients, parfois jusqu'à 90% dans certaines études. Par contre, un tel geste chirurgi-
cal est complexe et associé à des risques per/post opératoire importants, y compris de
décès.
- Ablation par cathéter de radiofréquence
L'ablation de la FA par voie percutanée consiste à effectuer une déconnexion électrique
des veines pulmonaires. Les foyers veineux (triggers) ainsi isolés ne pourront plus faire
passer les oreillettes en fibrillation. On crée, en utilisant la radiofréquence comme source
d'énergie, une lésion circonférentielle autour de l'ostium des quatre veines pulmonaires.
Cette procédure est actuellement proposée aux patients qui présentent une FA paroxys-
tique, symptomatique et réfractaire à plusieurs antiarythmiques. Le taux de succès (élimi-
nation de FA) est de l'ordre de 85 à 90% en cas de FA paroxystique et 70% à 85% en
cas de FA persistante. Les principales complications, à savoir les accidents thromboem-
boliques cérébraux et la sténose des veines pulmonaires sont rares 6. En cas d’échec,
l'ablation de nœud AV et la pose d’un pacemaker définitif pouvant être nécessaire. Une
anticoagulation efficace pendant un mois est requise avant la procédure et doit être pour-
suivie après durant trois mois. En l'absence de récidive et facteurs de risque emboligè-
ne, l'option d'arrêt de l'anticoagulation pourrait être considérée.
5.2 Ralentissement et contrôle de la fréquence ventriculaire: rate control
Le but du traitement pharmacologique est d’assurer une fréquence cardiaque cible de
60-80/mn au repos et de 90 à 115/min durant un effort physique modéré.
La digoxine est rarement suffisante pour contrôler la fréquence cardiaque à l’effort ; elle
est surtout indiquée chez les patients insuffisants cardiaques en FA. Les bétabloquants,
le diltiazem ou le vérapamil sont les molécules les plus utilisées en l’absence de contre-
indication en l’absence de signe d’insuffisance cardiaque et peuvent être utilisées en IV
en aigu et en PO pour un traitement de fond (Tableaux 5+6a+6b)
• Situations particulières :
- Faisceau accessoire: chez les patients avec un WPW, l’amiodarone serait le
traitement de 1ère option.
- Hyperthyroïdie: Les bêtabloquants son recommandés pour le contrôle de la ré-
ponse ventriculaire (IB).
- Grossesse: La digoxine, un bêtabloquant ou un anticalcique non-dihydripyridine
sont recommandé pour contrôler la fréquence ventriculaire chez la femme encein-
te (IC). En cas d’instabilité hémodynamique la CEE est recommandée (IC).
Fibrillation auriculaire – HUG – DMCPRU – Service de médecine de premier recours - 2013
Médicament Dose de charge Début Dose Effets secondaires
d’action d’entretien
Diltiazem 0,25mg/kg iv/2 mn 2-7 mn 5-15 mg/h de Hypotension, BAV, IC
perfusion
Metoprolol 2,5-5 mg iv bolus/2 5 mn Non applicable Hypotension, BAV,
mn bradycardie, asthme,
IC
Verapamil 0,075-0,15 mg/Kg 3-5 mn Non applicable Hypotension,
iv/2 mn bradycardie, IC
Digoxine 0,25 mg iv chaque 2h 0,125-0,25mg/j Intoxication digitalique,
2 h (max 1,5mg) BAV, bradycardie.
Tableau 5 : contrôle aigu de la réponse ventriculaire IV
Médicaments Début Dose d’entretien Effets secondaires Niveau
d’action d’évidence
Diltiazem 2-4h 120-360mg/j en Hypotension, IC, bloc cardiaque IB
plusieurs doses
Metoprolol 4-6h 25-100 mg 2 x/j Hypotension, IC, bradycardie, IC
bloc cardiaque, asthme
Propranolol 60-90 80-240 mg/j en Hypotension, IC, bradycardie, IC
min plusieurs prises asthme,
Verapamil 1-2h 120-360 mg/j en Hypotension, IC, bloc cardiaque, IB
plusieurs prises interaction avec digoxine
Tableau 6a : contrôle chronique de la réponse ventriculaire PO
Médicaments Dose de charge Début Dose Effets secondaires
d’action d’entretien
Digoxine 0,5 mg po /j Max 1,5 2j 0,125- Intoxication, Bloc car-
mg) 0,375mg/j diaque, IC, bradycar-
die
Amiodarone 800 mg/j pdt 7j, 1-3 sem 200 mg/j Toxicité pulmonaire,
600 mg/j pdt 7j, décoloration cutanée,
400 mg/j pdt 4-6 se- dépôt coronarien,
maines hypothyroïdisme, neu-
ropathie optique, pro-
arythmie, interaction
avec AVK
Tableau 6b: contrôle de la fréquence cardiaque chez les patients avec insuffisance car-
diaque et sans faisceau accessoire (WPW)
5.3 Rhythm versus rate control
Les deux approches rate et rhythm control sont des approches acceptables pour le trai-
tement de la FA. Les études AFFIRM, RACE, AF-CHF ne montrent pas d’avantages du
rhythm control comparé au rate control. Ces études montrent que les événements embo-
liques surviennent avec la même fréquence dans les deux approches choisies et sur-
viennent le plus souvent après l’arrêt de l’anticoagulation orale (warfarine) ou en cas
d’anticoagulation non optimale. De même aucun impact sur la mortalité n’a été mis en
évidence7. Aucune différence significative sur l’état fonctionnel ou sur la qualité de vie n’a
pu être démontrée prospectivement avec le rhythm control pharmacologique, par contre,
Fibrillation auriculaire – HUG – DMCPRU – Service de médecine de premier recours - 2013
une analyse post-hoc dans le sous-groupe d’AFFIRM avec maintien d’un rythme sinusale
a démontré une meilleure qualité de vie et niveau de tolérance a l’effort.
Il persiste un risque embolique, avec la stratégie de rhythm control, en raison probable-
ment des épisodes récurrents de FA (20 à 60%) en milieu de anticoagulation sous-
optimale, comparé à 70 à 80 % sans rhythm control. Plus de 40% des épisodes récur-
rents de FA sont asymptomatiques.
5.4 FA réfractaire aux traitements médicamenteux
Certains patients ont une FA réfractaire à un traitement anti-arythmique associé à un blo-
queur de la conduction AV et d’autres développent des effets secondaires importants.
L’association de plusieurs anti-arythmiques est souvent déconseillée à cause des effets
secondaires importants. Dans ces cas, il faut adopter la stratégie de rate control ou réfé-
rer les patients pour un traitement non pharmacologique.
5.5 Prévention des embols : anticoagulation
• Avant une cardioversion
Une FA de durée de <48 h peut être cardioversée sans anticoagulation préalable (mais
ceci doit être administrée pour couvrir la période de la cardioversion). Chez ces patients
la poursuite de l’anticoagulation sera évaluée en fonction du risque thromboembolique.
Chez les patients en FA datant de >48 h ou de durée inconnue une anticoagulation thé-
rapeutique doit être assurée durant au moins 3 semaines avant la cardioversion et pour-
suivie au moins 4 semaines après la cardioversion (électrique ou médicamenteuse).
Une cardioversion peut être effectuée de manière sure et sans anticoagulation préalable
si une échocardiographie transoesophagienne effectuée avant la cardioversion ne mon-
tre pas de thrombus intra-auriculaire (toutefois, l’anticoagulation doit être poursuivie du-
rant au moins 4 semaines après la cardioversion).
• Stratification du risque embolique
Selon les recommandations européennes et américaines de cardiologie le choix entre
l’aspirine et les anticoagulants oraux dépend du risque d’AVC qui varie considérablement
en fonction de l’âge et des comorbidités, raison pour laquelle une stratification de ce ris-
que est utile. Plusieurs études ont évalué les facteurs de risque embolique afin de prédi-
re ce risque et le bénéfice d’une thérapie avec des AVK ou de l’aspirine chez les patients
avec FA non valvulaire et des modèles multivariés de risque ont été proposés11.
La combinaison des schémas utilisés par l’équipe du Atrial Fibrillation Investigators et
Stroke Prevention in Atrial Fibrillation a aboutit à la classification proposée sous
l’acronyme CHADS2 –Vasc (Tableau 7) qui retient les facteurs de risque d'AVC indiqués
dans le tableau 7, le score est obtenu en additionnant les points attribués. Le score
CHADS2 vasc a été le plus largement adopté et a l’avantage d’être le plus simple à utili-
ser en clinique. Il peut être nécessaire de réactualiser le score au cours du temps, lors-
que les patients développent de nouveaux facteurs de risque.
Le score de CHADS 2-vasc ne s’applique pas aux patients ayant une cardiopathie valvu-
laire (rétrécissement et régurgitation mitrale, prothèses valvulaires mécanique ou biopro-
thèse), ces patients ont un risque embolique important et doivent tous recevoir une anti-
coagulation orale.
Fibrillation auriculaire – HUG – DMCPRU – Service de médecine de premier recours - 2013
Condition Points
Insuffisance cardiaque (le C étant pour le terme anglais Congestive heart failure)
C 1
ou fraction d'éjection diminué.
H Hypertension artérielle 1
A2 Âge supérieur à 75 ans 2
D diabète 1
antécédent d'accident vasculaire-cérébral (le S étant pour le terme anglais de
S2 2
Stroke, le 2 en indice étant le « poids » de ce paramètre
antécédent de maladie vasculaire (artériopathie oblitérante des membres infé-
V 1
rieurs, infarctus du myocarde...)
A Âge compris entre 65 et 74 ans 1
Sc Femme (SC étant l'acronyme du terme anglais « Sex category » 1
Tableau 7 : Score CHADS2-VASc
Recommandations d’anticoagulation :
• Score > 2 : anticoagulation orale.
• Score = 1 : anticoagulation orale ou aspirine avec une préférence pour les anti-
coagulants oraux.
• Aucun facteur de risque : pas de traitement antithrombotique ou aspirine avec une
préférence pour l'absence de traitement antithrombotique.
• Évaluation du risque hémorragique avec le score HAS BLED (15)
Le risque de saignement doit également être évalué et doit faire partie de toute stratégie
thérapeutique dans la FA. Le score proposé est le score HAS BLED (Tableau 8).
Caractéristique Points
Hypertension 1
Anomalie de la fonction rénale ou hépati- 1 pour chacun
que
AVC 1
Hémorragie 1
INR instables 1
Âge > 65 ans 1
Drogues ou alcool 1 ou 2
Fibrillation auriculaire – HUG – DMCPRU – Service de médecine de premier recours - 2013
Score maximum 9
Tableau 8 : Nouvelles recommandations ESC sur la FA : score HAS-BLED ; Risque éle-
vé si le score est > 3
• Anticoagulation au long cours
Le risque thromboembolique semble être équivalent chez les patients en FA paroxystique
et chez eux en FA chronique et de ce fait le traitement antithrombotique est le même.
Les antivitamines K (AVK) sont actuellement la classe thérapeutique la plus efficace dis-
ponible pour la prévention des événements thromboemboliques8.
L’association aspirine-clopidogrel chez les patients avec un risque modéré d’AVC, sem-
ble moins efficace que les AVK et présente cependant un risque d’hémorragie majeure
similaire à celui des AVK (2,4 % vs 2,2 % par année) selon les données de l’étude ACTI-
VE-W9. Malgré les risques et les inconvénients, les données font fortement pencher la
balance en faveur de l’anticoagulation avec les AVK chez la plupart des patients.
Il faut viser des taux d’INR (international normalized ratio) entre 2 et 310. Deux médica-
ments AVK (dérivés de la coumarine) sont utilisés actuellement en Suisse ;
l’acénocoumarol (Sintrom®) et la phenprocoumone (Marcoumar®). La plupart des études
dans le monde ont été effectuées avec la warfarine, un autre dérivé coumarininique qui
n’est pas disponible en Suisse.
Le dabigatran (Pradaxa) et le rivaroxabn (Xarelto) sont des anticoagulants oraux dis-
ponibles récemment, qui ne nécesitent pas de monitoring de l’INR, sont au moins aussi
efficace pour prévenir les évènements thrombo-emboliques avec un taux significative-
ment moindre d’hémorragie cérébral que la warfarin. Toutefois, en raison de leur coût
élevé et de l’absence d’antagonistes, leur indication en lieu et place des AVK doit être
réfléchie (p.ex. chez des patients avec un INR labile). Ils ne peuvent pas être utilisés
pour des patients avec une cardiopathie valvulaire (valvulopathie rhumatismale) et non
plus pour des patients avec un syndrome coronarien aigue ou récente avec FA (car pas
de même niveau de protection).
• Interruption de l’anticoagulation
Chez les patients ayant une FA non valvulaire l’anticogulation peut être interrompue pen-
dant 1 semaine si une intervention à haut risque hémorragique est programmée. Dans
les autres situations (patients à haut risque thromboembolique) une interruption de trai-
tement anticoagulant par voie orale nécessite un relais par héparine non fractionnée ou
héparine de bas poids moléculaire
• Mode de suivi clinique ambulatoire
- Contrôle symptômes, fréquence cardiaque, signes d’insuffisance cardiaque, anti-
coagulation
- Consultation cardiologique :
o Pour toute FA jugée non-secondaire avec bilan cardiaque au moins une
fois
o Symptômes réfractaires
o Fréquence cardiaque difficile à contrôler
o FA avec insuffisance cardiaque
o FA avec évenement thrombo-embolique
o FA avec dysfonction du VG
Fibrillation auriculaire – HUG – DMCPRU – Service de médecine de premier recours - 2013
o Planifier un contrôle du rythme
6. REFERENCES
1. Flegel KM,Shipley MJ, Rose G. Risk of stroke in non rheumatic atrial fibrillation. Apr
11 ;1(8537) :878. Lancet 1987 ;1 :526-9
2. Wolf PA, Abbott RD,Kannel WB. Atrial fibrillation as an independent risk factor for
stroke : the Framingham study. Stroke 1991; 22:983-8.
3. Wolf P, Abbott R, Kannel W. Atrial fibrillation as an independent risk factor for stroke:
The Framingham Study. Stroke. 1999;22:983-988.
4. Guiraudon CM, Ernst NM,Yee R ; The pathology of drug resistant lone atrial fibirllation
in eleven surgically treated patients Kluwer Academic pub ,1992 :41-57..
5. Yin Y et col. Eur H J 2006 ; 27 : 1841-46 et Healey JS et col. J Am Col Cardiol
2005;45:1832-39.
6. Sunthorn H, Burri H, Shah D. Ablation de la fibrillation auriculaire par voie percutanée :
pour qui et comment ? Med Hyg 2004; 62:1097-102.
7 . Wyse, DG, Waldo, Al, Di Marco, JP et al. A comparison of rate control and rhythm,
control in patients with atrial fibrillation. N Engl J Med 2002 ;347 :1825.
8. Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent
stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med.
2007;146(12):857-867.
9. Fuster V, Ryden LE, Cannom DS, et coll. ACC/AHA/ESC 2006 Guidelines for the
Management of Patients with Atrial Fibrillation: a report of the American College of Cardi-
ology/American Heart Association Task Force on Practice Management of Patients With
Atrial Fibrillation): developed in collaboration with the European Heart Rhythm Associa-
tion and the Heart Rhythm Society.Circulation. 2006;114(7):e257-e354.
10. Hylek EM, an analysis of the lowest effective intensity of prophylactic anticoagulation
for patients with nonrheumatic atrial fibrillation. N Engl J Med 1996 ; 335 :540-6.
11. Comparison of 12 risk stratification schemes to predict stroke in patients with nonval-
vular atrial fibrillation. Stroke 2008; 39:1901.
12. Gage BF et al. Validation of clinical classification schemes for predicting stroke: re-
sults from the National Registry of Atrial Fibrillation. JAMA 2001 Jun 13;285(22):2864-70
13. Go AS, et al. Anticoagulation therapy for stroke prevention in atrial fibrillation: how
well do randomized trials translate into clinical practice? JAMA 2003 Nov
26;290(20):2685-92.
14. Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ, Refining clinical risk stratification
for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-
based approach: the Euro Heart Survey on Atrial Fibrillation [archive], Chest,
2010;137:263–272
15. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation,
European Heart Journal, doi:10.1093/eurheartj/ehs253
16. Prevalence, mechanisms, and clinical significance of
macroreentrant atrial tachycardia during and following
left atrial ablation for atrial fibrillation, Heart Rhythm 2005;2:464–471
Date de la 1ère édition mars 1998 par J. Sztajzel et C. Bernard
Mises à jour: Décembre 2002 par J. Sztajzel et H. Stalder
Eté 2010 par M. Baroudi, A Keta, P Meyer, H Burri, D. Shah
Pour tout renseignement, commentaire ou question : marie-christine.cansell@hcuge.ch
Fibrillation auriculaire – HUG – DMCPRU – Service de médecine de premier recours - 2013
Vous aimerez peut-être aussi
- Les Troubles du Rythme Cardiaque : Comprendre, Diagnostiquer et TraiterD'EverandLes Troubles du Rythme Cardiaque : Comprendre, Diagnostiquer et TraiterPas encore d'évaluation
- La Fibrillation Auriculaire PDFDocument6 pagesLa Fibrillation Auriculaire PDFRahalisonPas encore d'évaluation
- 2015-2e Ref Cardio ch14 Fibrillation AtrialeDocument21 pages2015-2e Ref Cardio ch14 Fibrillation AtrialeYassine TaoussiPas encore d'évaluation
- Oap 2Document3 pagesOap 2Luc TiendrebeogoPas encore d'évaluation
- Fiche FADocument5 pagesFiche FAfichesevc100% (3)
- CAS CLINIQAUE Nouveau Document Microsoft Office Word - PDF Filename UTF-8''CDocument9 pagesCAS CLINIQAUE Nouveau Document Microsoft Office Word - PDF Filename UTF-8''CAnis Ali-khodjaPas encore d'évaluation
- 6 - Fibrillation Atriale Dr. ABBOUDocument7 pages6 - Fibrillation Atriale Dr. ABBOUImeneSba100% (1)
- Q 104 TVPDocument4 pagesQ 104 TVPLahcen BoulahcenPas encore d'évaluation
- CAS CLINIQAUEJUIN 2014 Nouveau Document Microsoft Office Word - PDF FilenameDocument10 pagesCAS CLINIQAUEJUIN 2014 Nouveau Document Microsoft Office Word - PDF FilenameAnis Ali-khodjaPas encore d'évaluation
- Journée de Cardiologie IUCPQDocument31 pagesJournée de Cardiologie IUCPQracine222222Pas encore d'évaluation
- Explr SnaDocument21 pagesExplr Sna7ams ChoukriPas encore d'évaluation
- 00 917Document9 pages00 917hizballah27Pas encore d'évaluation
- Fiche FADocument5 pagesFiche FAfichesevcPas encore d'évaluation
- HTA Insuffisant CardiaqueDocument5 pagesHTA Insuffisant Cardiaquedr barnigaPas encore d'évaluation
- Cas Clinique RAoDocument19 pagesCas Clinique RAoAnis DjemaiPas encore d'évaluation
- La MAPA Quelles Sont Les Clés Dune Bonne InterprétationDocument4 pagesLa MAPA Quelles Sont Les Clés Dune Bonne InterprétationDav HadibiPas encore d'évaluation
- Gestion D'un Traitement AnticoagulantDocument25 pagesGestion D'un Traitement AnticoagulantDoria Ouahrani100% (1)
- L'embolie PulmonaireDocument53 pagesL'embolie PulmonaireBMA-medecine100% (4)
- Prise en Charge Hta RenovasculaireDocument42 pagesPrise en Charge Hta RenovasculaireIdrissou FmsbPas encore d'évaluation
- RÃponses Questions de LExamen de PremiÃre AnnÃe en AnesthÃsie RÃanimationDocument6 pagesRÃponses Questions de LExamen de PremiÃre AnnÃe en AnesthÃsie RÃanimationfbncqfwp68Pas encore d'évaluation
- Surveillance Post Opératoire en Chirurgie Cardiaque 14Document27 pagesSurveillance Post Opératoire en Chirurgie Cardiaque 14wooden latexPas encore d'évaluation
- FA Réanimatoire PDFDocument21 pagesFA Réanimatoire PDFQuentin KesslerPas encore d'évaluation
- Cardiologie Pediatrique Pratique PDFDocument828 pagesCardiologie Pediatrique Pratique PDFMoncef Pecha100% (1)
- Syndrome de Tako-TsuboDocument32 pagesSyndrome de Tako-Tsuboblk fatimaPas encore d'évaluation
- CAT EMBOLIE PULMONAIRE - CopieDocument47 pagesCAT EMBOLIE PULMONAIRE - Copiekhadimoumou100Pas encore d'évaluation
- La MAPA Quelles Sont Les Clés D'une Bonne InterprétationDocument5 pagesLa MAPA Quelles Sont Les Clés D'une Bonne InterprétationRamo BeckerPas encore d'évaluation
- Edirect Cardionbsp Une Heure de Direct Consacre lHTA Une Rencontre Anime Et Riche Denseignement JoDocument4 pagesEdirect Cardionbsp Une Heure de Direct Consacre lHTA Une Rencontre Anime Et Riche Denseignement JoRamo BeckerPas encore d'évaluation
- 331R - Arret CardiocirculatoireDocument2 pages331R - Arret CardiocirculatoireCristina BesarabPas encore d'évaluation
- MasterClass - Insuffisance Cardiaque: CIC Concept - Pratique 2019 CHR LiègeDocument248 pagesMasterClass - Insuffisance Cardiaque: CIC Concept - Pratique 2019 CHR LiègeTroisfontaines PierrePas encore d'évaluation
- La MAPA Quelles Sont Les Cls Dune Bonne InterprtationDocument4 pagesLa MAPA Quelles Sont Les Cls Dune Bonne InterprtationRamo BeckerPas encore d'évaluation
- Prise en Charge de L Embolie PulmonaireDocument8 pagesPrise en Charge de L Embolie PulmonaireAlain SoucotPas encore d'évaluation
- Cas Clinique Hepato FARTOUXDocument24 pagesCas Clinique Hepato FARTOUXAbdelhak Zaher Benbouali100% (1)
- Cas CliniqueDocument37 pagesCas Cliniqueأسامة أسامةPas encore d'évaluation
- Examens Complementaires en CardiologieDocument35 pagesExamens Complementaires en CardiologieSandra PaivaPas encore d'évaluation
- Les Limites Du Bilan Standard D'hémostaseDocument1 pageLes Limites Du Bilan Standard D'hémostaseLAMA LAMAPas encore d'évaluation
- AlloimmunisationDocument25 pagesAlloimmunisationQassifi MarwanePas encore d'évaluation
- Anticoagulation Et Insuffisance Renale 2018Document16 pagesAnticoagulation Et Insuffisance Renale 2018Hind MechoumaPas encore d'évaluation
- Cpa 2023Document37 pagesCpa 2023ezzaouia.tahaPas encore d'évaluation
- Rôle de L'échographie Cardiaque Dans La Prise en Charge de L'hypertrension Arterielle PulmonaireDocument8 pagesRôle de L'échographie Cardiaque Dans La Prise en Charge de L'hypertrension Arterielle Pulmonairenvidia corePas encore d'évaluation
- Choc-En-Obstétrique DR.R BouallegDocument43 pagesChoc-En-Obstétrique DR.R BouallegRosa Line100% (1)
- Presentation Neuro 1Document7 pagesPresentation Neuro 1AnniH6Pas encore d'évaluation
- Du Nouveau Dans La Prévention de La Cardiotoxicité Des Chimiothérapies ?Document3 pagesDu Nouveau Dans La Prévention de La Cardiotoxicité Des Chimiothérapies ?Hamza Abu HumaidPas encore d'évaluation
- 10 - Lhypertension ArtérielleDocument7 pages10 - Lhypertension Artérielleهمس همس (همس)Pas encore d'évaluation
- Embolie PulmonaireDocument32 pagesEmbolie PulmonaireEsstst RadiologiePas encore d'évaluation
- Echographie Du Patient Choque Laurent MULLER NimesDocument22 pagesEchographie Du Patient Choque Laurent MULLER NimesJackson MavilaPas encore d'évaluation
- 3 - RaoDocument3 pages3 - Raoboutefal imenePas encore d'évaluation
- Le Syndrome Du QT Long BrochureDocument12 pagesLe Syndrome Du QT Long BrochurevgptmPas encore d'évaluation
- AnticoagcarteDocument4 pagesAnticoagcarteHind MechoumaPas encore d'évaluation
- 232 Item R2C FaDocument4 pages232 Item R2C FaFélix KOESTELPas encore d'évaluation
- Les Journes dHTA de Nouvelles Recommandations Journal Cardiologie PratiqueDocument11 pagesLes Journes dHTA de Nouvelles Recommandations Journal Cardiologie PratiqueRamo BeckerPas encore d'évaluation
- Syndrome Coronarien Aigu ST+ (Infarctus Du Myocarde)Document9 pagesSyndrome Coronarien Aigu ST+ (Infarctus Du Myocarde)Mahefa Serge RakotozafyPas encore d'évaluation
- La Fonction Circulatoire: Chapitre 3Document8 pagesLa Fonction Circulatoire: Chapitre 3ibtihelantriPas encore d'évaluation
- Conseils A La Prescription en HemostaseDocument11 pagesConseils A La Prescription en HemostaselembarkiPas encore d'évaluation
- 1-s2.0-S266647982200146X-amDocument3 pages1-s2.0-S266647982200146X-amsafusarl01Pas encore d'évaluation
- Insuffisance Hepatique Aigue-2Document13 pagesInsuffisance Hepatique Aigue-2Asmae OuissadenPas encore d'évaluation
- La Dysplasie Arythmogène Pertinence Des Examens DiagnostiquesDocument7 pagesLa Dysplasie Arythmogène Pertinence Des Examens DiagnostiquesAHOUANSOUPas encore d'évaluation
- QO Cardio 2023Document54 pagesQO Cardio 2023elenipapadopoulos.dicPas encore d'évaluation
- Insuffisance Cardiaque Chronique ArceDocument13 pagesInsuffisance Cardiaque Chronique Arcehamidbay313Pas encore d'évaluation
- 18. Anesthésie Réanimation chez l_hypertenduDocument168 pages18. Anesthésie Réanimation chez l_hypertendukheira SaketPas encore d'évaluation
- Medtizi ECGDocument19 pagesMedtizi ECGsamyriusPas encore d'évaluation
- Quizz Semio CardioDocument40 pagesQuizz Semio CardioFatoumata FALL100% (1)
- Cardio HallaDocument53 pagesCardio HallaTewfik TGrPas encore d'évaluation
- Valvulopathies 1Document63 pagesValvulopathies 1ale maril100% (1)
- Le Cycle CardiaqueDocument8 pagesLe Cycle CardiaqueMohamedBahmed100% (1)
- Troubles Du RythmeDocument20 pagesTroubles Du RythmePierre DeharchiesPas encore d'évaluation
- TP 4 Elec41Document3 pagesTP 4 Elec41cpagtchadPas encore d'évaluation
- Rhumatisme Articulaire AiguDocument7 pagesRhumatisme Articulaire AiguLazaar HamidPas encore d'évaluation
- L'EcgDocument10 pagesL'EcghichamPas encore d'évaluation
- 4 72 TamponnadeDocument3 pages4 72 Tamponnadewilbine belliot-jacquetPas encore d'évaluation
- Item 334 - Angor Chronique StableDocument5 pagesItem 334 - Angor Chronique Stableabdele.adelPas encore d'évaluation
- Aide Cognitive TachycardieDocument1 pageAide Cognitive TachycardieThomasPas encore d'évaluation
- Cardiologie Et Pathologievasculaire2Document61 pagesCardiologie Et Pathologievasculaire2Kadre DerraPas encore d'évaluation
- IC SuiteDocument4 pagesIC SuiteJean Jockson Laudy BaltazarPas encore d'évaluation
- Blocs AuriculoventriculairesDocument15 pagesBlocs AuriculoventriculairesSeif SeifoPas encore d'évaluation
- Bon Résumé ECGDocument3 pagesBon Résumé ECGranimale100% (1)
- Antiangineux - Les Points EssentielsDocument7 pagesAntiangineux - Les Points EssentielsAYOUB BAYADDIPas encore d'évaluation
- Cardiopathies CongenitalesDocument14 pagesCardiopathies CongenitalesAsma BdfPas encore d'évaluation
- ValvulopathiesDocument4 pagesValvulopathiesLouisGrassoPas encore d'évaluation
- Cas Clinique OapDocument4 pagesCas Clinique OapLuc TiendrebeogoPas encore d'évaluation
- CAT Devant DT Aigue TD Chirurgie GNRL Douira - BYDocument33 pagesCAT Devant DT Aigue TD Chirurgie GNRL Douira - BYMohamed MimouPas encore d'évaluation
- Cardio My Opa ThiesDocument49 pagesCardio My Opa Thiesidra.mahomPas encore d'évaluation
- FR Complications de L'infarctus - Évolution Et PronosticDocument11 pagesFR Complications de L'infarctus - Évolution Et PronosticJuan-Claudio Rodríguez Portier100% (1)
- EMC Anesthésie Du Cardiaque en Dehors de La Chirurgie CardiaqueDocument10 pagesEMC Anesthésie Du Cardiaque en Dehors de La Chirurgie CardiaqueCecile Madiba ManuelaPas encore d'évaluation
- Cardio4an-Sd Coronariens Aigues2018menzriDocument38 pagesCardio4an-Sd Coronariens Aigues2018menzriAimen SahPas encore d'évaluation
- ACCA Toolkit 2018 Francais 1Document212 pagesACCA Toolkit 2018 Francais 1GabrielaOanePas encore d'évaluation
- Syndrome de Wellens PDFDocument2 pagesSyndrome de Wellens PDFNicolas KanzaPas encore d'évaluation
- Cas Clinique RAoDocument19 pagesCas Clinique RAoAnis DjemaiPas encore d'évaluation
- Etudiant Insuffisance CardiaqueDocument99 pagesEtudiant Insuffisance Cardiaquezbacked0Pas encore d'évaluation
- Esc Pocket Guidelines HF 2021 IDocument62 pagesEsc Pocket Guidelines HF 2021 IMourad BouayedPas encore d'évaluation
- AntiarythmiquesDocument37 pagesAntiarythmiquesaymen garciPas encore d'évaluation
- Microbiologie médicale I: agents pathogènes et microbiome humainD'EverandMicrobiologie médicale I: agents pathogènes et microbiome humainÉvaluation : 5 sur 5 étoiles5/5 (1)
- La maîtrise de soi-même par l'autosuggestion conscienteD'EverandLa maîtrise de soi-même par l'autosuggestion conscienteÉvaluation : 5 sur 5 étoiles5/5 (2)
- L'Argent Colloïdal - L'Antibiotique Naturel: L'Alternative Holistique Aux Antibiotiques Nouveau DécouvertD'EverandL'Argent Colloïdal - L'Antibiotique Naturel: L'Alternative Holistique Aux Antibiotiques Nouveau DécouvertPas encore d'évaluation
- Encyclopédie de la thérapie par ventouses : Une nouvelle éditionD'EverandEncyclopédie de la thérapie par ventouses : Une nouvelle éditionPas encore d'évaluation
- La maîtrise de soi-même par l'autosuggestion consciente: la méthode CouéD'EverandLa maîtrise de soi-même par l'autosuggestion consciente: la méthode CouéPas encore d'évaluation
- Le TDAH chez l’adulte : Comment reconnaître & faire face au TDAH chez l’adulte en 30 étapes faciles.D'EverandLe TDAH chez l’adulte : Comment reconnaître & faire face au TDAH chez l’adulte en 30 étapes faciles.Pas encore d'évaluation
- Revue des incompris revue d'histoire des oubliettes: Le Réveil de l'Horloge de Célestin Louis Maxime Dubuisson aliéniste et poèteD'EverandRevue des incompris revue d'histoire des oubliettes: Le Réveil de l'Horloge de Célestin Louis Maxime Dubuisson aliéniste et poèteÉvaluation : 3 sur 5 étoiles3/5 (3)
- Régime IG bas pour débutants : Guide pratique de la cuisine IG bas super facile avec 45 recettes IG bas pour tous les joursD'EverandRégime IG bas pour débutants : Guide pratique de la cuisine IG bas super facile avec 45 recettes IG bas pour tous les joursPas encore d'évaluation
- Prise en soins de patients: L'inévitable contre-transfertD'EverandPrise en soins de patients: L'inévitable contre-transfertÉvaluation : 5 sur 5 étoiles5/5 (1)
- Les Miracles De La Medecine ProphetiqueD'EverandLes Miracles De La Medecine ProphetiqueÉvaluation : 5 sur 5 étoiles5/5 (4)
- Les Graines d'Abricot - Remède de Cancer avec de la Vitamine B17 ?: La Médecine Antique Que l'Industrie Pharmaceutique Moderne CacheD'EverandLes Graines d'Abricot - Remède de Cancer avec de la Vitamine B17 ?: La Médecine Antique Que l'Industrie Pharmaceutique Moderne CachePas encore d'évaluation
- Les 10 Secrets pour une Vie Plus Heureuse avec la Maladie de ParkinsonD'EverandLes 10 Secrets pour une Vie Plus Heureuse avec la Maladie de ParkinsonPas encore d'évaluation
- Diagnostics différentiels des psychoses endogènes, des troubles de la personnalité et des névrosesD'EverandDiagnostics différentiels des psychoses endogènes, des troubles de la personnalité et des névrosesÉvaluation : 4.5 sur 5 étoiles4.5/5 (2)
- Le secret des cellules immunitaires - Théorie bouleversant l'Immunologie: The secrecy of immune cells - Theory upsetting ImmunologyD'EverandLe secret des cellules immunitaires - Théorie bouleversant l'Immunologie: The secrecy of immune cells - Theory upsetting ImmunologyÉvaluation : 1.5 sur 5 étoiles1.5/5 (2)
- La Yogathérapie pour les maladies auto-immunesD'EverandLa Yogathérapie pour les maladies auto-immunesÉvaluation : 5 sur 5 étoiles5/5 (1)
- Autisme - La boîte à outils: Stratégies et techniques pour accompagner un enfant autisteD'EverandAutisme - La boîte à outils: Stratégies et techniques pour accompagner un enfant autistePas encore d'évaluation
- Troubles Bipolaires: Mieux les connaître pour mieux se débarrasser de ces souffrancesD'EverandTroubles Bipolaires: Mieux les connaître pour mieux se débarrasser de ces souffrancesÉvaluation : 4.5 sur 5 étoiles4.5/5 (3)
- Atlas de neuroanatomie fonctionnelle: Première édition françaiseD'EverandAtlas de neuroanatomie fonctionnelle: Première édition françaisePas encore d'évaluation
- Comment atténuer ses crises d’angoisse et son anxiété puis s’en affranchirD'EverandComment atténuer ses crises d’angoisse et son anxiété puis s’en affranchirPas encore d'évaluation
- Comment j'ai vaincu le syndrome des jambes sans reposD'EverandComment j'ai vaincu le syndrome des jambes sans reposPas encore d'évaluation
- Guide pratique des médecines naturelles pour l’étéD'EverandGuide pratique des médecines naturelles pour l’étéÉvaluation : 2 sur 5 étoiles2/5 (1)