Académique Documents
Professionnel Documents
Culture Documents
Acide Benzoique
Transféré par
Jonas lumbuTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Acide Benzoique
Transféré par
Jonas lumbuDroits d'auteur :
Formats disponibles
Synthèse d’un acide carboxylique : l’acide benzoïque
Document 1 : L’acide benzoïque
L’acide benzoïque C6H5COOH et l’ion benzoate C6H5COO- sont utilisés dans l’industrie comme conservateurs alimentaires pour leurs
propriétés fongicides et antibactériennes. L’acide benzoïque est présent en particulier dans de nombreuses boissons gazeuses « light
», sous le code E 210. Ses effets sur l’organisme sont mal connus. Il est possible qu’il se fixe sur les protéines, comme beaucoup de
composés comportant un noyau benzoïque. Certains toxicologues le considèrent donc comme suspect.
L’acide benzoïque est produit industriellement par oxydation du toluène par le dioxygène en phase gazeuse, en présence de
catalyseurs.
Mention de danger : Conseils de prudence :
H302 (nocif en cas d’ingestion) P302 (éviter le contact avec la peau)
H319 (provoque une sérieuse irritation des yeux)
Acide benzoïque : O Ion benzoate : O
-
OH O
Un acide (AH) est une espèce chimique capable de céder un ion hydrogène H+(aq) : AH = A- + H+
A- est sa base conjuguée. L’acide et sa base forment un couple acide/base.
Une base (A-) est une espèce chimique capable de capter un ion hydrogène H+(aq) : A- + H+ = AH
Ainsi lorsque l’on dissout un acide dans l’eau, il libère des ions hydrogène et rend le milieu acide et si on dissout une base dans l’eau,
celle-ci capte les ions hydrogènes et rend le milieu basique.
L'acide benzoïque (AH) et l’ion benzoate (A-) constituent un couple acide/base.
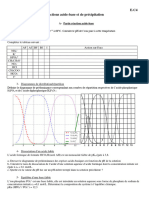
L’acide benzoïque est dit « faible » : dans une solution aqueuse il réagit avec l’eau et
selon le pH de la solution la forme acide ou basique prédomine :
L’acide benzoïque fait aussi parti d’un couple Ox/red : acide benzoïque/alcool benzylique
C6H5-COOH C6H5-CH2OH
O
OH
OH
Document 2 : Autres couples acide/base :
L’ion carbonate CO32-(aq) est la base du couple HCO3-(aq)/CO32-(aq) où HCO3-(aq) est l’acide.
Mais HCO3-(aq) est aussi la base du couple : CO2(aq)/HCO3-(aq). Selon le pH de la solution l’une ou l’autre forme prédomine :
S’il y a trop de dioxyde de carbone dissout, la solution est saturée et le gaz s’échappe sous forme de bulle de gaz.
L’acide chlorhydrique (HCl) est un acide fort. Dans l’eau il se trouve toujours sous forme d’ions H+(aq) et Cl-(aq).
Document 3: Autres données
M(g.mol-1) Tfusion (°C) Tébulition (°C) Solubilité dans l'eau Autres solvants
Acide benzoïque 68 g.L-1 à 95°C Soluble dans l'éthanol
122 122 249
3,4 g.L-1 à 20°C et l'éther
Benzoate de sodium
144 Très soluble
Alcool benzylique
108 205
(densité d = 1,04)
Permanganate de potassium : M(KMnO4) = 158 g.mol-1
L’ion permanganate : MnO4-(aq)
- Il donne une couleur violette aux solutions aqueuses.
- En milieu acide, l'ion permanganate se réduit en ion manganèse Mn2+ (incolore). Couple (Mn04-(aq)/Mn2+(aq))
- En milieu basique, l'ion permanganate se réduit en dioxyde de manganèse MnO 2.(solide brun très peu soluble dans
l'eau) Couple (Mn04-(aq)/MnO2(s)).
Ce travail est proposé par le Sgen-CFDT Midi-Pyrénées
I : Synthèse
Oxydation de l’alcool benzylique en acide benzoïque par l’ion permanganate en milieu basique.
L’oxydation est réalisée en milieu basique afin que la réduction du permanganate donne lieu à du dioxyde de
permanganate qui est un solide qui pourra être facilement séparé du mélange réactionnel par filtration.
Protocole expérimental pour la synthèse
(lire la fiche sur le montage à reflux : http://sgenmidipy.fr/WORDPRESS_ITRF/2020/05/15/montage-a-reflux/ )
- Verser dans le ballon: 500 mL d’eau, 10 g de carbonate de sodium Na2CO3(s), 22,5 g de permanganate de potassium.
- Ajouter goutte à goutte, tout en agitant, 10,0 mL d’alcool benzylique.
- Ajouter de la pierre ponce.
- Chauffer à reflux pendant 20 minutes environ.
- Lorsqu’on arrête le chauffage, maintenir la circulation d’eau.
- S’il y a des ions permanganate en excès, la solution dans le ballon est violacée ; on peut réduire ces
ions en ajoutant de l’éthanol. Ajouter 100 mL d’éthanol dans le ballon et agiter.
- Refroidir le ballon à l’air, puis sous l’eau du robinet.
Questions :
1. Recopier et légender le montage de chauffage à reflux. Quel est l’intérêt d’un tel montage ?
2. Quel est le rôle de la pierre ponce ?
3. Quel est le rôle du carbonate de sodium dans l’eau ?
4. Lors de cette synthèse, les couples oxydant / réducteur mis en jeu sont :
MnO4-/MnO2 et C6H5COO-/C6H5CH2OH
Ecrire l’équation bilan de la réaction en milieu basique.
II : Isolement de l’acide benzoïque
(lire la fiche d’utilisation d’une filtration Büchner http://sgenmidipy.fr/WORDPRESS_ITRF/2020/05/15/buchner/ )
→ Prélever une partie du mélange réactionnel : le filtrer sur Büchner pour récupérer le filtrat dans lequel
l’ion benzoate est dissous. Le filtrat doit être limpide et quasi incolore.
1. Schématiser la filtration sur Büchner.
2. Quel est le rôle d’une filtration ? Quel est l’avantage de filtrer sur Büchner dans ce cas-là.
3. Préciser ce que contiennent le filtrat et le résidu.
4. Mesurer le pH du filtrat, quel est l’intérêt de travailler avec ce pH ?
→ Placer le filtrat obtenu dans de la glace pilée. Y verser 20 mL d’acide chlorhydrique concentré, en
utilisant des gants et des lunettes. Mesurer le pH.
5. Qu’observe-t-on ?
6. Quels sont les produits formés ? Justifier.
7. Quel est l’intérêt de la glace ?
→ Après avoir attendu quelques minutes, filtrer le mélange sur Büchner en rinçant le solide à l’eau glacée.
8. Quel composant veut-on récupérer ? Quel est l’avantage de filtrer sur Büchner dans ce cas-là ?
9. Pourquoi rince-t-on le produit ? Pourquoi à l’eau glacée ?
→ Récupérer ensuite le solide dans le bécher commun à toute la classe pour qu’il soit séché à l’étuve.
10. Proposer une température pour le séchage à l’étuve en justifiant.
11. Comment pourrait-on déterminer à quel moment le produit est sec.
Ce travail est proposé par le Sgen-CFDT Midi-Pyrénées
Partie 2 : Caractérisation du produit obtenu
I- Caractérisation de l’espèce synthétisée :
a) Mesure du point de fusion :
(lire la fiche d utilisation du banc kofler http://sgenmidipy.fr/WORDPRESS_ITRF/2020/05/16/le-banc-kofler/ )
b)
A l’aide d’un banc Köfler, relever le point de fusion des cristaux obtenus. Comparer avec la valeur théorique.
c) Chromatographie sur couche mince (CCM) :
(lire la fiche CCM http://sgenmidipy.fr/WORDPRESS_ITRF/2020/05/17/ccm/ )
Prélever quelques cristaux, les dissoudre dans 2 mL d’éther ; on obtient la solution S3.
Placer l’éluant au fond de la cuve à chromatographie et fermer la cuve.
Tracer une ligne de dépôt sur la plaque de silice et effectuer 3 dépôts à partir des solutions suivantes : S1. Alcool
benzylique dans de l’éther (produit de référence) ; S2 acide benzoïque dans l’éther (produit de référence) ; S3 cristaux
obtenus dissous dans de l’éther (Vérifier la qualité de vos dépôts à l’aide de la lampe UV).
Placer la plaque dans l’éluant sans faire de vagues !
Après élution, sécher la plaque et observer sous une lampe UV, entourer avec soin les taches obtenues.
1. Faire un schéma du chromatogramme obtenu
2. Calculer le rapport frontal de l’acide benzoïque dans cet éluant.
3. Les cristaux obtenus sont-ils purs ? Argumenter.
4. L’interprétation de votre chromatogramme est-il en accord avec la mesure du point de fusion ? Expliquer.
II- Rendement de la synthèse :
Quelle est la masse d’acide benzoïque théoriquement attendue ?
Si l’on obtient expérimentalement une masse d’acide benzoïque égale à 20 g, quelles sont les hypothèses que vous
pourriez lui formuler ? Pour chaque hypothèse, proposer ensuite la démarche expérimentale afin de vérifier cette
hypothèse.
Donner la définition, puis calculer le rendement de la synthèse en pourcentage.
Ce travail est proposé par le Sgen-CFDT Midi-Pyrénées
Vous aimerez peut-être aussi
- Conception D'un Système D'aide À La DécisionDocument58 pagesConception D'un Système D'aide À La Décisionbadr79Pas encore d'évaluation
- Sime RXDocument11 pagesSime RXIgnacio LopezPas encore d'évaluation
- 2015 Polynesie Exo3 Sujet MedicamentDocument4 pages2015 Polynesie Exo3 Sujet Medicamentl.mayerPas encore d'évaluation
- TP - Synthse de L Acide BenzoiqueDocument2 pagesTP - Synthse de L Acide BenzoiqueFounette Milka100% (1)
- Preparation de L'Alcool Benzylique Et de L'Acide Benzoique: I - PrincipeDocument4 pagesPreparation de L'Alcool Benzylique Et de L'Acide Benzoique: I - PrincipeEssemlali Abde SamadPas encore d'évaluation
- TP N°2: Séparation de L'acide Benzoique Et Du 2-Naphtol: ObjectifDocument3 pagesTP N°2: Séparation de L'acide Benzoique Et Du 2-Naphtol: ObjectifMebarka TimPas encore d'évaluation
- Synthèse Dun ConservateurDocument3 pagesSynthèse Dun Conservateurnguyen.htd42Pas encore d'évaluation
- TP Spe Chimie TP 3 Synthese Acide Benzoique Eleve PDFDocument6 pagesTP Spe Chimie TP 3 Synthese Acide Benzoique Eleve PDFMasterPas encore d'évaluation
- Chapitre 6 - Reactions Acido - BasiquesDocument3 pagesChapitre 6 - Reactions Acido - BasiquesFongar gamingPas encore d'évaluation
- AcidebenzoiqueDocument1 pageAcidebenzoiqueAchwak BelfadelPas encore d'évaluation
- TP Synthese Acide BenzoiqueDocument6 pagesTP Synthese Acide BenzoiqueUlysse HubertPas encore d'évaluation
- TP Chimie Des SolutionsDocument11 pagesTP Chimie Des SolutionsFatima Yahia100% (1)
- TP - 1 - Traitement EauxDocument4 pagesTP - 1 - Traitement Eauxnasa nasaPas encore d'évaluation
- Concours 2015 Chimie TPCDocument16 pagesConcours 2015 Chimie TPCchartiercapucinePas encore d'évaluation
- Chapitre Acide BaseDocument23 pagesChapitre Acide BaseFakoro Abdul Aziz Doumbia100% (1)
- PC GENE SUJET 036 Exo2 Chi CamphreTigreDocument5 pagesPC GENE SUJET 036 Exo2 Chi CamphreTigreElias AthanassiadisPas encore d'évaluation
- SYNTHeSE DU SAVONDocument5 pagesSYNTHeSE DU SAVONkwamePas encore d'évaluation
- Couple Acide Base PDFDocument10 pagesCouple Acide Base PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Chimyaeaa 3 AedadzDocument66 pagesChimyaeaa 3 Aedadzsoufyane el ouahabiPas encore d'évaluation
- Synthèse de L'arôme de JASMIN CORRECTIONDocument5 pagesSynthèse de L'arôme de JASMIN CORRECTIONMOHAMMEDI AYMANPas encore d'évaluation
- C7 Cours T°S Acide Faible Base Faible Couple Acide Base Et Constante D AciditéDocument11 pagesC7 Cours T°S Acide Faible Base Faible Couple Acide Base Et Constante D AciditéBabacar NdiayePas encore d'évaluation
- E 99 P 471Document17 pagesE 99 P 471Ihsan MokhlissePas encore d'évaluation
- L'éthanolDocument4 pagesL'éthanolXray34Pas encore d'évaluation
- ChimieDocument4 pagesChimieWilfried ApianePas encore d'évaluation
- LC13 - Acides Et Bases (Lycée) : Niveau: TS BibliographieDocument13 pagesLC13 - Acides Et Bases (Lycée) : Niveau: TS BibliographieDiallo SafaiouPas encore d'évaluation
- 2022 Polynesie J1 Exo1 Sujet SyntheseEsterFloral 10ptsDocument6 pages2022 Polynesie J1 Exo1 Sujet SyntheseEsterFloral 10ptsemmanuel.tracePas encore d'évaluation
- TD2 Chimie en Solution 2021-1Document6 pagesTD2 Chimie en Solution 2021-1chairimanal017Pas encore d'évaluation
- La Reaction Chimique Exercices Non CorrigesDocument1 pageLa Reaction Chimique Exercices Non CorrigesSara EcheradiPas encore d'évaluation
- Examen Final 2009Document13 pagesExamen Final 2009Malika BENHAMADAPas encore d'évaluation
- 6.reaction AcidobasiqueDocument20 pages6.reaction AcidobasiqueDim LifyPas encore d'évaluation
- Synthèse AcideDocument3 pagesSynthèse Acidemohamed.mohamed-aminePas encore d'évaluation
- Chapitre - 1 Les Acides Et Les BasesDocument14 pagesChapitre - 1 Les Acides Et Les Baseseduardo3000Pas encore d'évaluation
- 13 SavonsDocument5 pages13 SavonsChartier Julien67% (3)
- BP 8 B FJTDG ERl DK Er UCtjDocument12 pagesBP 8 B FJTDG ERl DK Er UCtjIvan AdouPas encore d'évaluation
- Chimie en Solution PDFDocument27 pagesChimie en Solution PDFKhalid Zeg0% (1)
- TP MiniralDocument11 pagesTP MiniralAymene Salah Bendrihem100% (2)
- Chromatographie Sur Colonne Echangeuse D PDFDocument5 pagesChromatographie Sur Colonne Echangeuse D PDFمحمد دودو100% (3)
- 2nd C - C10 Solutions Acides Et Basiques. Mesure de PHDocument11 pages2nd C - C10 Solutions Acides Et Basiques. Mesure de PHSofien Zarrouki100% (1)
- Baccalaur at Technologique 2023 - S Rie STL - Sciences Physiques Et Chimiques en Laboratoire 154766Document20 pagesBaccalaur at Technologique 2023 - S Rie STL - Sciences Physiques Et Chimiques en Laboratoire 154766hounachayma02Pas encore d'évaluation
- BAC 2022 Spécialité Physique-Chimie Polynésie - Jour 1Document18 pagesBAC 2022 Spécialité Physique-Chimie Polynésie - Jour 1LETUDIANTPas encore d'évaluation
- CHM101 A20 Labo3 (Carbonates)Document4 pagesCHM101 A20 Labo3 (Carbonates)dimaPas encore d'évaluation
- Les Reactions Acido Basiques Cours 3Document4 pagesLes Reactions Acido Basiques Cours 3Brahimi AssalaPas encore d'évaluation
- Acides Et Bases en Solution AqueuseDocument6 pagesAcides Et Bases en Solution Aqueusemaster chimiePas encore d'évaluation
- Détermination Du Degré Alcoolique Dun Vin DépinesDocument4 pagesDétermination Du Degré Alcoolique Dun Vin DépinesDina DalilPas encore d'évaluation
- TP AciditetotalevinDocument2 pagesTP AciditetotalevinNassimaPas encore d'évaluation
- 18-Devoir de Vacances - Chimie 1S - TSDocument4 pages18-Devoir de Vacances - Chimie 1S - TSHussein AbdallahPas encore d'évaluation
- 2016 AmSud Exo2 Sujet Benzaldehyde 9ptsDocument7 pages2016 AmSud Exo2 Sujet Benzaldehyde 9ptsRichad NaziralyPas encore d'évaluation
- Exo TDDocument8 pagesExo TDBassirou YacoubaPas encore d'évaluation
- Réaction de Cannizzaro: 1) IntroductionDocument4 pagesRéaction de Cannizzaro: 1) IntroductionMajd FagroudPas encore d'évaluation
- E.C4 - Réaction Acide Base Et de PrécipitationDocument4 pagesE.C4 - Réaction Acide Base Et de Précipitationnoamassin78Pas encore d'évaluation
- Cours Acides Carboxyliques Et DerivesDocument46 pagesCours Acides Carboxyliques Et Deriveswissal1111 blmPas encore d'évaluation
- Les Reactions Acido Basiques Cours 2Document2 pagesLes Reactions Acido Basiques Cours 2Brahimi AssalaPas encore d'évaluation
- 2022 Asie J2 ExoC Sujet DissolutionCoquille 5pts PDFDocument3 pages2022 Asie J2 ExoC Sujet DissolutionCoquille 5pts PDFsara msouigPas encore d'évaluation
- Le CoursDocument6 pagesLe Courskapalab108Pas encore d'évaluation
- Chimie PDFDocument52 pagesChimie PDFAlex Iliassou PokassaPas encore d'évaluation
- Chapitre I CorrectionDocument4 pagesChapitre I CorrectionNAVENDRAN AjananPas encore d'évaluation
- MPSI2 TD1 R Acido BasiqueDocument4 pagesMPSI2 TD1 R Acido Basiquehidamohamed326Pas encore d'évaluation
- ExtraitDocument9 pagesExtraitSteeven VillagePas encore d'évaluation
- Acide BenzoïqueDocument3 pagesAcide BenzoïqueAymen AdjissiPas encore d'évaluation
- 2003 Asie Sujet Exo1 Savon 4ptsDocument2 pages2003 Asie Sujet Exo1 Savon 4ptstrenteastonPas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Analyse Qualitative Et Quantitative de l'IBUPROFENE Dans Différentes FormulatioDocument108 pagesAnalyse Qualitative Et Quantitative de l'IBUPROFENE Dans Différentes FormulatioJonas lumbuPas encore d'évaluation
- Leszczak J P OCRDocument207 pagesLeszczak J P OCRJonas lumbuPas encore d'évaluation
- Copie de FACTURE PROFORMA Mardoché DistillationDocument3 pagesCopie de FACTURE PROFORMA Mardoché DistillationJonas lumbuPas encore d'évaluation
- Copie Pour EtudiantDocument114 pagesCopie Pour EtudiantJonas lumbuPas encore d'évaluation
- Memoire MUKALA CorrigéDocument54 pagesMemoire MUKALA CorrigéJonas lumbuPas encore d'évaluation
- MakalDocument58 pagesMakalJonas lumbuPas encore d'évaluation
- Les Polyol閒ines Actualit開Chimique Revision VfDocument19 pagesLes Polyol閒ines Actualit開Chimique Revision VfJonas lumbuPas encore d'évaluation
- Cours - L3 GP - Partie 1 - Simulateurs de Proc閐閟Document26 pagesCours - L3 GP - Partie 1 - Simulateurs de Proc閐閟Jonas lumbuPas encore d'évaluation
- B 9 000 000.vf3-SavDocument39 pagesB 9 000 000.vf3-SavJonas lumbuPas encore d'évaluation
- Extract Am3320 TechniquesDeLIngenieurDocument6 pagesExtract Am3320 TechniquesDeLIngenieurJonas lumbuPas encore d'évaluation
- Adriana 1Document16 pagesAdriana 1Jonas lumbuPas encore d'évaluation
- Gloire À L'éternel IIDocument11 pagesGloire À L'éternel IIJonas lumbuPas encore d'évaluation
- Chap 1 PhineDocument13 pagesChap 1 PhineJonas lumbuPas encore d'évaluation
- Dim 01 Culte 01Document4 pagesDim 01 Culte 01Jonas lumbuPas encore d'évaluation
- Fichier Suivi Du 30.03.2024Document152 pagesFichier Suivi Du 30.03.2024Jonas lumbuPas encore d'évaluation
- - - za - نسخة (3) - compressed - compressed - compressedDocument69 pages- - za - نسخة (3) - compressed - compressed - compressedJonas lumbuPas encore d'évaluation
- Discours de La Soutenance de MemoireDocument8 pagesDiscours de La Soutenance de MemoireJonas lumbuPas encore d'évaluation
- Cours de Compagnies Petrolieres NationalesDocument75 pagesCours de Compagnies Petrolieres NationalesJonas lumbuPas encore d'évaluation
- Interprétation BenDocument2 pagesInterprétation BenJonas lumbuPas encore d'évaluation
- TFC Chapitre IerDocument14 pagesTFC Chapitre IerJonas lumbuPas encore d'évaluation
- CHAPITRE 1,2 Et 3Document40 pagesCHAPITRE 1,2 Et 3Jonas lumbuPas encore d'évaluation
- Lettre de StageDocument1 pageLettre de StageJonas lumbu0% (1)
- Grace 3Document13 pagesGrace 3Jonas lumbuPas encore d'évaluation
- Syllabus Q.H.S.E IpgDocument108 pagesSyllabus Q.H.S.E IpgJonas lumbuPas encore d'évaluation
- Courrier Interpellation Perenco Juillet 2021 Final 003Document6 pagesCourrier Interpellation Perenco Juillet 2021 Final 003Jonas lumbuPas encore d'évaluation
- Manya 2Document11 pagesManya 2Jonas lumbuPas encore d'évaluation
- Cote D'analyse Des Produits PétrolierDocument1 pageCote D'analyse Des Produits PétrolierJonas lumbuPas encore d'évaluation
- MDMB03Document4 pagesMDMB03Jonas lumbuPas encore d'évaluation
- TD 1Document4 pagesTD 1Jonas lumbuPas encore d'évaluation
- Cours de Carbochimie Ipg KinDocument80 pagesCours de Carbochimie Ipg KinJonas lumbuPas encore d'évaluation
- Matrice Sous PythonDocument22 pagesMatrice Sous PythonStaphanie MelPas encore d'évaluation
- Bibliographie Section Cinema 2013Document32 pagesBibliographie Section Cinema 2013JoPas encore d'évaluation
- Les Modes Et Les TempsDocument4 pagesLes Modes Et Les TempsLaura MarcuPas encore d'évaluation
- DELMEEDocument164 pagesDELMEEDjam'sPas encore d'évaluation
- Luther Et Le Luthéranisme, FR Henri Denifle OP, T IVDocument486 pagesLuther Et Le Luthéranisme, FR Henri Denifle OP, T IVarchi01 ANDPas encore d'évaluation
- SOPAQDocument20 pagesSOPAQAli BouchakorPas encore d'évaluation
- Circulation Ocean Chap 1BDocument19 pagesCirculation Ocean Chap 1Bهند العمرانيPas encore d'évaluation
- Mlle. KOUASSI Amoin Ella CorineDocument118 pagesMlle. KOUASSI Amoin Ella CorineAdjoua NakePas encore d'évaluation
- php37D9 TMPDocument2 pagesphp37D9 TMPkrishnan1159Pas encore d'évaluation
- Série Révision Bac 2020 1 PDFDocument5 pagesSérie Révision Bac 2020 1 PDFSam EhPas encore d'évaluation
- Chute Libre Verticale D Un Solide Exercices Non Corriges 4Document5 pagesChute Libre Verticale D Un Solide Exercices Non Corriges 4S Bouhmid100% (1)
- Tumeurs de La VessieDocument30 pagesTumeurs de La Vessieمحمد أمين دريسيPas encore d'évaluation
- TP de Pétrographie Séance 2Document10 pagesTP de Pétrographie Séance 2sumaleePas encore d'évaluation
- Isara RDocument44 pagesIsara RAymeric CharonnatPas encore d'évaluation
- LM Leclerc AoutDocument8 pagesLM Leclerc AoutTitouan BltPas encore d'évaluation
- Oscillations Mécaniques ForcéesDocument4 pagesOscillations Mécaniques ForcéesBryce Ingram100% (1)
- MemoireDocument175 pagesMemoireAbdelkader SakiniPas encore d'évaluation
- Memoire M2 ABADA B. 2020Document54 pagesMemoire M2 ABADA B. 2020OUSSAMA BEN OMARPas encore d'évaluation
- N4 CE Int-01 AppDocument7 pagesN4 CE Int-01 AppiancasilimasqPas encore d'évaluation
- Accidents D'évolution Des Dents de SagesseDocument2 pagesAccidents D'évolution Des Dents de Sagessesalmasalhi1994Pas encore d'évaluation
- El MarinoDocument4 pagesEl MarinoZaki CitizenPas encore d'évaluation
- SMQ LEONI MPQT Groupe 5Document41 pagesSMQ LEONI MPQT Groupe 5sokaina elgasmiPas encore d'évaluation
- 6 6857 581702f3 PDFDocument22 pages6 6857 581702f3 PDFSAEC LIBERTEPas encore d'évaluation
- Eco Orga EntreprisesDocument134 pagesEco Orga EntreprisesAsseman KacouPas encore d'évaluation
- G N Tique Foresti Re Et Am Lioration Des Arbres Forestiers Premi Re PartieDocument41 pagesG N Tique Foresti Re Et Am Lioration Des Arbres Forestiers Premi Re Partiekhaoula yaakoubiPas encore d'évaluation
- I - Compréhension de L'écritDocument2 pagesI - Compréhension de L'écritELasri Mohammed Ben MansourPas encore d'évaluation
- Main Rela 2019Document50 pagesMain Rela 2019authenticgolden3Pas encore d'évaluation
- BulletinDocument8 pagesBulletintalainiPas encore d'évaluation