Académique Documents
Professionnel Documents
Culture Documents
PC T ch1 Bilan
Transféré par
Zeyn NdTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
PC T ch1 Bilan
Transféré par
Zeyn NdDroits d'auteur :
Formats disponibles
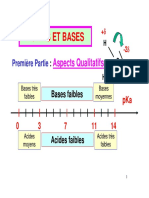
BILAN - PHYSIQUE-CHIMIE TERMINALE
Notions d’acide et de base
Capteur
Donneur de proton
de proton Perte d’un proton
Acide Base + H+
Gain d’un proton
Proton
Couple avec l’acide citrique :
C 6 H 8 O 7 (aq) /C 6 H 7 O -7 (aq)
› Notation du couple : Acide/Base
› Espèce amphotère : espèce qui possède à la fois des propriétés acides et basiques
› Réaction acide-base : transfert d’ion H+ entre l’acide d’un couple et la base d’un autre couple :
Acide1 / Base1
Acide1 + Base2 Base1 + Acide2
Acide2 / Base2
Lien entre acidité et pH Acides carboxyliques et amines
En solution aqueuse : Acide carboxylique/Ion carboxylate
[H O+]
pH = -log d c3 ° n et [H3O+] = c° · 10-pH O O
Solution R C R C
Solution -
Solution neutre O H O
basique 14
0 acide 7 d- d +
pH Ion ammonium tertiaire/Amine
[H3O+] H
(mol·L-1) R1 N R3
100 10-7 10 -14
R1 R3
+
N
R2
R2
Éléments essentiels de la modélisation et limites
Ce modèle permet de : Mais il ne permet pas de :
y prévoir le caractère acide ou basique d’une espèce ; y savoir si une transformation acide-base possible a
y prévoir si une transformation acide-base peut avoir vraiment lieu ou non ;
lieu et établir l’équation de cette réaction ; y savoir si un acide réagit plus fortement ou non qu’un
y calculer [H3O ] connaissant le pH et réciproquement
+ autre.
pour des solutions de concentration inférieure à
0,1 mol·L-1.
26 LLS.fr/PCTP26
Vous aimerez peut-être aussi
- Résumé 2 Chimie Des SolutionsDocument2 pagesRésumé 2 Chimie Des SolutionsLoubna El JehouariPas encore d'évaluation
- AciditeDocument9 pagesAciditejranluPas encore d'évaluation
- Chap I-3 CSDocument11 pagesChap I-3 CSSimo MaroPas encore d'évaluation
- Chimie Des Solutions AqueusesDocument29 pagesChimie Des Solutions AqueusesJean-Loïc BauchetPas encore d'évaluation
- Signet Fonctions OrganiquesDocument1 pageSignet Fonctions OrganiquesSab 433Pas encore d'évaluation
- A Equilibres Acide Base Power PDFDocument57 pagesA Equilibres Acide Base Power PDFmenin noorPas encore d'évaluation
- CH6 Transformation Acide - BaseDocument4 pagesCH6 Transformation Acide - BaseYasminaPas encore d'évaluation
- AB Poly ElevesDocument14 pagesAB Poly Eleveslaprimelion0Pas encore d'évaluation
- CHAPITRE I - Chimie en SolutionDocument3 pagesCHAPITRE I - Chimie en SolutionNikabou Napo TCHANDIKOUPas encore d'évaluation
- Chapitre 6 - Reactions Acido - BasiquesDocument3 pagesChapitre 6 - Reactions Acido - BasiquesFongar gamingPas encore d'évaluation
- 6129e58c389fecouple Acide Base Classification Chimie TerminaleDocument6 pages6129e58c389fecouple Acide Base Classification Chimie TerminalePrince Informaticien GamesPas encore d'évaluation
- CH Gene Cours Chimie en SolutionDocument41 pagesCH Gene Cours Chimie en SolutionAlhassane BahPas encore d'évaluation
- Chapitre 2 PH Des Solutions Acides BasesDocument26 pagesChapitre 2 PH Des Solutions Acides BasesRottina RossyPas encore d'évaluation
- MMCh3 Les Réactions Acido-Basiques CoursDocument4 pagesMMCh3 Les Réactions Acido-Basiques CoursegozeelowPas encore d'évaluation
- Cours Le PH d' Une SolutionDocument5 pagesCours Le PH d' Une SolutionTom AndlerPas encore d'évaluation
- Chap 2 Les Acides Et Les BasesDocument4 pagesChap 2 Les Acides Et Les BasessaliPas encore d'évaluation
- Les Reactions Acido Basiques Resume de CoursDocument2 pagesLes Reactions Acido Basiques Resume de CoursMahfoud NatsuPas encore d'évaluation
- Equilibre Acide Base Fiche CoursDocument2 pagesEquilibre Acide Base Fiche CoursArchange StevithPas encore d'évaluation
- Chapitre 5 Les AlcoolsDocument7 pagesChapitre 5 Les AlcoolsBeatrice Florin100% (6)
- Test en Ligne Acide-BaseDocument16 pagesTest en Ligne Acide-BaseNesrine DibPas encore d'évaluation
- Chimie - Chapitre 7: Equilibre Acido-Basique en Solution Aqueuse Ce Qu'il Faut RetenirDocument2 pagesChimie - Chapitre 7: Equilibre Acido-Basique en Solution Aqueuse Ce Qu'il Faut RetenirOussama ElfaqyrPas encore d'évaluation
- COURSDocument10 pagesCOURSMohammed TahriPas encore d'évaluation
- Cours - Chimie - Dosage - Acide - Base - Bac Toutes Sections (2019-2020) MR Sfaxi SalahDocument3 pagesCours - Chimie - Dosage - Acide - Base - Bac Toutes Sections (2019-2020) MR Sfaxi Salahgzqg9cp7mtPas encore d'évaluation
- Série 4Document5 pagesSérie 4gaboPas encore d'évaluation
- Doc1 CarboxylesDocument4 pagesDoc1 CarboxylesDominique LoeuilletPas encore d'évaluation
- Séance 9Document13 pagesSéance 9SantamitoPas encore d'évaluation
- Tab 3Document11 pagesTab 3deziri mohamedPas encore d'évaluation
- Calcul Du PH D'une Solution AqueuseDocument5 pagesCalcul Du PH D'une Solution AqueuseJean-Loïc BauchetPas encore d'évaluation
- Chapitre 6 Aldéhydes Et CétonesDocument7 pagesChapitre 6 Aldéhydes Et CétonesBeatrice Florin100% (8)
- CS Ensa 2020-21Document103 pagesCS Ensa 2020-213freefire 3gamePas encore d'évaluation
- ERC 18 Chapitre 7CDocument10 pagesERC 18 Chapitre 7CALPHA ROMEOPas encore d'évaluation
- Acide Base FicheDocument2 pagesAcide Base FicheAnis LekhalPas encore d'évaluation
- Calcul Du PH Des Solutions AqueusesDocument5 pagesCalcul Du PH Des Solutions AqueusesHassen JinyorPas encore d'évaluation
- Reactions Acide BaseDocument14 pagesReactions Acide BaseDjonba PaguerePas encore d'évaluation
- Acide BaseDocument35 pagesAcide BaseKhoudia Sy CamaraPas encore d'évaluation
- Polycopie de CG S2 2011Document62 pagesPolycopie de CG S2 2011Dobl JokPas encore d'évaluation
- # 02 Cours Chap 1 Réactions Acide-Base ProfDocument2 pages# 02 Cours Chap 1 Réactions Acide-Base ProfLouisPas encore d'évaluation
- 4 - Metabolisme Des NucleotidesDocument9 pages4 - Metabolisme Des NucleotidesAnani Jacques YaoPas encore d'évaluation
- Fiche Synthese Ue3 Biophysique Ph-70255Document2 pagesFiche Synthese Ue3 Biophysique Ph-70255janahammoud499Pas encore d'évaluation
- Reactions Acido Basiques ExercicesDocument3 pagesReactions Acido Basiques ExercicesZineb ZahimPas encore d'évaluation
- PH Et SolubilitéDocument34 pagesPH Et SolubilitésafemindPas encore d'évaluation
- Série 3: Acides Et BasesDocument30 pagesSérie 3: Acides Et BaseschakiircherfPas encore d'évaluation
- COURS PH DES SOLUTIONS AQUEUSES HADJ ALI BOUZIDDocument6 pagesCOURS PH DES SOLUTIONS AQUEUSES HADJ ALI BOUZIDMohamed Helmi Chebbi100% (5)
- Cours Chim 7Document2 pagesCours Chim 7Yasmina BenPas encore d'évaluation
- Cours Acide BaseDocument14 pagesCours Acide BaseAli AllamPas encore d'évaluation
- Chapitre - 1 Les Acides Et Les BasesDocument14 pagesChapitre - 1 Les Acides Et Les Baseseduardo3000Pas encore d'évaluation
- Chap 2, AlcènesDocument8 pagesChap 2, AlcènesChTri LyricsPas encore d'évaluation
- 6-Les Équilibres Acido-BasiquesDocument50 pages6-Les Équilibres Acido-BasiqueslilybarachantPas encore d'évaluation
- Chap1 Acides Et Bases Avec ExosDocument16 pagesChap1 Acides Et Bases Avec Exosperekamela33Pas encore d'évaluation
- S11 - Force Des Acides Et Des BasesDocument5 pagesS11 - Force Des Acides Et Des BasessocranedeoufPas encore d'évaluation
- TD 9 AB I CorrecDocument4 pagesTD 9 AB I CorrecSoukainaBenBoualamPas encore d'évaluation
- Reactivité Chimique - Chapitre 2Document69 pagesReactivité Chimique - Chapitre 2abraham LincolnPas encore d'évaluation
- Reactions Acide-BaseDocument8 pagesReactions Acide-BaseMahmoud GazzahPas encore d'évaluation
- Les Reactions Acido Basiques Cours 2Document2 pagesLes Reactions Acido Basiques Cours 2Brahimi AssalaPas encore d'évaluation
- Cours EtudiantDocument8 pagesCours EtudiantJeremie MangoumbaPas encore d'évaluation
- Les AlcoolsDocument4 pagesLes AlcoolsADJEPas encore d'évaluation
- Carte Mentale Chap1Document1 pageCarte Mentale Chap1im.victoiresonPas encore d'évaluation
- Cours III Acides - Bases-A. BENAMARDocument60 pagesCours III Acides - Bases-A. BENAMARMed Seghir YounesPas encore d'évaluation
- Les Bétons À Hautes Performances (BHP) - Le Guide de La MaçonnerieDocument9 pagesLes Bétons À Hautes Performances (BHP) - Le Guide de La MaçonnerieAdouPas encore d'évaluation
- Etude Expérimentale D'un Capteur Solaire Plan À Air: Réalisé ParDocument71 pagesEtude Expérimentale D'un Capteur Solaire Plan À Air: Réalisé ParISSOUSSI fatima ezzahraPas encore d'évaluation
- SMP-S6-Outils Math Et Logiciels-TD3-SolutionDocument6 pagesSMP-S6-Outils Math Et Logiciels-TD3-SolutionRABAB MASDOURPas encore d'évaluation
- Eurofloor Expo ProDocument3 pagesEurofloor Expo ProNoussa NesPas encore d'évaluation
- Serre Autonome Connecteev2Document59 pagesSerre Autonome Connecteev2AMEL REBBOUCHEPas encore d'évaluation
- Notes D'hypothèses.Document12 pagesNotes D'hypothèses.Quentin BindziPas encore d'évaluation
- Dimensionnement Des Compensateurs de L'énergie RéactiveDocument52 pagesDimensionnement Des Compensateurs de L'énergie RéactiveybePas encore d'évaluation
- MecafluDocument81 pagesMecafluJamel Gasmi100% (1)
- Chapitre IV ForageDocument12 pagesChapitre IV ForageZakaria Ghrissi alouiPas encore d'évaluation
- Cours-MMC-CHAPITRE 1 Tenseur de Contrainte Parties I Et IIDocument38 pagesCours-MMC-CHAPITRE 1 Tenseur de Contrainte Parties I Et IIAxel BekaertPas encore d'évaluation
- Note de Calcul Charpente BoisDocument25 pagesNote de Calcul Charpente BoisBeta-Pi ExpertsPas encore d'évaluation
- Cours Generalites Sur Les Fonctions Et ApplicationDocument23 pagesCours Generalites Sur Les Fonctions Et ApplicationAllou Antoine KouassiPas encore d'évaluation
- Variations Extremumsb1Document3 pagesVariations Extremumsb1maeva.raderaPas encore d'évaluation
- TP DRDocument30 pagesTP DRBoris GanmavoPas encore d'évaluation
- TD N°3 em 2 18-19Document3 pagesTD N°3 em 2 18-19Shekina Évangile MABIALAPas encore d'évaluation
- Cours 4 Polarisation de La LumièreDocument59 pagesCours 4 Polarisation de La LumièreadamPas encore d'évaluation
- 329 PDFDocument42 pages329 PDFSlimane HamidouPas encore d'évaluation
- Devoir de Contrôle N°1 2011 2012 (Abdellatif Heni)Document8 pagesDevoir de Contrôle N°1 2011 2012 (Abdellatif Heni)ayoub dably0% (1)
- Chap. 16-La Lumière, Un Flux de PhotonsDocument2 pagesChap. 16-La Lumière, Un Flux de PhotonsBénédicte & Christophe MULLERPas encore d'évaluation
- Electrique FordDocument50 pagesElectrique Fordoussama zemziPas encore d'évaluation
- Turbines À VapeurDocument46 pagesTurbines À Vapeuryfzysgfikfr100% (2)
- Des Métiers Le Fermier - Le Médecin - Le Pompier - Le Cuisinier - Le Tailleur - Le Menuisier Madrassati ComDocument6 pagesDes Métiers Le Fermier - Le Médecin - Le Pompier - Le Cuisinier - Le Tailleur - Le Menuisier Madrassati ComAhmed Amine MoussaouiPas encore d'évaluation
- CGS 2005 - WahabdiopDocument11 pagesCGS 2005 - WahabdiopAwa WadePas encore d'évaluation
- Derivee D Une Fonction Cours de Maths en 1ere A Telecharger en PDFDocument4 pagesDerivee D Une Fonction Cours de Maths en 1ere A Telecharger en PDFWilliam PouokamPas encore d'évaluation
- EA TP 2Document9 pagesEA TP 2Hanae MenounyPas encore d'évaluation
- Cavitation - WikipédiaDocument59 pagesCavitation - WikipédiaAnime forever 2016100% (1)
- Différences Entre Un Calcul Statique Linéaire Et Non LinéaireDocument2 pagesDifférences Entre Un Calcul Statique Linéaire Et Non LinéairedagbaPas encore d'évaluation
- Series Numeriques ExercicesDocument2 pagesSeries Numeriques ExercicesomarPas encore d'évaluation
- TD 2 Mip - Mipc 2020Document2 pagesTD 2 Mip - Mipc 2020HEBATONPas encore d'évaluation
- Oeuvres 7 Activation EnergieDocument352 pagesOeuvres 7 Activation Energiegarry deroy100% (1)