Académique Documents
Professionnel Documents
Culture Documents
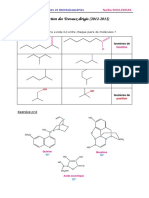
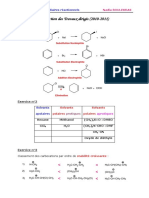
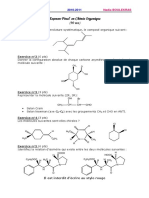
SN2 Ou SN1
SN2 Ou SN1
Transféré par
Karla RoseTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
SN2 Ou SN1
SN2 Ou SN1
Transféré par
Karla RoseDroits d'auteur :
Formats disponibles
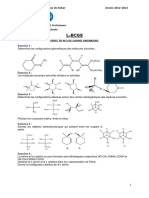
Corrigé exercice 24
SN 2 OU SN 1 ?
1) Formation d’ester par substitution nucléophile
Structure du (S)-2-bromobutane :
2
C2H5
1
Br
4 H
H3C
3
Cet halogénoalcane est secondaire : il peut donc a priori donner lieu aux mécanismes SN 1 et SN 2 selon
les conditions (on n’envisage ici que les substitutions ainsi que le précise l’énoncé).
a) L’acide méthanoïque est un très mauvais nucléophile, parce qu’il est neutre et qu’un atome
d’oxygène est peu polarisable. Les acides carboxyliques sont en outre fortement liés par des liaisons
hydrogène (rappel de la bande O − H extrêmement large en IR). De plus, c’est également le solvant, et
il est polaire et protique : il favorise donc la formation du carbocation en solvatant les ions,
notamment l’anion par liaisons hydrogène. Le mécanisme le plus rapide est donc SN 1 :
C2H5 + C2H5
acide
Br H + Br
H mÈthanoÔque
H3C méthanoïque CH3
carbocation plan
OH
+ CH3
C H H S
O C2H5
attaque C2H5 O
+ ou
sur l'une H H C O
ou l'autre CH3 R C2H5 +C H
O H H
face CH3
50% 50% OH
Le mécanisme SN 1 n’est pas stéréospécifique : il conduit à une racémisation, c’est-à-dire qu’on obtient
deux produits énantiomères en proportion 1:1. Ceci est dû au fait que l’intermédiaire réactionnel est
un carbocation plan. On aurait obtenu le même mélange racémique si on était parti du (R)-2-
bromobutane.
Le solvant est ici aussi le réactif : la réaction s’appelle une solvolyse.
Le mécanisme précédent est, en outre, complété par une étape de déprotonation :
+ O H +
O + H
H C
H C
O CH(CH3)(C2H5)
O CH(CH3)(C2H5)
ester final
ester final
racÈmique
racémique
b) L’ion méthanoate, base conjuguée de l’acide méthanoïque, est un assez bon nucléophile. De
plus, le solvant est le DMSO (diméthylsulfoxyde), c’est-à-dire un solvant polaire et aprotique, très
favorable au mécanisme SN 2 car il ne forme pas de liaison hydrogène avec le nucléophile.
Chimie organique Exercice 24 Page 1 sur 7
Le mécanisme qui se produit est donc le mécanisme SN 2 :
O C2H5 O 2 +
H Br H C2H5 Br
H S
O H3C O
_ 1R H4
CH
3 3
En raison de l’inversion de Walden, on a inversion de configuration du carbone asymétrique. En
examinant les ordres de priorité dans le produit, on détermine qu’on obtient exclusivement l’ester R. Si
on était parti du (R)-2-bromobutane, on aurait obtenu exclusivement l’ester S : le mécanisme SN 2 est
stéréospécifique.
2) Influence de la nature du substrat sur la vitesse du mécanisme SN 𝟏
Un mélange d’eau et d’acétone ne contient pas de nucléophile suffisamment bon pour envisager un
mécanisme SN 2. Par contre, c’est un mélange de deux solvants très polaires et très dissociants, dont
l’un, l’eau, est protique. C’est donc un milieu très favorable à l’apparition de carbocations.
Pour chacun des substrats proposés, la réaction conduit à substituer le chlore par un groupe OH, selon
le mécanisme SN 1, suivi d’une déprotonnation :
i) RCl → R" + Cl#
ii) R" + H$ O → ROH$"
iii) ROH$" → ROH + H"
Les étapes ii) et iii) sont très faciles par rapport à i), qui est l’étape cinétiquement déterminante. C’est
donc sur cette étape, qui consiste en la formation du carbocation, qu’il faut raisonner pour discuter de
la vitesse globale du mécanisme.
On rappelle ci-dessus l’allure du profil énergétique de cette première étape. Un carbocation étant
instable, il est situé haut en énergie par rapport aux réactifs. L’état de transition y est tardif, les études
montrent que l’énergie du complexe activé est peu différente de celle du carbocation.
L’application du postulat de Hammond permet d’affirmer que la structure du complexe activé est
quasiment celle du carbocation. Ainsi, plus le carbocation est stable, plus le complexe activé qui y
mène est stable également, et plus la réaction est rapide.
𝐸% complexe activé, quasiment identique à R" + Cl#
R" + Cl#
RCl
coordonnée de réaction
Pour résoudre l’exercice, on écrit donc pour chaque cas les deux carbocations et on regarde lequel est
le plus stable.
Chimie organique Exercice 24 Page 2 sur 7
a)
+ +
+ Cl
Cl
1-chlorobut-2-ène
1-chlorobut-2-Ëne
Cl
+ + Cl
2-chlorobut-1-Ëne
2-chlorobut-1-ène
Le carbocation issu du 1-chlorobut-2-ène est stabilisé par mésomérie (situation lacune/sigma/pi), ce
qui montre que la charge positive est délocalisée sur deux atomes, donc moins réactive.
On ne peut pas écrire de formule mésomère raisonnable sur le carbocation issu du 2-chlorobut-1-ène
qui est donc bien moins stable que le premier.
C’est donc le 1-chlorobut-2-ène qui réagit le plus vite selon un mécanisme SN 1 ou E1.
b)
+
Cl + Cl
+ +
Cl
+ 88 autres
autres
Cl formules
formules
mésomères
mÈsomËres
Les deux carbocations sont tertiaires, mais le second est fortement stabilisé par mésomérie, car il
existe dix formules mésomères ! La charge + est délocalisée sur 10 atomes de carbone, ce qui confère
une stabilité exceptionnelle à ce carbocation.
Rappel : Repérez immédiatement les possibilités de carbocations au pied des groupes phényle. Ils sont
fortement stabilisés par mésomérie car la charge + est délocalisée sur trois atomes du cycle.
c) Un atome possédant des doublets libres et situé à une liaison d’un carbocation peut également
stabiliser celui-ci par mésomérie, comme on le voit dans le deuxième cas ci-après (situation
nl/sigma/lacune). La deuxième formule mésomère que l’on peut écrire fait certes apparaître la charge
+ sur l’atome le plus électronégatif, mais elle permet de respecter la règle de l’octet sur tous les
atomes. Elle est donc également très représentative de l’ion.
Chimie organique Exercice 24 Page 3 sur 7
O O + Cl
Cl +
hautement instable
O +
O O + Cl
Cl +
Notez que le premier carbocation est particulièrement instable : il est inconcevable de le voir se
former à une vitesse raisonnable. En effet, non seulement il est primaire, mais de plus il est déstabilisé
par l’effet inductif attracteur de l’oxygène à proximité. En effet, l’oxygène électronégatif tend à attirer
à lui de la densité électronique, ce qui renforce encore la charge + au niveau du carbone.
Dans le deuxième carbocation, cet effet existe également, mais il est largement compensé par l’effet
mésomère donneur de l’oxygène, qui permet de délocaliser la charge positive.
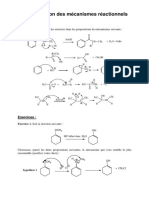
3) Profils énergétiques
a) L’halogénoalcane est tertiaire, ce qui exclut un mécanisme SN 2 ; la triphénylphosphine est une
base très faible, ce qui exclut que l’élimination par mécanisme E2 soit rapide. Un carbocation tertiaire
étant relativement stable, le mécanisme est donc SN 1 (ou E1), donc constitué de deux étapes dont la
première est e.c.d. : c’est le profil n°3.
F : (CH& )& C" + Cl# + Ph& P
H : (CH& )& CPPh" #
& + Cl .
E et G sont des complexes activés.
b) Halogénoalcane secondaire avec très bon nucléophile (ion Br # ) très faiblement basique :
mécanisme SN 2 sans ambiguïté. Il y a donc une seule étape. Les profils 1 et 2 conviennent a priori.
c) On sait que pour substituer le groupe OH d’un alcool, il doit être préalablement protonné : la
première étape est donc la protonnation de l’alcool, difficile (il faut une concentration importante
d’acide). Puis le mécanisme SN 1 peut avoir lieu, en deux étapes : c’est le profil n°4.
J : (CH& )& COH$" + Br #
L : (CH& )& C" + H$ O + Br #
N : (CH& )& CBr + H$ O
I, K et M sont des complexes activés.
d) Réaction de Williamson : le mécanisme est SN 2 car on a un très bon nucléophile et un
halogénoalcane primaire non encombré.
Le profil est donc le 1 ou le 2.
À la différence du b), la réaction n’est pas renversable car l’éther-oxyde n’a pas de bon groupe partant.
Le profil est donc le n°1.
On en déduit que le profil du b) est le n°2, la réaction du b) est renversable.
B : CH& CH$ OCH$ CH& + Na" + Br #
D : (CH& )$ CHBr + K " + I #
A et C sont les complexes activés des mécanismes SN 2 respectifs (inversion de Walden en cours de
réalisation).
4) Effets de solvant
a) Il est impossible de former le carbocation sans classe CH&" , bien trop instable. De plus, l’ion
iodure est un bon nucléophile. Le mécanisme est donc SN 2 sans ambiguïté :
_ _
+ H3C Br I CH3 + Br
I
Chimie organique Exercice 24 Page 4 sur 7
Loi de vitesse : Si on suppose la réaction non renversable (ce qui n’est probablement pas très pertinent
car Br # est aussi un bon nucléophile et I # un bon nucléofuge), le mécanisme étant constitué d’une
seule étape élémentaire, alors l’ordre est égale à la molécularité : 𝑣 = 𝑘[I # ][CH& Br].
Effets de solvants :
L’effet de solvatation le plus important étant la liaison hydrogène, on commence par identifier les
solvants protiques et aprotiques parmi les solvants proposés.
Solvants protiques : acide acétique, éthanol, éthane-1,2-diol et eau. Ils solvatent l’ion I # par liaison
hydrogène. Mais ils diffèrent par leur pouvoir dissociant (constante diélectrique 𝜖). Le nucléophile
étant anionique, il sera d’autant mieux solvaté que le solvant est polaire et dissociant. Le complexe
activé est également anionique, mais sa charge est plus diffuse car elle est répartie entre l’iode et le
brome : la stabilisation par solvatation est donc moins efficace qu’avec le nucléophile. On en déduit
que plus le solvant est polaire et dissociant, plus l’énergie d’activation est élevée, donc plus la réaction
est lente. : la nucléophilie diminue quand 𝜖 augmente.
On visualise ceci sur le profil énergétique de la réaction :
H
-d -d
𝐸% I C Br
H
H
solvant peu polaire/dissociant
solvant plus polaire/dissociant : solvate mieux le
nucléophile que le complexe activé
_
_
I Br
coordonnée de réaction
H3C Br I CH3
Solvant aprotique : l’acétone : l’acétone a une constante diélectrique voisine de celle de l’éthanol.
Pourtant, la nucléophilie de l’ion I # y est 200 fois meilleure ! Ceci est dû au fait que l’acétone est un
solvant aprotique. Elle solvate donc beaucoup moins l’ion I # que l’éthanol. On dit que l’acétone exalte
la nucléophilie de l’ion iodure.
b) Le substrat est CH& Nf " , où le nucléofuge Nf est le thioéther (CH& )$ S. Comme pour la question
précédente, le carbocation CH&" est inconcevable, et l’on fait agir de plus un bon nucléophile HO# : le
mécanisme est donc SN 2 sans ambiguïté.
_ CH3 CH3
+
H O
+ HC S
3
HO CH3 + S
CH3 CH3
#
Loi de vitesse : La réaction est non renversable car HO n’est pas un nucléofuge. Le mécanisme étant
constitué d’une seule étape élémentaire, alors l’ordre est égal à la molécularité : 𝑣 =
𝑘[HO# ][(CH& )& S" ]
Effets de solvant :
On voit que lorsque la proportion d’eau augmente par rapport à l’éthanol, la nucléophilie de HO#
chute. On retrouve le résultat de la question a), mais l’effet semble beaucoup plus important dans ce
cas-là.
En effet, les réactifs sont tous les deux chargés : l’eau ayant une constante diélectrique bien plus
Chimie organique Exercice 24 Page 5 sur 7
élevée que l’éthanol, elle solvate très bien les ions, les stabilise et les sépare fortement.
À l’état de transition, le complexe activé est neutre dans ce cas ! L’eau ne le stabilise donc quasiment
pas, d’où la valeur élevée de l’énergie d’activation dans ce solvant.
c) Il s’agit de l’hydrolyse du chlorure de tertiobutyle.
L’halogénoalcane étant tertiaire, le mécanisme SN 2 est impossible et le mécanisme SN 1 favorisé (un
carbocation tertiaire est relativement stable et le solvant eau+éthanol est protique et dissociant).
H3C ecd + CH3 _
Cl H3C + Cl
H3C k1
H3C CH3
H
+
CH3 O H O
H3C + + H H
CH3
CH3 H3C
CH3
H
+ déprotonnation
H O dÈprotonnation H O +
+ H
CH3 CH3
H3C H3C
CH3 CH3
Si on considère pour simplifier les réactions non renversables, alors il s’agit de trois réactions
successives dont la première, la formation du carbocation, est l’étape cinétiquement déterminante. Elle
impose donc sa vitesse à l’ensemble de la réaction et on trouve 𝑣 = 𝑘' [(CH& )& Cl].
Effets de solvant :
On raisonne uniquement sur l’ecd. Seule 𝑘' intervient dans la loi de vitesse.
Le carbocation et le complexe activé qui lui est proche en énergie et structure sont fortement
stabilisés par les solvants polaires et dissociants, alors que la molécule neutre de départ est peu
affectée. D’où l’accélération de la réaction avec l’augmentation de la teneur en eau. L’eau, avec sa
constante diélectrique particulièrement élevée et les multiples liaisons hydrogène qu’elle peut donner
avec les anions est un solvant optimal pour provoquer l’ionisation des halogénoalcanes (mais elle doit
être mélangée à un solvant organique comme l’éthanol ou l’acétone pour que les halogénoalcanes y
soient solubles !).
d) On constate que la substitution se fait sur un atome de carbone tertiaire. Le mécanisme SN 2 est
donc exclu. On écrit le mécanisme SN 1 :
H3C C2H5 C2H5
ecd + CH3
S H3C + S
H3C + k1
H3C C2H5 CH3 C2H5
_ Br
CH3 Br
H3C + +
CH3
CH3 H3C
CH3
Si on considère pour simplifier les réactions non renversables, alors il s’agit de deux réactions
successives dont la première, la formation du carbocation, est l’étape cinétiquement déterminante. Elle
impose donc sa vitesse à l’ensemble de la réaction et on trouve 𝑣 = 𝑘' [(C$ H( )$ S" C(CH& )& ].
Effets de solvant :
On constate qu’au contraire de ce qu’on observe habituellement pour un mécanisme SN 1, la réaction
Chimie organique Exercice 24 Page 6 sur 7
ralentit lorsque le caractère dissociant du solvant augmente.
Ceci peut s’interpréter de la manière suivante :
L’ecd n’est pas la formation d’un carbocation à partir d’une molécule neutre mais à partir d’un cation,
portant une charge + sur un atome de soufre. On ne peut pas appliquer a priori le postulat de
Hammond dans ce cas : on passe d’un réactif instable à un intermédiaire instable également. L’état de
transition n’est probablement pas tardif.
Il faut donc imaginer un complexe activé plus symétrique, où la charge + est en train de passer du
soufre au carbone. La charge + est répartie sur deux atomes dans le complexe activé, alors qu’elle
est concentrée sur le soufre dans le réactif.
On en déduit que les solvants les plus polaires et dissociants stabilisent davantage le réactif que le
complexe activé, ce qui augmente l’énergie d’activation et donc ralentit la réaction.
Chimie organique Exercice 24 Page 7 sur 7
Vous aimerez peut-être aussi
- TD Infrarouge Corrigé 2020Document8 pagesTD Infrarouge Corrigé 2020Mohamed Belbaraka100% (6)
- CH Org TD 7Document8 pagesCH Org TD 7Mohammed El Kacem KadraouiPas encore d'évaluation
- TD Éffets Électroniques 2020Document3 pagesTD Éffets Électroniques 2020Berthe AmiPas encore d'évaluation
- Epreuve Juin smc6 14 15Document2 pagesEpreuve Juin smc6 14 15cvbn100% (1)
- Examen Correction L1 Chimie Organique 2006 2Document7 pagesExamen Correction L1 Chimie Organique 2006 2med madPas encore d'évaluation
- TD Stereochimie Corrige 5Document7 pagesTD Stereochimie Corrige 5othmanPas encore d'évaluation
- 2009 Lyon Walchshofer Radix StrucMolOrgaCours PDFDocument19 pages2009 Lyon Walchshofer Radix StrucMolOrgaCours PDFAbdessamed GherbaouiPas encore d'évaluation
- Pharmacologie EndodontiqueDocument9 pagesPharmacologie EndodontiqueKamalo TrissePas encore d'évaluation
- EXAMEN 1 CORRIGéDocument3 pagesEXAMEN 1 CORRIGéSOUFYANE MUSTAPA100% (2)
- Td11chim2019 2020Document3 pagesTd11chim2019 2020Med Stu DentPas encore d'évaluation
- Serie TD 2 L2BCGS 2022 - 2023-5Document2 pagesSerie TD 2 L2BCGS 2022 - 2023-5Daour NdiayePas encore d'évaluation
- Série 3 SMC4Document5 pagesSérie 3 SMC4anwar jakriPas encore d'évaluation
- Mecanismes Reactionnels PDFDocument6 pagesMecanismes Reactionnels PDFJérémie NimpagaritsePas encore d'évaluation
- Série 2 Isomérie 2020-2021Document3 pagesSérie 2 Isomérie 2020-2021Ayoub HmPas encore d'évaluation
- OrganometalliquesDocument13 pagesOrganometalliquesabdelouahed.rhaouiPas encore d'évaluation
- Corrige Session 2 2015 16Document7 pagesCorrige Session 2 2015 16Khalid ZegPas encore d'évaluation
- RevisionDocument10 pagesRevisionChimiste ChimistePas encore d'évaluation
- Session 1 2016Document7 pagesSession 1 2016Yc YacinePas encore d'évaluation
- 6 Reactions D Elimination 1Document9 pages6 Reactions D Elimination 1Blondet RomaricPas encore d'évaluation
- 15209cours Orga M1 CMS Reactions PericycliquesDocument33 pages15209cours Orga M1 CMS Reactions PericycliquesLaura DijouxPas encore d'évaluation
- Série-3-Corrigée Chimie4Document15 pagesSérie-3-Corrigée Chimie4poly educationPas encore d'évaluation
- 0 C 40 F 13 A 769 Aef 3 Ca 505Document4 pages0 C 40 F 13 A 769 Aef 3 Ca 505api-497754935Pas encore d'évaluation
- TD Nomenclature Corrigé12goodprepa PDFDocument3 pagesTD Nomenclature Corrigé12goodprepa PDFNour EddinePas encore d'évaluation
- Serie 3 PDFDocument2 pagesSerie 3 PDFElbahi Djaalab33% (3)
- SMC4 Examen Juin 2013Document5 pagesSMC4 Examen Juin 2013Yc YacinePas encore d'évaluation
- TD Intermediaires Reactionnels 2 SolutionDocument2 pagesTD Intermediaires Reactionnels 2 SolutionIssa SINDEPas encore d'évaluation
- Sujet Corrige Exam 2017Document6 pagesSujet Corrige Exam 2017huihu100% (1)
- 2016 Hétérocycles Caractères GénérauxDocument56 pages2016 Hétérocycles Caractères GénérauxhugoboddaertPas encore d'évaluation
- TDDocument10 pagesTDam47Pas encore d'évaluation
- Série 5Document1 pageSérie 5simo Gri100% (1)
- Nomenclature Exercices PDFDocument3 pagesNomenclature Exercices PDFmagnumPas encore d'évaluation
- S6 HOC CH Chapitre 4Document21 pagesS6 HOC CH Chapitre 4Eddouks Fatimazahrae100% (2)
- Chimie Organique Fonctionnelle TD 02Document2 pagesChimie Organique Fonctionnelle TD 02123456789Pas encore d'évaluation
- Al CoolsDocument13 pagesAl Coolsbmm2Pas encore d'évaluation
- A 3 CompetitionDocument3 pagesA 3 CompetitionEmilie BoubinetPas encore d'évaluation
- TD Orga3 L3 S5Document2 pagesTD Orga3 L3 S5DialloPas encore d'évaluation
- Chapitre 1 CHM321 CoordinationDocument35 pagesChapitre 1 CHM321 CoordinationVictor NguemoPas encore d'évaluation
- Chimie Organique Fonctionnelle TD Corr 01Document2 pagesChimie Organique Fonctionnelle TD Corr 01123456789Pas encore d'évaluation
- TD Chap 1-2Document8 pagesTD Chap 1-2Aris MpomePas encore d'évaluation
- Exam I 2Document1 pageExam I 2Anonymous sdeGjzXETG100% (2)
- TD Stereochimie 5Document5 pagesTD Stereochimie 5Jean TellPas encore d'évaluation
- TD1-composés Carbonylés IIIDocument3 pagesTD1-composés Carbonylés IIIRita No ExistePas encore d'évaluation
- Exam-Corrige Chimie PDFDocument4 pagesExam-Corrige Chimie PDFNassimaPas encore d'évaluation
- Exo TDDocument8 pagesExo TDBassirou YacoubaPas encore d'évaluation
- Exam I 7Document3 pagesExam I 7Dlimi MohamedPas encore d'évaluation
- Aldehydes CetonesDocument29 pagesAldehydes CetonesAhmad Elhamri100% (1)
- UntitledDocument3 pagesUntitledAbdeldjalil MayachePas encore d'évaluation
- Corrige Exercices 14 21 Chimie OrganiqueDocument33 pagesCorrige Exercices 14 21 Chimie OrganiqueFofo BokovouPas encore d'évaluation
- Aldéhydes Et CétonesDocument34 pagesAldéhydes Et Cétonesatika benslimanePas encore d'évaluation
- Serie1 Org2-1Document2 pagesSerie1 Org2-1Bibi Biba100% (1)
- DiolsDocument9 pagesDiolsAhmad ElhamriPas encore d'évaluation
- Diols PDFDocument9 pagesDiols PDFDaoui Ibtihel100% (2)
- Corrigé de Examen Final OrganiqueDocument2 pagesCorrigé de Examen Final OrganiqueRedOne DerrouazinPas encore d'évaluation
- Orga 6Document11 pagesOrga 6Romain Laher100% (1)
- Diagrammes Potentiel-PhDocument7 pagesDiagrammes Potentiel-Phaymane el hachimiPas encore d'évaluation
- TD Chim Orga FonctDocument11 pagesTD Chim Orga FonctAnäśś AnassPas encore d'évaluation
- TD SyntheseDocument11 pagesTD SyntheseibrahimaPas encore d'évaluation
- SMC4 Examen Juillet 2013Document4 pagesSMC4 Examen Juillet 2013Yc Yacine100% (1)
- TD Chapitre 8 SNDocument4 pagesTD Chapitre 8 SNزيد بخليفةPas encore d'évaluation
- Alcènes AlcynesDocument17 pagesAlcènes AlcynesINFINITY & BEYONDPas encore d'évaluation
- TD Substitution NucleophileDocument3 pagesTD Substitution NucleophileJohns AtsacwounPas encore d'évaluation
- Corrige Exercices 22 27 Chimie OrganiqueDocument20 pagesCorrige Exercices 22 27 Chimie Organiqueephraim MoukokoPas encore d'évaluation
- Universite D Abomey Calavi La Problematique de L Eau Potable Et La Sante Humaine Dans La Ville de Cotonou Odoulami Leocadie 2009 PDFDocument230 pagesUniversite D Abomey Calavi La Problematique de L Eau Potable Et La Sante Humaine Dans La Ville de Cotonou Odoulami Leocadie 2009 PDFزيد بخليفةPas encore d'évaluation
- La Problématique de L'eau en Algérie Enjeux Et Contraintes PDFDocument268 pagesLa Problématique de L'eau en Algérie Enjeux Et Contraintes PDFزيد بخليفة100% (1)
- DOERFLINGER 2017 Diffusion PDFDocument217 pagesDOERFLINGER 2017 Diffusion PDFزيد بخليفةPas encore d'évaluation
- Analyses Des Eaux de Réseau de La Ville de Béjaia Et Évaluation de Leur Pouvoir Entartant PDFDocument102 pagesAnalyses Des Eaux de Réseau de La Ville de Béjaia Et Évaluation de Leur Pouvoir Entartant PDFزيد بخليفة100% (1)
- Les MosommeDocument15 pagesLes Mosommeزيد بخليفةPas encore d'évaluation
- 12P14 PDFDocument156 pages12P14 PDFزيد بخليفةPas encore d'évaluation
- TD Chapitre 8 SNDocument4 pagesTD Chapitre 8 SNزيد بخليفةPas encore d'évaluation
- TD Substitution Nucleophile Corrige 3Document5 pagesTD Substitution Nucleophile Corrige 3زيد بخليفةPas encore d'évaluation
- Exercices HalogenoalcanesDocument10 pagesExercices HalogenoalcanesJean-François Abena100% (1)
- Rapport de StageDocument7 pagesRapport de Stageabdelghani benhamoudaPas encore d'évaluation
- TP MM TesDocument32 pagesTP MM TesAtayi100% (1)
- Compte Rendu de TPDocument4 pagesCompte Rendu de TPManonPas encore d'évaluation
- Devoir Chimie 1ere CDDocument3 pagesDevoir Chimie 1ere CDBriendon PogaPas encore d'évaluation
- Tse ChimieDocument67 pagesTse Chimiefombafousseini46Pas encore d'évaluation
- Travaux Dirigés de Chimie: Centre D'Encadrement ' Good Prepa''Document3 pagesTravaux Dirigés de Chimie: Centre D'Encadrement ' Good Prepa''Anta OndonPas encore d'évaluation
- Cours - Microbiologie Industrielle - BUT GB 2Document17 pagesCours - Microbiologie Industrielle - BUT GB 2Kérina FosPas encore d'évaluation
- Série D'exercices - Chimie Série Acide Base Acide Base - 2ème Sciences (2012-2013) MR Chouket HasenDocument2 pagesSérie D'exercices - Chimie Série Acide Base Acide Base - 2ème Sciences (2012-2013) MR Chouket HasenRamzi Tarchouni75% (4)
- 4 Propriétés Des OsesDocument20 pages4 Propriétés Des OsesMr. ZakariaPas encore d'évaluation
- 1ère A - APC - Les AlcanesDocument5 pages1ère A - APC - Les AlcanesLAWSON NICOLASPas encore d'évaluation
- Pfe AazmiDocument105 pagesPfe Aazmim'hamed elomari50% (2)
- Omposition de Himie NDocument15 pagesOmposition de Himie Namandine gaianiPas encore d'évaluation
- Essai de Multiplication Et Culture de Champignons Pleurote À Échelle Du LaboratoireDocument70 pagesEssai de Multiplication Et Culture de Champignons Pleurote À Échelle Du LaboratoireAMINEPas encore d'évaluation
- U 1000 RVFVDocument4 pagesU 1000 RVFVBouity MavyPas encore d'évaluation
- Cours Solubilite PDFDocument10 pagesCours Solubilite PDFRafik DraPas encore d'évaluation
- Objectifs Du Stage de Pharmacie HospitaliereDocument5 pagesObjectifs Du Stage de Pharmacie HospitaliereLolo ButyPas encore d'évaluation
- MINOUGOU Abdoul Kaled RachidDocument86 pagesMINOUGOU Abdoul Kaled RachiddanielsinkotPas encore d'évaluation
- Degradation PolymèreDocument5 pagesDegradation PolymèreHB RIMPas encore d'évaluation
- Guide de Nettoyage Et Entretien Du VerreDocument9 pagesGuide de Nettoyage Et Entretien Du VerreChristian NunezPas encore d'évaluation
- Écologie Bac 1 MédecineDocument38 pagesÉcologie Bac 1 Médecinemwambatshibanda04Pas encore d'évaluation
- Les Risques NRBC - Savoir Pour AgirDocument253 pagesLes Risques NRBC - Savoir Pour AgirazaPas encore d'évaluation
- Bio ImpoDocument20 pagesBio ImpoMeryem RkayaePas encore d'évaluation
- Vanne de DechargeDocument8 pagesVanne de DechargeSOFIANEPas encore d'évaluation
- Correction DS N°1 SpécialitéDocument2 pagesCorrection DS N°1 Spécialitédavid Bentouza100% (1)
- Huile BSE 85KDocument6 pagesHuile BSE 85KmithascoetPas encore d'évaluation
- 2012 Metropole Exo3 Correction CinetiqueConducti 4ptsDocument2 pages2012 Metropole Exo3 Correction CinetiqueConducti 4ptsĀbdï FïgõPas encore d'évaluation
- Exposé Sur:: Centre D'enfouissement Technique CET Des Déchets Urbains-Quel Avenir en AlgérieDocument20 pagesExposé Sur:: Centre D'enfouissement Technique CET Des Déchets Urbains-Quel Avenir en AlgériedrgocefPas encore d'évaluation
- GraphismeDocument5 pagesGraphismeabidi issam eddinePas encore d'évaluation