Académique Documents
Professionnel Documents
Culture Documents
02 - Troubles Des Règles Et Du Cycle, Aménorrhée Et Tableaux
Transféré par
Iván ATTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
02 - Troubles Des Règles Et Du Cycle, Aménorrhée Et Tableaux
Transféré par
Iván ATDroits d'auteur :
Formats disponibles
EGONEplus ENDOCRINOLOGY Script E2
pour la formation post-graduée et formation continue Release:
© Auteurs: tous droits réservés 2013/14
Version:
6
TROUBLES DES RÈGLES ET DU CYCLE, AMÉNORRHÉE ET TABLEAUX Date:
CLINIQUES ASSOCIÉS 11.09.2017
Voulez-vous
évaluer ce
chapitre?
Auteurs: B. ImthurnZürich, F. LeidenbergerHamburg
Traduction: H. StammMontreux
OBJECTIFS D’APPRENTISSAGE
Connaître les définitions, les causes, les investigations et thérapies des anomalies des règles et
du cycle (incl. aménorrhée) ainsi que de la dysménorrhée et du syndrome prémenstruel.
Euménorrhée: Le cycle normal dure 28 (25-35) jours, la menstruation normale (=les règles)
dure < 7 jours, sans élimination de caillots.
CLASSIFICATION DES TROUBLES DU CYCLE
Les troubles des règles et du cycle sont divisés en 2 groupes : Les anomalies d’intensité
(l’abondance du saignement n’est pas normale) et les anomalies de fréquence (le rythme du
cycle est perturbé).
Parmi les phénomènes liés au cycle, la dysménorrhée et le syndrome prémenstruel relèvent
d’une importance clinique significative, c’est pourquoi ils sont traités dans un chapitre ad hoc.
Les anomalies d’intensité (all. Typusanomalien) comportent l‘hypoménorrhée,
l‘hyperménorrhée, la ménorragie, la ménométrorragie et les métrorragies (qui sont des
saignements acycliques). Dans les pays anglophones, les anomalies d’intensité avec des
saignements prolongés/accentués se résument sous le terme de „menorrhagie“ ou „HMB“
(Heavy Menstrual Bleeding).
Les anomalies de fréquence (all. Tempoanomalien) sont la polyménorrhée,
l‘oligoménorrhée et l’aménorrhée.
Le moyen diagnostique idéal pour identifier et objectiver les troubles du cycle est le
calendrier menstruel (le ménogramme). La patiente y note tous les jours la présence et
l’intensité de ses saignements.
EGONEplus Troubles des règles et du cycle, aménorrhée 1 de 37
1. LES ANOMALIES D’INTENSITÉ
1.1 Hypoménorrhée
L’hypoménorrhée est caractérisée par un saignement menstruel très faible, en général de
courte durée.
La hauteur rouge marque l’intensité du saignement. La distribution des jours rouges dans le
mois visualise la cyclicité et la durée des saignements.
( Toutes les illustrations se trouvent dans la galerie d’images sous „Appliquer“)
Causes fréquentes
L’hypoménorrhée a comme causes :
1. soit une prolifération de l’endomètre insuffisante,
2. soit une capacité réactive de l’endomètre insuffisante malgré exposition hormonale normale.
Raisons ad 1
Effet progestatif marqué en cas de prise/prescription de contraceptifs hormonaux (effet
réversible)
Effet progestatif local après pose d’un stérilet (DIU) contenant/libérant un gestagène (effet
réversible)
Aucune raison reconnaissable („raison constitutionnelle“)
Raisons ad 2
Endommagement de l’endomètre consécutif à un ou plusieurs curetages, en particulier dans
la période postpartale (effet presque toujours irréversible) ou après des infections intra-
utérines (p.ex. tuberculose, actuellement rare) (effet presque toujours irréversible).
Les lésions caractéristiques observées sont des adhérences intra-utérines et des synéchies
provoquant une hypoménorrhée. Ce tableau clinique est appelé syndrome d’Asherman
partiel.
Si l’anamnèse parle pour un endommagement délimité de l’endomètre (p.ex. s’il existe un lien
temporel entre l’apparition de l’hypoménorrhée et des curetages – en particulier effectués
dans la période du post-partum), il est impératif de procéder à un diagnostic par
hystéroscopie (cf aussi chapitre 3.2.3.1 Syndrome d’Asherman).
EGONEplus Troubles des règles et du cycle, aménorrhée 2 de 37
1.2 Hyperménorrhée
L’hyperménorrhée est un saignement menstruel trop abondant, souvent associé à l’élimination
de caillots. Les pertes de sang lors de chaque menstruation dépassent les 150 ml.
Causes
L’hyperménorrhée est le plus souvent d’origine organique.
Les raisons organiques
La capacité contractile de la musculature utérine est réduite par la présence de
Myomes intramuraux et sous-muqueux
Foyers intramuraux d’endométriose
Malformations utérines
Processus inflammatoires intrautérins
Stérilets en cuivre (dispositifs intrautérins (DIU) au cuivre)
Polypes intracavitaires
Carcinomes
Dans les investigations sont importantes l’examen échographique de l’utérus et la
détermination de l’hématocrite (hyperménorrhée anémiante?).
Pour la thérapie on dispose en plus de l’approche chirurgicale de divers médicaments:
antifibrinolytiques, gestagènes, inhibiteurs d’ovulation voire des IUD libérant du gestagène.
En cas de pathologie non accessibles à un traitement opératoire:
Cyklokapron® 4x1 g au premier jour du cycle, et 3x1 g du jour 2 à 5
ou
Méfénacide® 3x500 mg par jour pendant toute la durée des règles
ou
Dicynone® 500 3x500 mg par jour pendant 10 jours, à commencer 5 jours avant le début
attendu des règles
Pose d’un DIU Mirena®
ou
Traitement cyclique aux gestagènes, p.ex. Primolut-N® 2x5 mg / jour de J 5 à 25 du cycle.
ou
Traitement par un inhibiteur de l‘ovulation.
( Toutes les illustrations se trouvent dans la galerie d’images sous „Appliquer“)
EGONEplus Troubles des règles et du cycle, aménorrhée 3 de 37
1.3 Ménorragie
Si un saignement menstruel dure au-delà de 7-14 jours, il s’agit d’une ménorragie. Ménorragie
et hyperménorrhée vont souvent de pair. De ce fait les causes et les procédés d’investigation
et de traitement sont les mêmes que pour l’hyperménorrhée.
( Toutes les illustrations se trouvent dans la galerie d’images sous „Appliquer“)
1.4 Métrorragie, Ménométrorragie
Les métrorragies sont des saignements acycliques, c.-à-d. des saignements survenant en
dehors du cycle normal.
Si ces saignements se prolongent au-delà de 14 jours, on les nomme ménométrorragies.
Dans l’adolescence et la périménopause ces troubles sont plus fréquents qu’au milieu de la
vie fertile, car dans cette période de vie, la fonction ovarienne est plus stable.
Dans les différentes périodes de vie, les causes diffèrent sensiblement. Mais dans toutes les
périodes, les troubles de la fonction ovarienne, le plus souvent de type anovulatoire, sont les
plus fréquents (= saignements dysfonctionnels). Les saignements dysfonctionnels se
présentent le plus souvent sous forme de ménométrorragies en combinaison avec de
l’oligoménorrhée.
Périménarche et adolescence
Troubles anovulatoires de la fonction ovarienne
Troubles de la coagulation
Infections locales
Tumeurs produisant des hormones (rare)
Age fertile
Issue pathologique d’une grossesse
Troubles anovulatoires de la fonction ovarienne
Causes organiques (myomes, polypes, adénomyosis, ectopies du col, infections)
Raisons iatrogènes (p. ex. anticoagulation, traitement continu aux gestagènes, DIU)
Néoplasies (p. ex. cancer du col, cancer de l’endomètre, tumeurs ovariennes produisant des
hormones)
EGONEplus Troubles des règles et du cycle, aménorrhée 4 de 37
Périménopause
Troubles anovulatoires de la fonction ovarienne
Infections
Néoplasies (p. ex. cancer du col, cancer de l’endomètre, tumeurs ovariennes produisant des
hormones)
Diagnostic différentiel
Les piliers du diagnostic différentiel sont:
L’anamnèse détaillée (histoire du cycle, de la puberté, de l’adolescence, indices pour des
maladies générales et troubles métaboliques, anamnèse sexuelle, médicaments,
contraception)
L’examen clinique avec examen gynécologique comprenant une échographie des organes
pelviens (ovaires, utérus, endomètre, espace rétro-utérin (Douglas), et dans des cas
particuliers, hystéroscopie, laparoscopie.
Dans la péri-ménopause, surtout en présence de métrorragies / ménométrorragies, un
prélèvement histologique afin d’exclure un carcinome de l’endomètre est obligatoire.
En cas de ménométrorragies, combinées avec des oligoménorrhées, les analyses
hormonales s’avèrent utiles pour établir les diagnostics différentiels et apprécier le pronostic
de la perturbation de la fonction ovarienne (FSH, Prolactine, Testostérone, TSH).
Thérapie
La thérapie est fonction du diagnostic définitif:
Prise en charge oncologique opératoire en cas de cancer
Opération (laparoscopie - hystéroscopie) ou mesures locales en cas de processus locaux
bénins (ectopies, polypes, endométriose, fibromes/myomes)
Stimulation de la maturation folliculaire et de l’ovulation en cas de troubles ovariens et
saignements dysfonctionnels, quand il y a désir de grossesse (cf chapitre E5 Stérilité)
Traitement hormonal à visée hémostatique en cas de saignements dysfonctionnels
Si endomètre épais à l’échographie (> 5mm):
o Gestagène atrophiant (p.ex. Primolut-N® 3x1cp par jour pdt 10 jours).
Si endomètre atrophique à l’échographie (< 5mm):
o Microgynon® 30 selon le „schéma de Kaufmann“ remodelé:
1.-2. jour: 2x1 dragée/j
3.-8. jour: 1 dragée/j
o Cave: il est à prévoir que les caisses-maladie ne remboursent pas ce médicament dans
cette indication, même s’il ne s’agit pas d’un traitement (ttt) contraceptif
Alternatives:
o GnRH-Agoniste (z.B. 1 Amp. Decapeptyl® Retard s.c.)
o Curetage: en cas de saignement massif/anémiant et endomètre fortement épaissi
(> 10 mm) et/ou présence de caillots intracavitaires.
La patiente doit être instruite qu’une diminution des saignements n’est à s’attendre qu’après
2 à 4 jours de traitement médicamenteux. Elle doit également savoir que quelques jours
après l’arrêt du traitement médicamenteux, une métrorragie de privation se produira (=
« curetage hormonal »). Il ne s’agit-là nullement d’une récidive !
Important: en tant que prophylaxie tous les mois: cure de progestatif dans la
deuxième phase du cycle (p.ex. Prodafem® 10mg/d du 16.-25. jour du cycle ou
Duphaston® 20mg/d du 11.-25. jour du cycle).
EGONEplus Troubles des règles et du cycle, aménorrhée 5 de 37
( Toutes les illustrations se trouvent dans la galerie d’images sous „Appliquer“)
2. LES ANOMALIES DE FREQUENCE
2.1 Polyménorrhée
Si la durée du cycle, à compter du premier jour des dernières règles (DR) jusqu’au premier
jour des règles suivantes est inférieure à 25 jours, il s’agit d’une polyménorrhée.
La plupart du temps, la cause d’une polyménorrhée est une insuffisance lutéale bénigne due
à un léger trouble de la maturation folliculaire. Occasionnellement, en cas de polyménorrhée,
on trouve un cycle anovulatoire.
L’insuffisance lutéale, fréquemment rencontrée lors de polyménorrhée, ou le cycle anovulatoire
sont la conséquence d’une maturation folliculaire insuffisante.
La maturation folliculaire, l’ovulation et la phase lutéale sont fonctionnellement liées et
dépendent de l’interaction harmonieuse des hormones impliquées. Il n’est dès lors pas étonnant
que selon la sévérité de l’atteinte de la maturation folliculaire, les répercussions cliniques
prendront plusieurs formes.
En cas de trouble léger on constate un spotting prémenstruel (insuffisance lutéale isolée;
production de progestérone insuffisante). En cas de trouble de maturation plus important, on
trouve une polyménorrhée ou une oligoménorrhée (anovulation avec saignements
dysfonctionnels; absence de production de progestérone). En cas de trouble massif, la cessation
complète de maturation folliculaire (plus aucune production d’oestrogènes et absence de
production de progestérone) aboutit finalement à une aménorrhée hypo-oestrogénique.
L’arrêt prématuré de la production de progestérone provoque une instabilité de l’endomètre qui
se manifeste par le début prématuré du saignement de privation hormonale (soit spotting
prémenstruel soit polyménorrhée).
Parfois il est difficile de déceler, à l’aide du calendrier menstruel, s’il s’agit d’une polyménorrhée
ou d’une métrorragie. Vu qu’une des causes possibles de métrorragie est un carcinome, il faut,
dans le doute, partir de l’idée d’un saignement acyclique et procéder aux investigations
nécessaires.
En cas de désir de grossesse, une induction de la maturation folliculaire corrigera
rapidement le trouble de la fonction ovarienne et la polyménorrhée associée ( E5 Stérilité).
En cas d’absence de désir de grossesse, le cycle peut être corrigé à l’aide d’un progestatif
dans la deuxième phase (p.ex. Prodafem® 10mg de J 16 à 25 du cycle) ou par la prescription
d’un contraceptif hormonal combiné.
EGONEplus Troubles des règles et du cycle, aménorrhée 6 de 37
Le choix est fonction des souhaits de la patiente: Demande-t-elle une contraception ou non ?
Des gestagènes, prescrits pendant 10 à 14 jours dans la deuxième moitié du cycle dans un
dosage suffisant pour permettre la transformation sécrétoire de l’endomètre, sont indiqués
quand une contraception n’est pas souhaitée et pour autant qu’il n’y ait pas de spotting en
cours de traitement. L’apparition de spotting trouve son explication dans un effet oestrogénique
insuffisant pour faire proliférer l’endomètre dans la première phase du cycle: L’endomètre est
insuffisamment préparé et les doses insuffisantes d’oestradiol induisent un nombre insuffisant
de récepteurs à la progestérone. Ceux-ci sont indispensables pour le déclenchement de l’effet
de la progestérone. Dans ce cas de figure, un traitement séquentiel oestro-progestatif est
indiqué. Une pilule contraceptive combinée classique, prescrite « à titre thérapeutique »
(toutefois sans garantie de prise en charge par la caisse-maladie) serait un traitement adéquat.
( Toutes les illustrations se trouvent dans la galerie d’images sous „Appliquer“)
2.2 Oligoménorrhée
On parle d’oligoménorrhée quand le cycle dure > 35 jours (soit 36 à 90 jours)
Nota bene :
En cas de cycle > 90 jours, il s’agit d’une aménorrhée (cf plus bas)!
De la normalité avec un cycle de 28 jours, témoin d’une fonction ovarienne stable, à
l’aménorrhée complète, la pathologie est croissante, mais obéissant à la même pathogénie
(d’abord insuffisance lutéale, ensuite oligoménorrhée et finalement aménorrhée). Le trouble est
fonction de la péjoration d’une seule et même pathogénie. Les différentes formes de
perturbation de la fonction ovarienne ne reflètent que le degré de gravité du trouble et ne
permettent pas de tirer des conclusions sur les causes. L’oligoménorrhée est donc une
forme atténuée de l’aménorrhée ou un stade qui la précède. Vu que leurs causes ont les
mêmes origines, les diagnostics différentiels et les investigations sont les mêmes. Ils seront
traités au chapitre « aménorrhée » (cf plus bas ).
EGONEplus Troubles des règles et du cycle, aménorrhée 7 de 37
( Toutes les illustrations se trouvent dans la galerie d’images sous „Appliquer“)
3. AMENORRHEE
En principe, l’aménorrhée fait partie des anomalies de fréquence. La définition est : Absence
de saignement menstruel pendant trois mois ou plus.
En raison de son importance clinique, on consacre un chapitre particulier à ce trouble du cycle.
Il existe plusieurs classifications des différentes formes d’aménorrhée:
Classification selon l’anamnèse
Aménorrhée primaire
Absence de ménarche à 16 ans révolus
En cas de manque de tout signe de puberté débutante, les investigations pour cette forme
d’aménorrhée primaire sont à entreprendre déjà à partir de l’âge 14, car il est de toute
façon pathologique de ne pas observer le moindre signe de début de puberté à 14 ans.
Aménorrhée secondaire
Absence de règles pendant plus de 3 mois alors que le cycle était déjà établi
Classification selon l’importance clinique (allemand: Krankheitswert)
Aménorrhée pathologique
Aménorrhée physiologique
o enfance
o grossesse
o allaitement (aménorrhée de lactation)
o postménopause
EGONEplus Troubles des règles et du cycle, aménorrhée 8 de 37
Classification selon l‘OMS
I Insuffisance hypothalamo-hypophysaire
II Trouble de la régulation hypothalamo-hypophysaire
III Insuffisance ovarienne primaire
IV Anomalies du tractus génital
V Adénomes hypophysaires sécrétant de la prolactine
VI Hyperprolactinémie fonctionnelle
VII Autres tumeurs hypothalamo-hypophysaires
Classification selon les valeurs hormonales
normo- / hypo-oestrogénique
normo- / hypo- / hyper-gonadotrope
hyper-prolactinémie
hyper-androgénie
Classification selon la pathogenèse
d’origine ovarienne ou gonadique (= insuffisance ovarienne primaire)
d’origine hypothalamo-hypophysaire (= insuffisance ovarienne tertiaire / secondaire)
d’origine utérine
d‘origine extra-génitale
Dans la pratique clinique quotidienne, on utilise surtout les classifications selon l’anamnèse et
selon les valeurs hormonales !
3.1 Aménorrhée primaire
En considérant les conditions de vie en Europe, la ménarche ( = premier saignement
menstruel spontané) a lieu en moyenne à 12 ans et demi.
Si la ménarche n’a pas eu lieu à 16 ans révolus, il s’agit par définition d’une aménorrhée
primaire.
La puberté commence bien deux ans auparavant: Avec le développement de la pilosité
pubienne (pubarche) et le développement mammaire (thélarche). Ces deux phénomènes
commencent souvent presque en même temps. Ils sont suivis par la poussée de croissance
pubertaire.
Le développement mammaire et pubien sont répertoriés selon les stades de Tanner.
Tableau 1. Les 5 stades de Tanner
Développement
Stade Stade Pilosité pubienne
mammaire
S1 Période de repos P1 Absence de pilosité
S2 P2 Quelques poils longs sur le
Élargissement de l’aréole
Ménarche Pubarche pubis( pubarche)
Le corps glandulaire Les poils se renforcent et
S3 P3
augmente deviennent plus foncés
Saillie de l’aréole et du
Mont de Vénus pas encore
S4 mamelon sur la glande P4
fourni
(all. Knospenbrust)
Pilosité pubienne
S5 Sein adulte (mûr) P5
triangulaire adulte
EGONEplus Troubles des règles et du cycle, aménorrhée 9 de 37
Chronologie du développement pubertaire somatique
(tiré de: Marshall WA, Tanner SM. Arch. Dis. Childh. 1969; 44: 291)
Les stades de développement de la pilosité pubienne selon Tanner
( toutes les illustrations avec commentaire dans la galerie d’images sous „Appliquer“)
EGONEplus Troubles des règles et du cycle, aménorrhée 10 de 37
Les stades de développement de la glande mammaire selon Tanner
( toutes les illustrations avec commentaire dans la galerie d’images sous „Appliquer“)
Si le développement mammaire et pubien démarre avant 8 ans de vie, il s’agit d’une puberté
précoce (pubertas praecox).
Si ce développement démarre seulement après 14 ans, il s’agit d’une puberté tardive
(pubertas tarda).
3.1.1 Troubles gonadiques
Par trouble gonadique on entend un tableau clinique dont la cause est un « défaut ovarien »
ou « défaut gonadique » ( = insuffisance ovarienne primaire).
Une caractéristique commune de toutes ces formes d’insuffisance ovarienne primaire est
un taux sanguin de gonadotrophines élevé, en particulier de la FSH (hormone
folliculostimulante). En même temps on observe un taux extrêmement bas d’AMH (hormone
antimüllérienne).
Les taux de gonadotrophines sont élevés, car l’absence de follicules ovariens - qui ne produisent
donc pas d’hormones (en particulier stéroïdiennes, de la progestérone et la protéine inhibine) -
empêche un feed-back négatif qui pourrait freiner la libération de gonadotrophines au niveau de
l’hypophyse.
EGONEplus Troubles des règles et du cycle, aménorrhée 11 de 37
Une insuffisance ovarienne primaire accompagne les syndromes cliniques
suivants (3.1.1.1 à 3.1.1.4) :
3.1.1.1 Syndrome de Turner
La cause du syndrome de Turner (ou syndrome de Ullrich-Turner) réside dans la perte du
deuxième chromosome X (monosomie X0) déjà dans la période embryonnaire ou fœtale.
Lors du syndrome de Turner classique, le caryotype est
diminué d’un chromosome (45, X0 au lieu de 46, XX). En cas
de perte relativement tardive du chromosome X (le plus
souvent paternel), des formes mosaïques peuvent se créer
avec des lignées cellulaires atteintes à côtés de lignées
normales. Par conséquent, le défaut chromosomique ne
touche qu’une partie plus ou moins grande des cellules
somatiques.
95% des grossesse avec un embryon atteint d’une
monosomie 45,X0 finissent en abortus spontané au premier
trimestre.
Parfois, une grossesse avec syndrome de Turner frappe lors
d‘une échographie précoce par la présence d’un hygroma
colli ou d’un hydrops foetal. Ceci représente souvent
l’indication pour un diagnostic prénatal invasif qui permet de
prouver le défaut chromosomique.
Le phénotype est dans tous les cas féminin.
caryotype d'une patiente avec un syndrome de Turner
© Laboratoire médical MCL Duedingen
Les ovaires ne contiennent pas de follicules. Ainsi manque la production ovarienne
d’oestrogènes (et d’autres substances, p.ex. l’inhibine), qui a lieu normalement dans les
follicules.
A la laparoscopie, les ovaires impressionnent comme cordes fibreuses minces („Streak-
Ovaries“) (cf illustration).
L’analyse hormonale montre, à partir de la puberté, des taux de FSH fortement élevés.
Un cas de syndrome de Turner se trouve sur env. 2.500 naissances.
EGONEplus Troubles des règles et du cycle, aménorrhée 12 de 37
Traits morphologiques particuliers du syndrome de Turner *
Symptôme Fréquence[%]
Petite taille 96–100
Aménorrhée primaire hypergonadotrope 85–97
Gonades rudimentaires (« Streak Gonads ») 96–100
Thélarche manquante bis 95
Implantation basse des cheveux sur la nuque avec aspect en trident 80–90
Dysplasies de l’oreille externe 60–80
Thorax large „en bouclier“ 60–80
Névi pigmentés en nombre augmenté 60–80
Hypoplasies et/ou malformations des ongles 50–80
Lymphoedème chez le nouveau-né et le nourrisson 40–80
Cubitus valgus 40–60
Pterygium colli 40–55
Raccourcissement des métarcarpalia/-tarsalia 40–60
Troubles auditifs ca. 50
Col court ca. 40
Malformations des reins et de l’arbre urinaire ca. 40
Expression faciale (hypomimie, angles de la bouche, « tête de sphinx ») 35–60
Voute du palais ogivale ca. 40
Hypertension artérielle ca. 35
Epicanthus 25–40
Troubles visuels 12–40
Tolérance au glucose altérée ca. 40
Dysfonctions thyroïdiennes (Hypothyroïdie, Thyroïdite de Hashimoto) 10–35
Malformations cardiaques et des gros vaisseaux 5–21 (–55)
Scoliose resp. anomalies de la colonne vertébrale ca. 15
Déformation de Madelung ca. 7,5
* Tiré de: H. Jung: Störungen der sexuellen Differenzierung und Klinik der Pubertät, S. 262. In:
Leidenberger, Strowitzki, Ortmann, Klinische Endokrinologie für Frauenärzte, 3. Auflage, 2005,
Springer Verlag, Heidelberg
Dans les formes pures, il y a toujours une aménorrhée primaire. En plus, le développement
des caractères sexuels secondaires manque. La patiente est de petite taille et présente une
série de signes dysmorphiques (cf tableau).
Dans les formes à mosaïque, il y a le plus souvent une aménorrhée secondaire. Les signes
dysmorphiques, pour autant qu’ils soient reconnaissables, sont moins marqués que dans le
syndrome de Turner classique.
A l’époque, le diagnostic d’un syndrome de Turner a été posé souvent seulement au
moment de la puberté manquée. De nos jours, ce diagnostic est souvent suspecté
beaucoup plus rapidement: les examens échographiques in utero permettent parfois déjà
de le suspecter (hydrops fétalis, hygroma colli). On doit le suspecter également dans la
petite enfance, quand la croissance de l’enfant est moins rapide que la norme pour l’âge.
L’établissement rapide du diagnostic est important, car avec l’administration de l’hormone
de croissance, un gain statural peut être obtenu et le déficit de croissance limité.
Une femme avec un Turner à mosaïque peut présenter des signes de puberté et, pendant
un certain temps, avoir des règles spontanées. Dans des cas isolés, même des grossesses
ont été décrites. Dans un grand pourcentage, néanmoins, ces grossesses finissent en
abortus ou en mort in utéro.
En présence d’une aménorrhée, le test au gestagène reste positif si les ovaires
produisent encore une quantité résiduelle d’oestrogènes. Le cycle peut alors être maintenu
avec un traitement cyclique aux progestatifs (cf chapitre 3.4). En cas de test au
gestagène négatif, on doit également substituer les oestrogènes (cf chapitre 3.4).
En cas de désir de grossesse, le seul moyen pour une femme Turner après épuisement de
son pool folliculaire, est de recourir au don d’ovules (interdit en Suisse).
Cave : La surcharge (physiologique) du système cardiovasculaire pendant la grosses impose
chez une femme Turner des investigations cardio-vasculaires avant d’envisager une
grossesse. Les malformations du cœur de des gros vaisseaux sont fréquentes dans cette
population, on craint particulièrement la rupture ou la dissection de l’aorte.
EGONEplus Troubles des règles et du cycle, aménorrhée 13 de 37
3.1.1.2 Dysgénésie gonadique pure *
L’étiologie de la dysgénésie gonadique pure, nommée aussi dysgénésie gonadique XX,
n’est pas connue. Probablement elle est hétérogène. Occasionnellement on observe une
manifestation familiale ce qui pourrait indiquer une origine autosomale-récessive. Les oreillons
dans la petite enfance pourraient détruire les follicules ovariens et provoquer le tableau clinique
de la dysgénésie ovarienne pure. Dans la majorité des cas, on admet une mutation primaire
comme explication du défaut des ovaires. Comme dans le syndrome de Turner, le phénotype
est féminin. Mais les femmes sont de taille normale et ne montrent pas les stigmates du
syndrome de Turner :
En général, on n’observe pas de signes de dysmorphie
Les caractères sexuels secondaires manquent ou sont plus ou moins présents. Cela dépend
de la durée (plus ou moins longue) pendant laquelle les ovaires ont encore pu produire des
hormones stéroïdiennes sexuelles.
On trouve des taux fortement élevés de FSH et des „Streak-Ovaries“ sans follicules ni sécrétion
d’oestrogènes. Le caryotype est féminin normal (46 XX). Les gonades en forme de bandelettes
de femmes atteintes de dysgénésie gonadique XX ne présentent pas de risque élevé de
dégénération maligne.
Les organes génitaux internes sont de conception normale. Toutefois, les ovaires se présentent
en forme de bandelette („streak ovaries“), et l’utérus et les trompes sont hypoplastiques en
raison du manque d’oestrogènes. Les femmes atteintes ont une taille normale. La puberté est
retardée voire ne se fait pas. Les femmes ont un risque d’ostéopénie. En raison du déficit
d’oestrogènes et des conséquences néfastes en découlant, les patientes doivent être substituées
avec des préparations oestro-progestatives (cf chapitre 3.4). Après don d’ovules (interdit en
Suisse) des grossesses ont été décrites.
Les personnes atteintes du syndrome de dysgénésie XX sont de tout point de vue féminines,
soit chromosomique, génital, phénotypique, psycho-sexuel et social.
* Dans la littérature anglo-américaine, le syndrome de dysgénésie pure („pure gonadal
dysgenesis“) décrit le plus souvent une femme avec des „streak-ovaries“ et un phénotype
féminin. Mais celle-ci peut avoir un caryotype XX ou XY (ce dernier cas de figure est également
appelé syndrome de Swyer – cf 3.1.1.3).
Dysgénésie ovarienne Streak Ovaries („ovaires en bandelette“)
pure (dysgénésie
ovarienne XX)
( Toutes les illustrations se Les ovaires « en bandelette » se trouvent en cas de :
trouvent dans la galerie Syndrome de Turner
d’images sous „Appliquer“) Dysgénésie ovarienne pure
EGONEplus Troubles des règles et du cycle, aménorrhée 14 de 37
3.1.1.3 Syndrome de Swyer
Le syndrome de Swyer (ou dysgénésie gonadique XY) est caractérisé par un défaut des
testicules en présence d’un caryotype masculin normal (46 XY).
Au moins une partie des cas est du à différentes mutations dans la région du gène Y qu’on
appelle en anglais la „SRY“ (= sex determining region of the Y-gene). Contrairement au
syndrome de Turner qui apparaît sporadiquement, le syndrome de Swyer ne se produit que très
rarement (prévalence : moins que 1 : 20’000).
On trouve des „gonades en bandelette“ ( „Streak-Gonads“). Vu l’absence non seulement de
production de spermatozoïdes, mais aussi de testostérone ou d’AMH (hormone antimüllérienne),
le phénotype est féminin. Le taux sérique de FSH est fortement élevé (absence de feed-back
négatif entre gonade et hypothalamus/hypophyse). Les caractères sexuels secondaires sont
sous-développés.
Les femmes atteintes sont de taille normale et ne présentent pas de signes dysmorphiques.
Leur puberté est retardée voire manque. Elles ont une tendance à l’ostéopénie. Leur utérus est
présent et normal. Des grossesses après don d’ovule (interdit en Suisse) ont été décrites. Les
patientes doivent être substituées avec des préparations oestro-progestatives (cf chapitre 3.4).
Vu que les gonades en cas de syndrome de Swyer ont une tendance marquée à la
dégénération maligne (> 50% des cas voire plus !), l’ablation bilatérale des gonades précoce
est fortement recommandée
Les personnes atteintes du syndrome de Swyer ont un caryotype masculin. Mais elles sont
féminines du point de vue génital, phénotypique, psycho-sexuel et social.
3.1.1.4 Syndrome androgéno-résistant
(all. Androgen-Insensitivitäts-Syndrom (AIS))
La cause du syndrome androgéno-résistant (all. AIS) est un défaut de nature génétique des
récépteurs à la testostérone. Quoi qu’il ne s’agisse pas d’un problème gonadique à proprement
parler, nous le présentons dans ce chapitre. On distingue différents degrés de gravité:
Dans le cas extrême de résistance complète aux androgènes on parle du syndrome du
testicule féminisant.
Les testicules sont normalement développés et se trouvent le plus souvent dans la région
inguinale ou dans les grandes lèvres. La production de testostérone est normale, mais vu
que dans les organes cibles un effet de testostérone manque, le phénotype est féminin. Les
seins se développent entièrement, mais aucune pilosité au niveau génital ou axillaire ne se
produit („hairless women“).
Egalement en cas de syndrome androgéno-résistant, il existe un risque de dégénération
maligne des gonades, qui est proportionnel au degré de résistance aux androgènes. Par
conséquent, après achèvement de la puberté, l’ablation bilatérale des testicules est
recommandée. Néanmoins, après information détaillée, l’autodétermination de la patiente doit
être respectée. Ainsi c’est elle qui décide de subir ou non cette intervention.
Les personnes atteintes du syndrome androgéno-résistant ont un caryotype masculin, des
gonades masculines et des hormones masculines. Mais le phénotype est féminin. Leurs
organes génitaux externes sont normaux, le vagin relativement court. Elles ont des
proportions féminines normales et sont féminines du point de vue psycho-sexuel et social.
Le développement des proportions féminines et des seins devient possible, car une partie de la
testostérone présente dans la circulation sanguine en concentrations normales (correspondant à
celles d’un homme adulte en bonne santé) est transformée en périphérie en Oestradiol. Vu que
les testicules, situés le plus souvent dans la région inguinale, produisent également l’AMH
(hormone antimüllérienne), ces femmes ne possèdent pas d’utérus. Une grossesse dès lors est
impossible, même avec don d’ovule.
EGONEplus Troubles des règles et du cycle, aménorrhée 15 de 37
Testicule féminisant Anorexia nervosa
© P.J. Keller
3.1.2 Troubles hypothalamo-hypophysaires
Les aménorrhées primaires d’origine hypothalamo-hypophysaire se caractérisent par des taux
sanguins de FSH et LH (encore) normaux et des taux d’oestradiol (E2) abaissés voire
indétectables.
Un manque de GnRH idiopathique ou consécutif à un état de stress, provoqué p.ex. par une
maladie consomptive ou un trouble alimentaire, peut mener à une aménorrhée primaire.
Comme un manque de GnRH dû au stress représente un trouble fonctionnel de la régulation
hypothalamo-hypophysaire, le traitement du problème en cause peut permettre l’apparition
de la ménarche.
Plus rarement la cause réside dans des lésions organiques du cerveau comme des tumeurs
ou des traumatismes. Il peut également s’agir du syndrome de Kallmann, d’apparition
familiale.
3.1.2.1 Le syndrome de Kallmann
Le syndrome de Kallmann est aussi nommé syndrome olfacto-génital, car il s’agit d’un
hypogonadisme congénital hypogonadotrope en combinaison avec des troubles olfactifs. Dans
ce syndrome, l’absence de sécrétion de GnRH, les taux sériques de FSH et LH indétectables et le
manque d’oestrogènes vont de pair avec l’inexistance anatomique des bulbes olfactifs.
La cause de ce syndrome se trouve dans des mutations de plusieurs gènes responsables du
contrôle moléculaire de la sécrétion de GnRH et du développement des bulbes olfactifs.
Chez la femme, la présence d’une anosmie avec une aménorrhée primaire est pour ainsi dire
pathognomonique pour le diagnostic du syndrome de Kallmann. Des symptômes variables
supplémentaires sont des troubles visuels, surdité, épilepsie et ataxie. En plus, des troubles en
dehors du système nerveux central ont été décrits (touchant p.ex. les reins et les organes
génitaux). Aussi des hommes peuvent présenter un hypogonadisme hypogonadotrope et une
anosmie.
A côté du syndrome de Kallmann classique une série d’autres formes congénitales
d’hypogonadisme hypogonadotrope sont connus dont les symptômes dominants sont
l’aménorrhée et la puberté qui ne se produit pas
EGONEplus Troubles des règles et du cycle, aménorrhée 16 de 37
Toutes ces formes trouvent leur origine dans des mutations diverses des gènes impliqués dans
la synthèse des hormones stéroïdiennes et de la leptine tout comme dans des mutations des
gènes responsables pour les sous-unités des gonadotrophines, des récepteurs à la GnRH etc. La
différenciation de ces sousgroupes d’hypogonadisme hypogonadotrope congénital a surtout un
intérêt scientifique et est du ressort des spécialistes.
Diagnostic
Anamnèse (aménorrhée primaire, développement pubertaire manquant, troubles olfactifs).
Examen physique, échographie des organes génitaux, signes de déficit d’oestrogènes (test aux
gestagènes négatif), dosages des hormones (FSH, Estradiol, TSH, Prolactine), en cas de doute
imagerie de la région de l’hypophyse.
Thérapie
1. Thérapie de substitution hormonale (cf chapitre 3.4) pour induire le développement des
caractères sexuels secondaires et pour prévenir l’ostéoporose.
2. La stimulation de la maturation folliculaire et de l’ovulation est possible en cas de désir de
grossesse. Les médicaments utiles sont les gonadotrophines et le traitement pulsatile avec
la pompe LHRH. Ces thérapies sont du ressort des spécialistes (risque d’hyperstimulation et
de grossesse multiple, surtout en cas d’utilisation des gonadotrophines) ( E5 Stérilité).
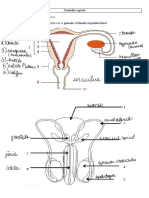
3.1.3 Des troubles au niveau utérin et vaginal responsables
d’une aménorrhée
Le phénotype d’une femme avec des malformations par inhibition au niveau du vagin ou des
organes dérivés des canaux de Müller (corps et col utérin, tiers supérieur du vagin) est
absolument féminin. La puberté se déroule normalement, les femmes ont des seins, une pilosité
pubienne et axillaire normales ainsi que des proportions féminines harmonieuses. Le phénotype
féminin normal prouve l’existence d’ovaires et de surrénales (cortex) fonctionnant normalement.
La combinaison d’un développement physique normal avec une aménorrhée primaire appelle
obligatoirement à la recherche/l’exclusion de malformations au niveau du vagin et de l’utérus.
Les personnes décrites dans ce chapitre sont féminines de tout point de vue,
chromosomique, gonadique, phénotypique, hormonal, psycho-sexuel et social.
Les malformations par inhibition des canaux de Müller et du développement du vagin sont
appelés gynatrésies. La forme la plus légère est l’atrésie de l’hymen qui peut être traitée par
une simple incision. La forme la plus extrême est le syndrome de Mayer-Rokitansky-Küster-
Hauser:
3.1.3.1 Le syndrome de Mayer-Rokitansky-Küster-Hauser (Syndrome MRKH)
Le syndrome MRKH (1 cas sur
4‘000 naissances vivantes) se
caractérise par l’absence de
l’utérus et du vagin – à leur
place se trouve un mince
cordon fibreux
(Uterus bipartitus solidus cum
vagina solida) [G17]
Aplasie vaginale
EGONEplus Troubles des règles et du cycle, aménorrhée 17 de 37
Le caryotype est normal (46 XX), les taux sériques de FSH et AMH sont dans la norme, les
ovaires intactes et fonctionnent normalement.
A l’échographie, l’utérus est impossible à mettre en évidence. L’introïtus est rudimentaire ou
absent. Sans opération, ces femmes ne peuvent pas cohabiter.
On distingue deux sous-groupes:
Syndrome MRKH I: présente exclusivement les malformations génitales sus-citées.
Syndrome MRKH II.
Cette variante présente souvent une série de malformations associées:
Malformations rénales (reins en fer à cheval), aplasie rénale unilatérale, reins ectopiques et
d’autres malformations rénales ou de l’arbre urinaire.
Anomalies squelettiques telles que des fusions osseuses au niveau de la colonne vertébrale,
syndactylies, polydactylies.
hypoacousie
anomalies cardiaques (rarement)
Diagnostic
Une gynatrésie doit être hautement suspectée si la ménarche n’a pas lieu (aménorrhée
primaire) chez une femme ayant eu une puberté normale avec développement physiologique
des caractères sexuels secondaires (càd proportions typiquement féminines, pilosité pubienne et
axillaire présentes, développement normal des seins). L’apparition plus ou moins régulière, à
quelques semaines d’intervalle, chez cette femme de douleurs crampiformes au bas ventre peut
parler pour une malformation du vagin ou de l’hymen (non-perforation) avec présence d’une
cavité utérine fonctionnelle.
Les étapes diagnostiques
Anamnèse détaillée, surtout concernant le développement pubertaire et la présence de
douleurs abdominales basses.
Examen gynécologique et examen physique complet
Echographie de l’abdomen inférieur (petit bassin, organes génitaux, loges rénales)
Imagerie de la région des reins et de la colonne vertébrale
Les femmes avec un (une des formes du) syndrome MRKH présentent donc une aménorrhée
primaire, car l’organe cible pour les hormones sexuelles ovarienne est inexistant (l’utérus). Vu
que les ovaires fonctionnent (en général) normalement, ces femmes ont eu par ailleurs un
développement pubertaire régulier avec un phénotype féminin normal.
Une conséquence de la malformation génitale est la stérilité primaire. La prise en charge
psychologique et la correction chirurgicale de l’aplasie vaginale sont du ressort de spécialistes
avec beaucoup d’expérience. En cas de désir de grossesse, seul le recours à une mère porteuse
est efficace (interdit en Suisse).
3.1.4 Des troubles extra-génitaux comme causes d’une
aménorrhée primaire
Des troubles endocriniens extra-génitaux perturbant la sécrétion de GnRH, peuvent causer une
aménorrhée primaire, p.ex.:
une hypothyroïdie primaire
un syndrome adréno-génital (all. et angl. AGS) avec production massive d’androgènes au
niveau des glandes surrénales.
3.2 Aménorrhée secondaire
La cause la plus fréquente d’aménorrhée secondaire au cours de la phase reproductive de la
femme est évidemment la grossesse. C’est pourquoi il est indispensable d’effectuer un test de
grossesse avant de se lancer dans des investigations dispendieuses.
EGONEplus Troubles des règles et du cycle, aménorrhée 18 de 37
Nous savons que le fonctionnement normal des ovaires tant du point de vue hormonal en
général que de la capacité de procréer résulte d’un fonctionnement normal de l’axe
hypothalamo-hypophyso-ovarien:
La sécrétion pulsatile dans l‘hypothalamus, à un rythme d‘une et demie à plusieurs heures,
de la GnRH (hormone libérant les gonadotrophines) est la condition de base pour la
libération adéquate dans le lobe antérieur de l’hypophyse de FSH et LH. Ces deux
gonadotrophines, à leur tour, garantissent au niveau de l’ovaire la maturation harmonieuse
du follicule et de l’ovocyte et stimulent la sécrétion hormonale normale du follicule.
L’hypothalamus est le centre de contrôle dans lequel se décide si la fonction ovarienne se
déroule normalement ou non, càd s’il y a fertilité normale ou stérilité fonctionnelle. Il
représente le centre de contrôle neuro-endocrinien où convergent toutes les informations,
provenant de l’environnement extérieur, des organes déterminants pour le métabolisme
(tissu adipeux, foie, musculature, reins etc), des glandes endocriniennes et du système
nerveux central.
C’est dans l’hypothalamus où toutes ces informations neuronales, endocriniennes et
métaboliques sont analysées et interprétées pour être transformées en un signal neuro-
endocrinien envoyé au lobe antérieur de l’hypophyse. Ce signal est la sécrétion de GnRH.
Si les informations et signaux arrivant dans l’hypothalamus donnent des conditions
défavorables pour un aboutissement réussi d’une grossesse, la sécrétion pulsatile de la
GnRH est (plus ou moins) supprimée. Ces conditions défavorables peuvent être p.ex. un
stress de longue durée, une surcharge massive physique ou psychique, des réserves
d’énergie insuffisantes, càd un poids insuffisant (résultant p.ex. d’une mauvaise
alimentation ou d’une insuffisance rénale) ou au contraire une surcharge pondérale
excessive pour ne citer que ces quelques raisons. La fonction ovarienne ainsi perturbée
mène à une diminution réversible du potentiel de fertilité. L’organisme féminin, dans ces
conditions défavorables, se concentre sur la survie et met la reproduction en arrière-plan.
Ces formes d’aménorrhée, provoquées « depuis la centrale » (l’hypothalamus), sont
normo- ou hypogonadotropes. Ainsi on peut conclure qu’un taux normal ou bas de
gonadotrophines indique une forme d’aménorrhée qui se laisse rétablir si les causes la
provoquant sont corrigées ou éliminés.
En plus, des facteurs environnementaux et des maladies systémiques peuvent
endommager de manière directe la fonction ovarienne, plus précisément l’appareil folliculaire.
Citons p. ex. une chimiothérapie, la radiothérapie, la galactosémie ou des infections virales
(parotidite épidémique).
La conséquence est l’apparition d’une aménorrhée secondaire car l’appareil folliculaire est
endommagé – au pire des cas de manière définitive – et ne sécrète plus d’oestrogènes et
d’autres hormones sexuelles produites dans les follicules.
Ces formes d’aménorrhée sont hypergonadotropes: La sécrétion des gonadotrophines
hypophysaires LH et FSH ne subit aucun freinage, car il n’y a plus de production d’hormones
ovariennes (sexuelles et Inhibine) qui pourraient limiter la sécrétion des gonadotrophines par
rétro-contrôle (feed-back) négatif.
Les causes les plus fréquentes d’une aménorrhée (voire oligoménorrhée) secondaire
sont
Les troubles alimentaires provoquant un déficit pondéral important
Activité sportive excessive, surtout en combinaison avec une alimentation restrictive et un
poids insuffisant
Maladies systémiques et du métabolisme sévères
Situations de stress chronique, conditions de vie extrêmes, troubles psychogènes
Troubles du métabolisme des androgènes
Hyperprolactinémie ( 3.2.2.1)
EGONEplus Troubles des règles et du cycle, aménorrhée 19 de 37
3.2.1 Troubles ovariens
L’endocrinopathie la plus fréquente de la femme en âge fertile est le syndrome des ovaires
polykystiques (SOP ou SOPK) (all. et angl. PCO-S). A ce propos, comme pour les tumeurs
produisant des androgènes, -> cf scripte E04 Androgénisation et syndrome des ovaires
polykystiques.
3.2.1.1 Insuffisance ovarienne prématurée (all. Prämature
Ovarialinsuffizienz “POI”, angl. également “POI”, soit primary/premature
ovarian insufficiency)
Von parle d’insuffisance ovarienne prématurée - nommée également ménopause prématurée
ou climatère précoce (climacterium praecox), lorsque la ménopause survient avant l’âge de 40
ans révolus. (Note du traducteur: “ménopause précoce” serait la ménopause avant 45 ans, l’âge moyen de la
ménopause en Europe est actuellement de 51 ans).
Les principaux symptômes sont:
une aménorrhée secondaire s’installant avant l’âge de 40 ans révolus.
des taux de FSH élevés
des taux d’AMH abaissés et une stérilité (quasi toujours) irréversible.
L’insuffisance ovarienne prématurée touche environ 1 % de la population féminine.
L’insuffisance ovarienne prématurée est un tableau clinique aux causes
hétérogènes:
Deux tiers des femmes touchées ont eu une puberté tout à fait normale et au bon moment.
Par la suite, après des intervalles variables, elles développent une aménorrhée secondaire.
Une cause de plus en plus fréquente est la poly-chimiothérapie, grâce à laquelle un nombre
croissant de jeunes femmes survivent à leur maladie oncologique.
Env. 15 % des patientes signalent des cas dans la famille (facteur constitutionnel)
Env. 15% présentent des signes cliniques ou de laboratoire parlant pour une maladie voire
endocrinopathie auto-immune avec présence d’anticorps anti-ovariens. Dans ce contexte il
est indiqué de déterminer la glycémie à jeun (insuffisance pancréatique ?), la TSH
(hypothyroïdie primaire ?), le taux sérique de cortisol (insuffisance des surrénales ?) et les
facteurs rhumatismaux les plus importants (pour autant qu’une maladie auto-immune ne
soit pas déjà connue).
Dans moins de 10% il existe des défauts chromosomiques, p.ex. des mosaïques et des
anomalies de structure (surtout mosaïques de Turner ( 3.1.1.1). Parmi les causes
génétiques il convient de noter le syndrome du X fragile. Cette maladie se caractérise par
un retard intellectuel et une stérilité chez tous les déscendants masculins. Pour cette raison,
en cas de découverte d’un cas de ce syndrome dans la famille, toutes les femmes dans la
parentèle en âge de procréer devraient être incluses dans les investigations.
Env. 20% des patientes présentent une forme fluctuante: Des phases avec des cycles et
des taux de FSH normaux alternent avec des phases d’aménorrhée secondaire et des taux
de FSH élevés.
Une forme particulière et rare d’une ménopause prématurée est le « syndrome de
l’ovaire résistant », le (angl.) « Resistant-Ovary-Syndrome ». Il existe un défaut des
récepteurs de la FSH. Pour cette raison, les gonadotrophines sécrétées par l’hypophyse ne
produisent aucun effet dans l’organe cible, càd aucune maturation folliculaire dans l’ovaire.
En cas de „Resistant-Ovary-Syndrome“ – au contraire à toutes les autres causes de
ménopause prématurée citées auparavant - le décompte des follicules restants et le taux
d’AMH s’avèrent dans la norme.
Dans la plupart des cas, la cause de l’insuffisance prématurée des ovaires ne peut pas être
établie à l’aide de moyens cliniques simples.
Toutes ces causes d’insuffisance ovarienne prématurée ont en commun un taux de FSH
fortement élevé. Et, à l’exception du « syndrome de l’ovaire résistant », à l’examen
histologique, aucun follicule n’est retrouvé dans l’ovaire.
EGONEplus Troubles des règles et du cycle, aménorrhée 20 de 37
3.2.2 Troubles hypothalamo-hypophysaires
Les formes hypothalamo-hypophysaires d’une aménorrhée secondaire se caractérisent par
des taux de FSH et LH normaux voire abaissés.
Toutes les causes d’aménorrhée primaire exposées au chapitre 3.1.2 peuvent également être
responsables d’une aménorrhée secondaire, à l’exception du syndrome de Kallmann.
La plupart des aménorrhées secondaires hypothalamo-hypophysaires sont induites
par le stress. « Stress » dans ce contexte est entendu au sens le plus large du terme
(maladies consomptives, poids fortement insuffisant (IMC < 18, anorexie nerveuse),
changement très rapide de la corpulence, stress psychologique professionnel ou privé ou
surmenage physique en cas d’activité sportive de haut niveau). En règle générale, une
composante héréditaire-constitutionnelle doit s’ajouter à ce stress afin que le symptôme
aménorrhée se développe.
Chez les sportives de très haut niveau peut se produire ce qu’on appelle la „Female Athlete
Triad“ (surtout course à pied sur de longues distances, danse classique et gymnastique). Cette
triade comporte des troubles alimentaires, l’ostéoporose et l’aménorrhée. L’aménorrhée dans
cette constellation est le résultat de la surcharge de l’organisme par le stress de la compétition
chronique et la réduction souvent massive du tissu graisseux (surtout dans les sports
d’endurance exercés à un niveau très pointu).
Une deuxième cause fréquente pour une aménorrhée hypothalamo-hypophysaire sont les
médicaments qui abaissent, directement ou indirectement, la sécrétion des gonadotrophines.
Exemples d’inhibiteurs directs: GnRH-analogues
Gestagènes FSH
Anabolisants
Exemples d’inhibiteurs indirects: Neuroleptiques
Antidépresseurs
Prolactine
Antiémétiques
FSH
Antihypertenseurs
Antihistaminiques
3.2.2.1 Hyperprolactinémie
Une augmentation du taux sérique de prolactine est physiologique:
Pendant la grossesse. Les taux de prolactine augmentent continuellement pendant toute la
durée de la grossesse. Ceci est la conséquence de l’effet croissant des oestrogènes sur
l’hypophyse et de le production placentaire de prolactine. La taille de l’hypophyse augmente
de 20 – 30 % pendant la grossesse pour redevenir normale après la fin de la période
d’allaitement.
Pendant l’allaitement. Les taux de prolactine, en diminution après l’accouchement,
augmentent pendant la succion de manière ponctuelle et courte. Par la succion, le
nourrisson stimule la production de lait chez la mère.
Autres stimuli physiologiques:
o Manipulation de la glande mammaire
o Succion
o Orgasme
o Hyperprolactinémie en relation avec la nuit et le sommeil
EGONEplus Troubles des règles et du cycle, aménorrhée 21 de 37
Une cause fréquente d’hyperprolactinémie pathologique est une série de troubles fonctionnels.
Des causes plus rares sont des tumeurs de l’hypophyse ou situées à proximité.
Les principaux symptômes et conséquences (non obligatoirement présents) d’une
hyperprolactinémie sont les suivants:
Galactorrhée bilatérale (= écoulement spontané, pas à confondre avec un écoulement à la
pression)
Troubles du cycle d’intensité variable (insuffisance du corps jaune, oligoménorrhée,
aménorrhée normo- ou hypogonadotrope avec ou sans déficit oestrogénique)
Tendance à l’ostéoporose (en cas d’hyperprolactinémie chronique avec déficit
oestrogénique)
Causes fréquentes d’une hyperprolactinémie
Prolactinome
Tumeurs extra-sellaires avec compression du pédicule hypophysaire (p.ex.
craniopharyngiome ou ménigiome)
Lésion traumatique du pédicule hypophysaire (post accident)
Stress de tout genre
Stimuli physiologiques
o Manipulations du sein
o Succion
o Orgasme
o Hyperprolactinémie en relation avec le sommeil
o Grossesse
Autres causes
o Consommation de bière
o Alimentation riche en protéines
o De nombreux médicaments, notamment des psychotropes, anti-émétiques et
préparations contenant des oestrogènes
Un taux sérique de prolactine de < 50 µg/L (ou moins que le double de la limite supérieure
de la norme) parle nettement contre la présence d’un prolactinome.
La tumeur la plus fréquente de l’hypophyse est l’adénome hypophysaire produisant de la
prolactine, nommée prolactinome.
Les principaux symptômes du prolactinome
Galactorrhée bilatérale
Troubles du cycle, le plus souvent oligo- ou aménorrhée secondaire
Stérilité
Prolactinémie > 50 µg/L
Des symptômes facultatifs du prolactinome
Troubles visuels
Céphalées
Conséquences d’un manque d’oestrogènes, p.ex. ostéoporose
Diminution de la libido
Le diagnostic est assuré par la résonance magnétique (IRM) de l‘hypophyse.
En cas d’un diamètre de moins de 10 mm on parle de microprolactinome. Les tumeurs plus
grandes sont des macroprolactinomes.
En général, les microprolactinomes ont une croissance très lente. Par contre, les
macroprolactinomes grandissent très rapidement. Ils compriment assez facilement le chiasma
optique qui se situe juste au-dessus de la selle turcique. De ce fait, des déficits du champ visuel
temporal se produisent.
EGONEplus Troubles des règles et du cycle, aménorrhée 22 de 37
Mise en évidence par IRM d’un
prolactinome
( toutes les illustrations, avec commentaires,
dans la galerie d’images sous „Appliquer“)
Aussi des tumeurs extra-sellaires comme le craniopharyngiome ou le méningiome peuvent
mener à une hyperprolactinémie, même si elles ne produisent pas cette hormone. Le
mécanisme est le suivant: En comprimant le pédicule hypophysaire, elles empêchent l’arrivée de
la dopamine en provenance de l’hypothalamus avec comme conséquence la sécrétion accrue de
prolactine dans l’hypophyse.
En cas de diagnostic fortuit d’hyperprolactinémie sans symptômes cliniques correspondants, la
possibilité de formation de macroprolactine doit être envisagée. Il s’agit-là de grands
agrégats moléculaires composés de prolactine et d’IgG. Ces complexes n’ont pas d’effet
clinique, mais les analyses de laboratoire modernes risquent de les méprendre pour de la
prolactine normale, vu leur identité immunologique avec la prolactine. La « précipitation au PEG
(polyéthylène glycol) » permet de différencier les deux formes de prolactine (all : die
sogenannte PEG-Ausfällung).
Les investigations d’une hyperprolactinémie doivent toujours inclure une détermination du
taux de TSH. Le recours à une imagerie (IRM) afin de confirmer ou d’exclure la présence d’un
prolactinome ne se justifie en général qu’en cas de constat répété de taux de prolactine
nettement élevés (> 50 µg/L) ou si des symptômes cliniques (p.ex. nouvelle apparition de
céphalées ou défauts du champ visuel) exigent la représentation de la région de l’hypophyse.
La thérapie de premier choix est l’administration de médicaments agonistes de la dopamine.
Un traitement chirurgical est à envisager
en présence d’un macroprolactinome
si les taux sériques de prolactine ne diminuent pas
si les médicaments dopaminergiques (agonistes de la dopamine) ne sont pas tolérés
Nota bene: toute hyperprolactinémie ne doit pas forcément être prise en charge par
médicaments ou chirurgie
Indications pour un traitement par un inhibiteur de la prolactine (= agoniste de la dopamine):
le prolactinome
une galactorrhée dérangeante
pour obtenir un cycle ovulatoire optimal (traitement de stérilité) en cas de perturbations du
cycle à cause d’une hyperprolactinémie
Si en cas d’hyperprolactinémie, l’anomalie du cycle est la seule motivation pour un traitement
(aucun désir de grossesse actuelle), l’administration cyclique d’un gestagène ou le traitement
combiné oestro-progestatif peut être suffisant (cf 3.4).
Dans tous les cas, il est impératif de déterminer à intervalles réguliers la prolactine pour
surveiller le taux d’hyperprolactinémie et/ou le succès de la thérapie instaurée pour faire baisser
la prolactinémie.
EGONEplus Troubles des règles et du cycle, aménorrhée 23 de 37
3.2.2.2 Le syndrome de Sheehan
Décrit dans de nombreux ouvrages, le syndrome de Sheehan (Hypopituitarisme postpartal)
ne s’observe pratiquement plus sous nos latitudes et dans les pays avec un système de santé
efficace et une prise en charge obstétricale des parturientes moderne.
Ce syndrome décrit la perte totale (panhypopituitarisme) ou partielle (de toutes ou de parties
des fonctions) du lobe antérieur de l’hypophyse maternelle par mort cellulaire. Cette mort est le
résultat d’une nécrose de l’hypophyse par ischémie consécutive aux pertes sanguines massives
de la mère sub partu.
Mesures diagnostiques en cas de suspicion de syndrome de Sheehan
Vérification des fonctions partielles du lobe antérieur de l’hypophyse (adénohypophyse) à
l’aide de tests endocriniens spécifiques (à déléguer aux spécialistes).
Thérapie du syndrome de Sheehan
Selon indication, thérapie de substitution hormonale par de la L-Thyroxine, des gluco- et
minéralo-corticoïdes, des préparations oestrogéniques ou oestro-progestatifs combinées
(cf chapitre 3.4)
En cas de désir de grossesse, thérapie de stimulation à l’aide de gonadotrophines
(E5 Stérilité)
3.2.3 Causes utérines d’une aménorrhée secondaire
Une cause utérine d’aménorrhée secondaire ne provoque aucune autre perturbation de la
femme: Le phénotype est féminin normal, la puberté s’était déroulée normalement, les
caractères sexuels secondaires sont normalement développés. Un diagnostic hormonal est
inadéquat dans cette circonstance.
Notons d’abord le status après hystérectomie, sans que ce tableau ne représente de maladie
dans le sens stricte. La pathologie utérine la plus fréquente à provoquer une aménorrhée
secondaire ou une hypoménorrhée est le syndrome d’Asherman.
3.2.3.1 Le syndrome d‘Asherman
Causes
Lésion mécanique locale ou destruction complète de l’endomètre par des (un ou plusieurs)
curetages appuyés, surtout après grossesse (p.ex. après placenta accreta ou increta). Ces
dégâts sont le plus souvent irréversibles.
Infections intra-utérines (p.ex. tuberculose – de nos jours rare en Europe central). Les
lésions en découlant sont le plus souvent irréversibles.
Indice / suspicion
Une hypo- voire aménorrhée secondaire qui apparaît après un ou plusieurs curetages,
surtout s’ils sont effectués après un accouchement.
Mesures diagnostiques
En présence d’indices anamnestiques (p.ex. apparition d’une hypoménorrhée voire aménorrhée
après curetage, surtout dans la période postpartale) parlant pour un dommage délimité dans
l’endomètre chez une patiente avec désir de grossesse, un diagnostic hystéroscopique s’impose.
La visualisation pendant l’hystéroscopie de synéchies intrautérines prouve le syndrome
d’Asherman. L’hystéroscopie permet en plus d’en apprécier l’étendu et de se prononcer sur les
chances thérapeutiques.
EGONEplus Troubles des règles et du cycle, aménorrhée 24 de 37
Hystéro-salpingographie Hystéroscopie
La cavité utérine présente des irrégularités Cavité utérine avec une adhérence entre la
persistantes provoquées par des adhérences paroi antérieure et postérieure (flèche)
Thérapie
L’objectif est de de sectionner les adhérences intrautérines par hystéroscopie et de prévenir la
formation de nouvelles adhérences par l’insertion temporaire d’un DIU (dispositif intrautérin,
stérilet). En parallèle, par un traitement médicamenteux oestrogénique, on essaie de refaire
proliférer l’endomètre restant. Ces traitements appartiennent aux spécialistes. Le taux de succès
(en terme de grossesses) dépend de la gravité d’endommagement de l’endomètre. Lors d’une
grossesse après lyse de synéchies une complication typique est le placenta accreta ou praevia.
3.2.4 Causes extra-génitales d’une aménorrhée secondaire
En principe, les causes sont les mêmes que pour les aménorrhées primaires.
3.3 Investigations en cas d‘aménorrhée
Le premier diagnostic différentiel d’une aménorrhée est la grossesse. Il est donc
impératif de l’exclure ou de la vérifier dès le début. De ce constat et du fait de la multitude de
raisons pouvant causer une aménorrhée découle l’importance d’une anamnèse soigneuse et
fouillée. L’anamnèse détaillée et le status clinique et gynécologique obligatoires permettent dans
la majorité des cas d’établir un diagnostic supposé, qui par la suite, très souvent se confirme
pour devenir le diagnostic définitif.
Les points les plus importants du status général sont
Vérification des proportions corporelles. Recherche de stigmates pouvant indiquer une
dysgénésie gonadique (le plus souvent accompagnée d’une aménorrhée primaire)
Signes d’androgénisation: alopécie, acné, séborrhée, hypertrichose / hirsutisme, acanthosis
nigricans
Etat de développement de la pilosité axillaire et pubienne, développement des glandes
mammaires, palpation des seins et des creux axillaires.
Font partie intégrante de l’examen clinique initial
L’inspection et la palpation
Une échographie du petit bassin (forme et taille de l’utérus, présence de myomes?,
épaisseur de l’endomètre. Taille des ovaires, présence de follicules, épaisseur du stroma
ovarien, signes de SOP (ou SOPK) (syndrome des ovaires polykystiques). Positionnement
des reins).
EGONEplus Troubles des règles et du cycle, aménorrhée 25 de 37
L’analyse hormonale a les deux objectifs suivants
Situer le niveau de la cause de l’aménorrhée:
A) Niveau hypothalamus-hypophyse (= pronostic plutôt bon en terme de stimulation
ovarienne ou induction d’ovulation, = taux de FSH normal ou bas).
B) Niveau ovarien ( = mauvais pronostic, = taux de FSH élevé).
Recherche de la cause de l’aménorrhée:
o La détermination hormonale comporte à côté du taux de FSH (et év. LH) la
détermination de la prolactine, de la TSH et de la testostérone.
Le diagnostic de base en cas d’aménorrhée secondaire comporte également la
détermination de l’activité oestrogénique: A l’échographie l’épaisseur et la structure (les
trois lignes) de l’endomètre, à l’examen clinique la glaire cervicale aqueuse et filante et
surtout le test aux gestagènes positif.
Les investigations de base en cas d‘aménorrhée
1. exclure une grossesse (!)
2. Anamnèse détaillée
o Médicaments, stress, habitudes alimentaires, chimio- / radiothérapie
3. Examen clinique général et status gynécologique
o Vérification des proportions corporelles, recherche de stigmates pouvant indiquer une
dysgénésie gonadique (à suspecter surtout en cas d’aménorrhée primaire)
o Indice de la masse corporelle (IMC), (BMI = Body Mass Index)
o Signes d’androgénisation, p.ex. alopécie androgénétique, acné, séborrhée,
hypertrichose / hirsutisme
o Stade de développement des seins, de la pilosité pubienne et axillaire. Mise en
evidence / exclusion d’une galactorrhée. Palpation des glandes mammaires et des
creux axillaires. Organes génitaux externes, taille du clitoris, vagin, col utérin
(sécrétions ?)
4. Echographie vaginale
o Forme et taille de l’utérus, épaisseur de l’endomètre, fibromes? Taille des ovaires?
Présence de follicules? Epaisseur du stroma ovarien ? Evidence / absence de signes de
SOP (SOPK) ? Localisation des reins.
5. Analyse hormonale de base
o FSH, Prolactine, TSH, Testostérone, (Estradiol = E2)
6. Test aux gestagènes
o 3.3.1
D’autres investigations et des tests fonctionnels sont du domaine du médecin spécialiste
(homme ou femme)
La mise en évidence de valeurs hormonales hors norme a des conséquences sur le diagnostic
différentiel élargi, sur le pronostic et la prise en charge thérapeutique.
Exemples
Taux de FSH élevé (= taux hypergonadotrope de FSH) = problème ovarien primaire.
Absence de follicules se laissant stimuler. Mauvais pronostic de fertilité, déficit également en
oestrogènes possible et même probable.
Hyperprolactinémie = aménorrhée hyperprolactinémique. A signaler qu’en cas
d‘hyperprolactinémie modérée (taux de 15 – 40 µg/L) le taux de prolactine peut être la
cause ou un phénomène annexe de l’aménorrhée. Des taux de prolactine de > 50 µg/L
imposent d’exclure un adénome de l’hypophyse – s’il n y a pas d’autres causes évidentes
(p.ex. irritation chronique de la glande mammaire ou prise de médicaments ( 3.2.2.1).
Taux de TSH pathologiquement élevé ou abaissé:
o Diagnostic différentiel élargi de la fonction thyroïdienne par le spécialiste.
o Une hypothyroïdie primaire induit très souvent une hyperprolactinémie. Elle
s’accompagne souvent d’une aménorrhée hypothalamo-hypophysaire.
Taux de testostérone pathologique = diagnostic élargi:
o Un taux de testostérone élevé est l’expression d’une sécrétion augmentée dans les
ovaires (p.ex. syndrome des ovaires polykystiques) ou des glandes surrénales (p.ex. en
cas de forme pour la plupart légère de syndrome adréno-génital).
EGONEplus Troubles des règles et du cycle, aménorrhée 26 de 37
Taux élevé de DHEA-S (sulfate de déhydroépiandrostérone): est l’expression d’une
surproduction dans les glandes surrénales, ce qui se rencontre dans les différentes formes
de syndrome adréno-génital.
3.3.1 Test aux gestagènes
Le but du test aux gestagènes est de vérifier l’activité oestrogénique ovarienne et la
fonction de l’endomètre en cas d’aménorrhée.
S’il existe une production endogène suffisante d’oestrogènes et de ce fait une prolifération de
l’endomètre, l’administration d’un gestagène (pendant 10 à 14 jours à une dose dite „de
transformation“) aboutira à une transformation sécrétoire de l’endomètre. Par la suite, l’arrêt du
gestagène entraîne une hémorragie de privation. Un test aux gestagènes positif, soit un
saignement vaginal 2 à 10 jours après l’arrêt du médicament progestatif permet de conclure à
une activité endogène d’oestrogènes suffisante. Dans le cas contraire, l’imprégnation
oestrogénique est insuffisante pour la prolifération de l’endomètre et probablement aussi pour le
maintien de la masse osseuse. Le test aux gestagènes est aussi négatif en cas de défaut
anatomique génital, le plus souvent utérin (dégât mécanique, p.ex. après destruction de
l’endomètre suite à des curetages appuyés).
Exécution pratique du test aux gestagènes
1. Exclusion d’une grossesse
2. Par voie orale, prise de 10 mg/jour de Prodafem® (acétate de medroxyyprogestérone)
pendant 10 jours
Interprétation du test aux gestagènes:
"Positif"
= saignement vaginal 2 à 10 jours Conclusion
après l’arrêt du gestagène production d’oestrogènes endogène suffisante
"Négatif"
= absence de saignement vaginal Conclusion
production d’oestrogènes endogène insuffisante
ou
pathologie anatomique (le plus souvent au
niveau utérin)
Si le test aux gestagènes est négatif, on doit enchainer avec un test combiné oestro-
progestatif (nommé souvent simplement test aux oestrogènes) afin de différencier une
problématique fonctionnelle hormonale d’un problème anatomique.
Lors du test aux oestrogènes, en plus du gestagène, un oestrogène est administré ce qui fait
proliférer l’endomètre (p.ex. 1 EO de Microgynon 50®). En présence d’un endomètre intacte et
de voies d’écoulement normales perméables, à la fin d’un cycle de traitement, un saignement
par voie vaginale de sang menstruel (hémorragie de privation) se produit dans les 2 à 10 jours
(test aux oestrogènes positif). Si le test aux oestrogènes reste négatif, on doit chercher des
problèmes anatomiques (p.ex. atrophie de l’endomètre, atrésie hyménale, absence de l’utérus,
syndrome MRKH ou autre).
3.3.1 Schémas d’investigations en cas d‘aménorrhée
Nota bene : Les schémas reproduits ci-après ne visualisent que les causes principales
d’aménorrhée. Les investigations nécessaires pour exclure toutes les causes possibles
d’aménorrhée sont bien plus complexes.
EGONEplus Troubles des règles et du cycle, aménorrhée 27 de 37
EGONEplus Troubles des règles et du cycle, aménorrhée 28 de 37
EGONEplus Troubles des règles et du cycle, aménorrhée 29 de 37
3.4 Thérapie de l‘aménorrhée
Le traitement de l’aménorrhée peut se faire sous deux angles de vue:
1. Présence ou non d’une maladie ou d’un trouble responsable de l’absence de règles qui
serait accessible à un traitement ? (= thérapie causale).
2. La patiente, au moment de décider d’un traitement, envisage-t-elle une grossesse ou non ?
La réponse à cette question indique, s’il s’agit pour le thérapeute d’essayer d’obtenir au
mieux une fonction ovulatoire de l’ovaire ou s’il peut se contenter d’éviter des
conséquences négatives de l’aménorrhée (autres que l’anovulation) pour la patiente. Parmi
ces conséquences négatives comptent surtout les effets du manque d’oestrogènes sur
beaucoup d’organes de la femme (= thérapie symptomatique).
Ad 1: Il n’est pas nécessaire de traiter tous les cas où la maladie sous-jacente est accessible à
un traitement. Par exemple, chaque microprolactinome (prolactinome avec un diamètre de <
10 mm) n’est pas soumis à l’opération. Le risque opératoire et la difficulté technique de
l’intervention comparés à la tendance à la croissance souvent lente de ces tumeurs paraissent
trop grands.
Ad 2 : Par contre, vu l’hyperprolactinémie, ces patientes sont en général en aménorrhée et
souffrent souvent d’un déficit en oestrogènes. Dans ces cas, la réponse à la question No 2
devient importante : Doit-on viser, à l’aide d’un traitement au long cours, avec un inhibiteur de
la prolactine, la normo-prolactinémie avec la restitution d’un cycle ovulatoire (ce qui en même
temps élimine le déficit en oestrogènes) ? Ou peut-on se contenter de proposer un traitement
chronique peu dosé oestrogénique ou oestro-progestatif combiné ? Dans ce dernier cas de
figure, on renonce au traitement de l’hyperprolactinémie (sauf si une galactorrhée importante
provoquée par la prolactine élevée fait souffrir la patiente).
En cas d’hypothyroïdie par contre, qui peut provoquer une hyperprolactinémie et une
aménorrhée, le traitement à l’aide de L-thyroxine doit toujours être curatif et rétablir l’équilibre
euthyroïdien. La thérapie doit être permanente, car une hypothyroïdie a des effets néfastes sur
une multitude d’organes et de fonctions de notre corps. On doit contrôler si le traitement de
substitution élimine tous les effets directs et indirects du manque de thyroxine.
EGONEplus Troubles des règles et du cycle, aménorrhée 30 de 37
En général, la prescription de L-thyroxine rétablit assez bien les effets négatifs de
l’hypothyroïdie sur l’état général. Mais elle ne corrige pas dans tous les cas l’hyperprolactinémie
« d’accompagnement » et l’aménorrhée. On doit dès lors décider au cas par cas si d’autres
mesures, p.ex. une substitution en oestrogènes, doivent être appliquées ou non.
Les principes de base de la prise en charge en cas d’aménorrhée peuvent se résumer
comme suit:
Désir actuel de grossesse présent
Avant toute thérapie visant à obtenir une grossesse, le médecin doit s‘assurer que la maman et
son futur bébé pourront supporter la grossesse sans courir de gros risques de santé.
A défaut d’une thérapie curative, la maturation folliculaire doit être stimulée:
1. Aménorrhée normogonadotrope: La sécrétion endogène de FSH peut être stimulée à
l’aide de Clomifène (informations détaillées sur ce traitement: E5 Stérilité). La FSH peut
être administrée directement ( E5 Stérilité). On peut également avoir recours à
l’application pulsatile de GnRH (traitement élégant, mais hautement spécialisé). CAVE: les
stimulations par Clomifène ou FSH portent le risque d’hyperstimulation et de grossesse
multiple. Dès lors, le médecin les pratiquant doit être bien formé et expérimenté.
2. Aménorrhée hypogonadotrope: La stimulation à l’aide de la FSH est indiquée, dans
certains cas aussi le traitement pulsatile à la GnRH. Le traitement au Clomifène est inutile,
car des réserves de FSH dans l’hypophyse manquent.
3. Aménorrhée hypergonadotrope: Elle se caractérise par des taux élevés de FSH et LH, et
souvent aussi par un hypo-oestrogénisme. En règle générale, une ovulation ne se laisse pas
déclencher, car des follicules stimulables manquent. De très rares grossesses spontanées
lors d’aménorrhée hypergonadotrope ont été observées. Ceci ne change en rien le pronostic
très sombre en cas de taux de FSH élevés. La seule thérapie possible dans ce cas de figure
est le don d’ovocytes (interdit en Suisse).
Désir actuel de grossesse absent
Dans ce cas de figure, il n’est pas nécessaire de provoquer l’ovulation. Les thérapies de
stimulation ovarienne décrites ci-dessus ne sont pas indiquées (d’une part, elles n’agissent que
sur le cycle en cours et d’autre part, elles demandent un investissement médical important,
portent certains risques et sont coûteuses).
Le but de la prise en charge en cas d’absence de désir de grossesse est d’éviter des
conséquences néfastes à long terme de l’aménorrhée.
Si une thérapie causale fait défaut, on doit substituer, selon le degré de gravité de
l’aménorrhée, les stéroïdes ovariens, càd la progestérone (en cas de test aux gestagènes positif)
ou même la progestérone et les oestrogènes (en cas de test aux gestagènes négatif ->
traitement oestro-progestatif combiné). S’il existe une demande de contraception, la thérapie de
substitution peut facilement se faire à l’aide d’une pilule combinée. Dans tel cas, et en présence
d’un manque d’oestrogènes, les pilules bien dosées en oestrogènes (càd ≥30µg EE) ou des
produits à base d’oestrogènes naturels devraient être choisis (p.ex Qlaira ® , Zoely® ).
Si la femme porte toujours son utérus, l’exposition de longue durée aux oestrogènes seuls
augmente le risque de dégénération maligne de l’endomètre. Pour cette raison, la thérapie de
substitution doit être contrebalancée par un gestagène protégeant l’endomètre. Si l’utérus
manque, la situation change: l’effet protecteur des gestagènes n’est plus nécessaire et une
monothérapie aux oestrogènes est suffisante (p.ex. Estrofem N ® , 2mg par jour en continu).
Pour la thérapie de substitution, on n’emploie presque jamais la progestérone naturelle,
mais ses dérivés (p.ex. Dydrogestérone, Duphaston® ) ou des dérivés de la 17--hydroxy-pro-
gestérone (p. ex. acétate de cyprotérone, Climen® ) ou des dérivés de la 19-nortestostérone
(acétate de norethistérone, Primolut N® ).
EGONEplus Troubles des règles et du cycle, aménorrhée 31 de 37
La progestérone, en particulier par voie orale, développe souvent un effet sédatif et manque
d’un contrôle du cycle suffisant. Une compliance insuffisante en est la conséquence. Les dérivés
susmentionnés n‘ont pas ces inconvénients.
L‘acétate de cyprotérone a un effet anti-androgène, qui est souvent utile pour la thérapie,
mais qui entraîne aussi une baisse de la libido. Son indication de choix est l‘aménorrhée avec
hyperandrogénie.
A l’inverse, le dérivé de la testostérone, l’acétate de norethistérone, possède une action
partielle androgénique qui peut se manifester sous forme d’acné et/ou de séborrhée.
Pour la thérapie oestrogénique on utilise de préférence l’oestradiol naturel (p.ex.
Estrofem N®). La question de savoir si les doses de l’œstrogène artificiel (Ethynylestradiol, EE),
contenu dans les pilules contraceptives combinées classiques, sont suffisantes pour le
développement et le maintien de la masse osseuse, n’est pas définitivement close. En cas de
manque d’oestrogènes, avec un test aux gestagènes négatif, les doses journalières ne devraient
pas être inférieures à 2 mg pour l’oestradiol (E2) et 30 µg pour l’EE.
Thérapie:
Traitement curatif, en fonction de la maladie de base
Si impossible (et l’utérus en place):
o 1. Hypogonadotropie:
Inhibiteurs de l‘ovulation (≥ 30µg EE ou produit avec E2) ou traitement de
substitution séquentielle oestroprogestative (2mg E2; p.ex. Cyclacur ®).
o 2. Normogonadotropie:
Test aux gestagènes positif: Inhibiteurs de l’ovulation ou régulation du cycle avec
un progestatif dans la deuxième phase (p.ex. Prodafem® 10mg, du 16me au 25me
jour du cycle)
Test aux gestagènes négatif, mais test oestroprogestatif positif : inhibiteurs de
l’ovulation (avec ≥ 30µg EE ou contenant de l’E2) ou traitement hormonal
oestroprogestatif séquentiel (avec 2mg d’E2, p.ex. Cyclacur®).
o 3. Hypergonadotropie:
inhibiteurs de l’ovulation (avec ≥ 30µg EE ou contenant de l’E2) ou traitement
hormonal oestroprogstatif séquentiel (avec 2mg d’E2, p.ex. Cyclacur ®).
LE SYNDROME PREMENSTRUEL (SPM)
Le syndrome prémenstruel se caractérise par l’apparition de phénomènes physiques et
psychiques pénibles (!), typiquement quelques jours avant les règles, qui disparaissent de
nouveau spontanément au début des saignements.
Définition des termes
Dans la littérature on peut trouver le syndrome prémenstruel (SPM) différencié de sa forme la
plus grave, le « PMDD » (de l’anglais „premenstrual dysphoric disorder“ ). Ce tableau clinique a
été défini lors d’une conférence de consensus au milieu des années 80 du siècle passé aux Etats
Unis. Il s’agit d’un syndrome prémenstruel sévère avec composante dépressive majeure.
Ci-après les critères nécessaires définissant une symptomatologie (physique,
psychique et comportementale) induite par le cycle féminin:
Le symptôme apparaît de manière répétée dans une phase spécifique du cycle menstruel (le
plus souvent dans les jours ou la dernière semaine précédant les règles, mais la durée est
parfois plus longue).
Le symptôme disparaît au plus tard au 4me jour du nouveau cycle.
Le symptôme génère une souffrance et limite la femme dans ses activités quotidiennes.
EGONEplus Troubles des règles et du cycle, aménorrhée 32 de 37
Pour pouvoir poser le diagnostic d’un PMDD (syndrome prémenstruel sévère, cf ci-dessus), en
accord avec la conférence de consensus citée, les conditions suivantes doivent être remplies:
Présence dans la phase lutéale d’au moins 5 symptômes typiques – dont 1 au moins doit
concerner l’état d’humeur
Un journal doit être mené pendant au moins 2 mois décrivant l’intensité et le genre des
symptômes. Il doit permettre d’attribuer la symptomatologie à la phase lutéale du cycle.
La symptomatologie doit affecter la femme dans son bien-être et diminuer sa capacité de
gérer les activités du quotidien.
Les symptômes présents ne doivent pas s’expliquer par une maladie psychiatrique
préexistante.
Les experts s’accordent pour dire que la totalité des symptômes typiques du SPM sont
provoqués par les fluctuations des hormones stéroïdiennes sexuelles et qu’ils disparaissent avec
l‘arrêt du cycle hormonal.
Ceci ne signifie pas que tous les phénomènes observés suivent le même mécanisme patho-
génétique. Ceci ne veut pas dire non plus qu’il existe une voie thérapeutique hormonale
garantie de succès.
Prévalence
La plupart des études prospectives et retrospectives au sujet du syndrome prémenstruel citent
une prévalence de 5 à 8 %, càd présence de symptômes manifestes voire sévères chez des
femmes avec un cycle spontané. Des experts estiment pourtant que jusqu’à 20% des femmes
présentent des symptômes que l’on jugerait cliniquement significatifs.
Il existe une multitude de symptômes, dont les plus fréquents sont les suivants:
humeur dépressive et dysphorie
timidité, angoisse, appréhension
estime de soi diminuée
labilité affective (p.ex. pleurs ou rires sans raison)
irritabilité, agressivité
sauts d’humeur (labilité d’humeur)
prise de poids par rétention d‘eau
mastodynie (mastalgie) : tensions mammaires ou enflure douloureuse, sensibilité extrême
au toucher des seins ou des mamelons
D’autres symptômes typiques sont:
adynamie
difficultés de concentration
hyperactivité, agitation
dépressions ou phases maniaques
fringales intempestives
insomnie ou besoin exagéré de dormir
Fatigue, se sentir abattue, épuisement
nausées, problèmes circulatoires (vertiges, orthostase)
ballonnements, sensation d’estomac plein
crampes au bas ventre
mal à la tête et mal au dos
douleurs articulaires et musculaires
sensibillité accrue pour des stimuli externes (lumière, toucher, bruit, odeurs, pression par le
temps et le travail)
migraine
dyspareunie (douleurs au bas ventre et aux organes génitaux lors de rapports sexuels).
Cave
Envisager lors du diagnostic différentiel d’autres origines plausibles des symptômes, p.ex.
Douleurs au bas ventre et dyspareunie. DD: endométriose, myofibromes, d’autres processus
locaux.
Angoisse, irritabilité, dépression etc: maladies psychiatriques augmentées par le syndrome
prémenstruel
épilepsies
migraine
EGONEplus Troubles des règles et du cycle, aménorrhée 33 de 37
La plupart des auteurs n’associent pas les maux de tête prémenstruels, les migraines et
l’épilepsie au SPM, mais les considèrent comme maladies indépendantes.
On identifie des comorbidités à l’aide du journal des symptômes (mené au minimum pendant 2
mois ou 2 cycles), de l’anamnèse ciblée et l’examen clinique.
Les femmes avec SPM, comparées aux autres, souffrent plus souvent de maladies dépressives
(en général tout comme au post-partum et en période de péri- et postménopause).
Etiologie et physiopathologie
Malgré de nombreuses études, un mécanisme physiopathologique uniforme n’a pas pu être
identifié.
Le SPM (PMDD) ne se manifeste que pendant les années fertiles de la femme et dans la
deuxième phase du cycle. Toutefois, les taux d’oestradiol et de progestérone et leurs
fluctuations caractéristiques durant le cycle sont identiques chez les femmes atteintes et les
autres. Pour ces raisons on retient actuellement l’hypothèse d’une réponse psychosomatique
anormale à des changements endocriniens physiologiques pendant le cycle menstruel.
La suppression (ou l’arrêt) des fluctuations cycliques des taux d’hormones sexuelles
stéroïdiennes, à l’aide d’inhibiteurs de l’ovulation, d’analogues de la GnRH, pendant la grossesse
et après la ménopause élimine en grande partie la symptomatologie. Ceci indique une différence
de réactivité des centres du système nerveux central (SNC) envers les changements des taux
d’hormones sexuelles pendant le cycle chez les femmes avec ou sans SPM.
Ceci est probablement aussi vrai pour le seuil de tolérance à la douleur (en cas p.ex. de
douleurs gastro-intestinales et du bas ventre, de douleurs musculaires ou articulaires et
d’exacerbation de maux de tête).
Vu que la labilité d’humeur et les changements du comportement sont les principaux
symptômes d’un SPM, le SNC en tant qu’organe cible pour les hormones sexuelles (et leurs
métabolites) occupe une place centrale dans l’explication de l’étiologie du SPM. Ceci est vrai en
particulier pour le neurotransmetteur sérotonine et le système sérotoninergique. La sérotonine
joue un rôle important dans la régulation de l’état d’humeur et de l’agressivité et exerce un effet
modulateur sur les hormones stéroïdiennes sexuelles dans le SNC.
Un autre neurotransmetteur, le GABA (acide γ-aminobutyrique) jouerait également un rôle dans
la pathogenèse du SPM.
Options thérapeutiques
Avant d’entamer un essai thérapeutique, on doit assurer, par l’anamnèse soigneuse ( E7B ),
l’interprétation à leur juste valeur de toute une série de symptômes pouvant appartenir à bien
d’autres maladies.
La multitude de questions ouvertes concernant l’étiologie et la physiopathologie du SPM( E7B)
se reflète dans le grand nombre de propositions thérapeutiques ( E7B ).
Les inhibiteurs (sélectifs) de la recapture de la sérotonine (ISRS) (angl. SSRI = selective
serotonin reuptake inhibitors) sont prouvés d’efficacité. Ces médicaments sont des
antidépresseurs qui agissent via les récepteurs pour la sérotonine. Ils augmentent la quantité de
sérotonine dans le liquide tissulaire du cerveau.
Font partie de ce groupe de médicaments:
Clomipramin Citalopram Escitalopram Sertralin
Anafranil® Seropram® Cipralex® Zoloft®
Fluoxetin Paroxetin Paroxetin CR Venlafaxin
Fluctine® Deroxat® actuellement pas Efexor®
disponible en
Suisse
Effets des ISRS
Ils réduisent chez 60 à 90 % des femmes souffrant de SPM les symptômes psychiques et
physiques. Ils améliorent la qualité de vie et l’aptitude à établir des contacts sociaux.
Pour la plupart des auteurs ils représentent les médicaments de premier choix pour les cas
de graves états de dysphorie lors de PMDD.
EGONEplus Troubles des règles et du cycle, aménorrhée 34 de 37
Effets secondaires des ISRS
Ils sont le plus souvent légers: sécheresse buccale, nausée, suragitation, sédation et
diminution de la libido, anorgasmie.
Essais thérapeutiques hormonaux
La prescription d’inhibiteurs de l’ovulation (pilule combinée), dans la majorité des études
effectuées, n’a pas produit le succès thérapeutique désiré, à l’exception peut-être des pilules
contenant la drospirénone, un gestagène à effet partiel antiminéralocorticoïde.
5. LA DYSMENORRHEE
Le terme dysménorrhée définit des menstruations accompagnées de douleurs pelviennes ou
du bas ventre. Les douleurs peuvent être crampiformes ou sourdes.
La dysménorrhée frappe bien plus que la moitié (50 – 90 %) des adolescentes et femmes en
âge fertile. 10 – 15 % des femmes touchées sont limitées dans leurs activités quotidiennes au
point de devoir manquer l’école ou le travail tous les mois jusqu’à 3 jours. La dysménorrhée
commence juste avant ou avec l’arrivée des règles pour finir avec la fin des règles. Tandis que
des douleurs légères pelviennes ou des tiraillements dans le bas ventre pendant les règles sont
la norme, des douleurs fortes voire excessives ne le sont définitivement pas. La dysménorrhée
peut aller de pair avec une ménorragie.
Lors que la dysménorrhée est présente dès ou peu après la ménarche, il s’agit d’une
dysménorrée primaire. Quand une dysménorrhée se manifeste plus tard dans la vie
reproductive de la femme (apparition nouvelle de règles douloureuses), il s’agit d’une
dysménorrhée secondaire. Plusieurs auteurs définissent la dysménorrhée primaire comme
dysménorrhée sans évidence de pathologie pelvienne sous-jacente. La dysménorrhée
secondaire pour ces auteurs est alors associée à une pathologie pelvienne telle que
l’endométriose, la présence de fibromes, d’adhérences etc.
La dysménorrhée primaire non seulement apparaît en général plus tôt que la dysménorrhée
secondaire, mais de plus n’est en général pas associée à des pathologies spécifiques de l’utérus
ou des organes pelviens
La dysménorrhée secondaire est en général d’origine organique.
Les causes les plus fréquentes sont:
L‘endométriose
L’adénomyose (adénomyosis, endométriose interne)
Fibromes, myomes
Infections ascendantes
Présence d’adhérences dans le petit bassin
Anomalies de position (malpositions) de l’utérus
Polypes endométriaux
Sténose du col utérin
Malformations de l‘utérus
En tant que diagnostics différentiels entrent en ligne de compte les maladies voire
pathologies du bas abdomen suivant:
Grossesse extrautérine
Maladies intestinales inflammatoires (Maladie de Crohn et colite ulcéreuse)
Stérilet en cuivre
La dysménorrhée atteint sa fréquence maximale à la fin des années 20 et dans les années 30.
EGONEplus Troubles des règles et du cycle, aménorrhée 35 de 37
Recommandations
1. En cas d’apparition chez une adolescente de douleurs de type dysménorrhée dans les
premiers mois après la ménarche, des malformations utérines doivent être exclues.
2. Si une dysménorrhée n’apparaît que des années après la ménarche, des causes potentielles
(organiques) d’une dysménorrhée secondaire doivent être cherchées voire exclues.
3. Vu la prévalence élevée de la dysménorrhée et le fait que beaucoup de femmes ne
mentionnent pas spontanément leurs souffrances, le/la gynécologue devrait, lors de la prise
d’anamnèse, aborder ce sujet de manière ciblée.
Options thérapeutiques
Dans la genèse de la dysménorrhée primaire, une surproduction locale de prostaglandines joue
un rôle prépondérant, surtout de prostaglandine F2α (effet contractile sur le myomètre). Pour
cette raison, les médicaments AINS (anti-inflammatoires non-stéroïdiens) (angl. nonsteroidal
anti-inflammatory drugs“ NSAIDs) se sont avérés efficaces, car ils inhibent la synthèse des
prostaglandines.
Font partie de ces médicaments Ibuprofen(z.B. Brufen®), Naproxen (z.B. Apranax®, Proxen®),
acide méfénamique (p.ex. Ponstan®) et acide acétylsalicylique (Aspirin®).
Les deux substances citées en premier sont réputées être les plus efficaces.
Les inhibiteurs de la synthèse des prostaglandines sont les médicaments de premier choix.
Début du traitement au début des règles, durée souvent seulement 2 à 3 jours.
Effets secondaires potentiels: intolérance gastro-intestinale, céphalées, somnolence.
La femme avec un cycle anovulatoire souffre moins souvent de dysménorrhée (qui est alors
souvent moins forte). Pour cette raison, des inhibiteurs de l’ovulation, de préférence les
préparations oestro-progestatives, sont utilisés comme thérapeutiques.
Les inhibiteurs de l’ovulation combinés peuvent être administrés en continu (sans pause, en
„cycle long“) pendant plusieurs mois: Vu qu’il n’y a pas de règles, il n’y a pas de
dysménorrhée !
Dans des cas choisis, la monothérapie à l’aide d’un gestagène dépôt (Acétate de
médroxyprogestérone = MPA; p.ex. Depo-Provera®) ou la pose d’un stérilet contenant un
gestagène (Mirena®) peut s’avérer salutaire.
Si, en cas de dysménorrhée secondaire, une cause organique est présente, la thérapie doit
viser l’élimination de la cause décelée.
Note finale du traducteur:
Si des phrases dans le script contiennent des « germanismes », vous paraissent lourdes, peu
élégantes ou même incompréhensibles en français, veuillez nous le signaler afin que nous
puissions y remédier. (mail)
L’original étant le script allemand, en cas de doute, veuillez le consulter pour comparer le texte
français et pour vérifier que la version française provient effectivement de la dernière édition
disponible.
Vos commentaires et remarques sont les bienvenus. (mail)
LITTERATURE
1. Lane DE (2006) Polycystic ovary syndrome and its differential diagnosis. Obstet Gynecol
Surv 61: 125
http://www.ncbi.nlm.nih.gov/pubmed/16433936
2. Brettenthaler N, De Geyter C, Huber PR, Keller U(2004) Effect of the insulin sensitizer
pioglitazone on insulin resistance, hyperandrogenism, and ovulatory dysfunction in women
with polycystic ovary syndrome. J Clin Endocrinol Metab 89:3835
http://jcem.endojournals.org/content/89/8/3835.full.pdf
3. Kalu E, Panay N (2008) Spontaneous premature ovarian failure: management challenges.
Gynecol Endocrinol 24:273
http://www.ncbi.nlm.nih.gov/pubmed/18569032
EGONEplus Troubles des règles et du cycle, aménorrhée 36 de 37
4. Practice Committee of the American Society for Reproductive Medicine (2006) Current
evaluation of amenorrhea. Fertil Steril. 86 (5 Suppl 1):S148-55.
http://www.ncbi.nlm.nih.gov/pubmed/17055812
5. Leidenberger F A., Strowitzki Th, Ortmann O. (Hsg.) (2009) Klinische Endokrinologie für
Frauenärzte 4. Auflage, 2009, Springer Medizin Verlag Heidelberg
6. Goswami D, Conway GS (2005) Premature ovarian failure. Hum Reprod Update 11:391
http://humupd.oxfordjournals.org/content/11/4/391.full.pdf
7. Puder J, Pralong F (2009) Polycystic ovary syndrome and insulin resistance Rev Med Suisse,
198:779
http://www.ncbi.nlm.nih.gov/pubmed/19418980
8. Lefebvre G, Pinsonneault O (2005) SOGC Clinical Practice Guideline “Primary Dysmenorrhea
Consensus Guidline. JOGC 169: 1117
http://www.ncbi.nlm.nih.gov/pubmed/16524531
9. Halbreich U, Borenstein J, Pearlstein T (2003) The prevalence, impairment, impact, and
burden of premenstrual dysphoric disorder (PMS/PMDD). Pschychoneuroendocrinology, 28
Suppl 3:1-23.
http://www.ncbi.nlm.nih.gov/pubmed/12892987
10. Divasta AD, Gordon CM. Hormone replacement therapy and the adolescent. Curr Opin
Obstet Gynecol. 2010;22:363-8.
http://www.ncbi.nlm.nih.gov/pubmed/20724926
11. Santoro N. Update in hyper- and hypogonadotropic amenorrhea. J Clin Endocrinol Metab.
2011;96:3281-8.
http://www.ncbi.nlm.nih.gov/pubmed/22058375
12. Wang AT, Mullan RJ, Lane MA, Hazem A, Prasad C, Gathaiya NW, Fernández-Balsells MM,
Bagatto A, Coto-Yglesias F, Carey J, Elraiyah TA, Erwin PJ, Gandhi GY, Montori VM, Murad
MH. Treatment of hyperprolactinemia: a systematic review and meta-analysis. Syst Rev.
2012;33:1-33.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3483691/pdf/2046-4053-1-33.pdf
13. Visser JA, Schipper I, Laven JS, Themmen AP. Anti-Müllerian hormone: an ovarian reserve
marker in primary ovarian insufficiency. Nat Rev Endocrinol. 2012;8:331-41.
http://www.ncbi.nlm.nih.gov/pubmed/22231848
14. Santoro N. Update in hyper- and hypogonadotropic amenorrhea. J Clin Endocrinol Metab.
2011;96:3281-8.
http://jcem.endojournals.org/content/96/11/3281.full.pdf
15. Reindollar RH. Turner syndrome: contemporary thoughts and reproductive issues. Semin
Reprod Med. 2011;29:342-52
http://www.ncbi.nlm.nih.gov/pubmed/21969268
16. Imthurn B, Schiessl K, Stiller R. Handbuch - Hormon-, Zyklus- und Fertilitätsstörungen.
Universitätsspital Zürich 2011; 1-103.
Aidez nous, grâce à vos commentaires, à améliorer la structure ainsi que le contenu de
ce chapitre. Envoyez-nous simplement un mail. Nous vous sommes très reconnaissants
pour toutes vos remarques, qui seront anonymisées.
EGONEplus Troubles des règles et du cycle, aménorrhée 37 de 37
Vous aimerez peut-être aussi
- La chimiothérapie: Une brochure de la Fondation contre le CancerD'EverandLa chimiothérapie: Une brochure de la Fondation contre le CancerPas encore d'évaluation
- Les cancers du sein: Une brochure de la Fondation contre le CancerD'EverandLes cancers du sein: Une brochure de la Fondation contre le CancerPas encore d'évaluation
- Les coliques du cheval : diagnostic et traitementD'EverandLes coliques du cheval : diagnostic et traitementPas encore d'évaluation
- Les cancers de l'utérus: Une brochure de la Fondation contre le CancerD'EverandLes cancers de l'utérus: Une brochure de la Fondation contre le CancerPas encore d'évaluation
- L'infertilité N'est Pas Seulement Un Problème Du CoupleD'EverandL'infertilité N'est Pas Seulement Un Problème Du CouplePas encore d'évaluation
- Le manuel complet sur la scoliose et la chirurgie pour les patients: Un regard impartial en profondeur : qu’attendre avant et pendant l’opération de la scolioseD'EverandLe manuel complet sur la scoliose et la chirurgie pour les patients: Un regard impartial en profondeur : qu’attendre avant et pendant l’opération de la scoliosePas encore d'évaluation
- Médicament Grossesse Et AllaitementDocument24 pagesMédicament Grossesse Et AllaitementMidnightPas encore d'évaluation
- Ischémies Intestinales Chroniques Et SubaiguësFILEminimizerDocument46 pagesIschémies Intestinales Chroniques Et SubaiguësFILEminimizerIgorCotagaPas encore d'évaluation
- Docteur J Ai 4 EditionDocument838 pagesDocteur J Ai 4 EditiondjibiPas encore d'évaluation
- Investigation Infertilite MaleDocument74 pagesInvestigation Infertilite MaleMarc nobert junior JeanPas encore d'évaluation
- 1.troubles de Cycles Et de ReglesDocument48 pages1.troubles de Cycles Et de Reglespapinou sarrPas encore d'évaluation
- 16 Fiche Pédagogique TD 16 Physiologie Systeme Endocrinien Pour ÉtudiantsDocument3 pages16 Fiche Pédagogique TD 16 Physiologie Systeme Endocrinien Pour ÉtudiantsOusmanePas encore d'évaluation
- Resume Histoire de La Medecine DR - DragonDocument27 pagesResume Histoire de La Medecine DR - DragonFuji ToraxPas encore d'évaluation
- Protocole Diabete GestationnelDocument8 pagesProtocole Diabete GestationnelNaomie CorsicaPas encore d'évaluation
- Guide ParamedicalDocument83 pagesGuide Paramedicalcoralie muretPas encore d'évaluation
- Les NeurotransmetteursDocument13 pagesLes NeurotransmetteursLeilah Beddiaf100% (1)
- Rougeole (II) - Diagnostic, TraitementDocument10 pagesRougeole (II) - Diagnostic, Traitementmahefaserge100% (1)
- L'Examen GynécologiqueDocument17 pagesL'Examen GynécologiqueSamira Moutaoikkil Basskar100% (2)
- Polyarthrite RhumatoideDocument24 pagesPolyarthrite Rhumatoidephilsantiago0100% (1)
- 06 Goutte PDFDocument0 page06 Goutte PDFHamid MecherakPas encore d'évaluation
- Algoritme de Prise en Charge Du CholeraDocument4 pagesAlgoritme de Prise en Charge Du Choleracompte eleve100% (1)
- Physiologie Du ColonDocument33 pagesPhysiologie Du Colonyaya camaraPas encore d'évaluation
- Le Cancer de L'endometreDocument44 pagesLe Cancer de L'endometrewooden latexPas encore d'évaluation
- Syllabus Gynéco Revisé - 031153Document286 pagesSyllabus Gynéco Revisé - 031153dieudonnekatayi4Pas encore d'évaluation
- Apport de La Tomodensitométrie Dans Le Diagnostic de La Pathologie Pancréatique Au CamerounDocument5 pagesApport de La Tomodensitométrie Dans Le Diagnostic de La Pathologie Pancréatique Au CamerounAxelle BoukambaPas encore d'évaluation
- Echelle GEA Acnée PDFDocument2 pagesEchelle GEA Acnée PDFquang phamPas encore d'évaluation
- Le Magnésium Est-Il Un MédicamentDocument9 pagesLe Magnésium Est-Il Un MédicamentSoussou PerlaPas encore d'évaluation
- Endocrinologie Et Nutrition - Support de CoursDocument85 pagesEndocrinologie Et Nutrition - Support de CoursMarouan DhnPas encore d'évaluation
- Thèse D'exercice: Faculté de MédecineDocument162 pagesThèse D'exercice: Faculté de MédecineJeremy ChristmannPas encore d'évaluation
- TD Calcul Des Doses Et DébitsDocument25 pagesTD Calcul Des Doses Et DébitsEya TalbiPas encore d'évaluation
- Appareil GenitalDocument112 pagesAppareil GenitalSamira OunefloussePas encore d'évaluation
- Cycle MenstruelDocument8 pagesCycle MenstruelBadr Abou AliaPas encore d'évaluation
- Prise en Charge de La Nutrition ParentéraleDocument52 pagesPrise en Charge de La Nutrition ParentéraleAtef Amara KorbaPas encore d'évaluation
- Affections de L'appareil Urinaire SemiologieDocument9 pagesAffections de L'appareil Urinaire SemiologieBah LandryPas encore d'évaluation
- PHYSIOLOGIE DE LA GROSSESSE F-ConvertiDocument82 pagesPHYSIOLOGIE DE LA GROSSESSE F-ConvertiAyoub IbPas encore d'évaluation
- Comprendre Le Cancer Du Sein PDFDocument116 pagesComprendre Le Cancer Du Sein PDFANDELA Dior100% (1)
- Diabète de Type 2Document14 pagesDiabète de Type 2solidarcoPas encore d'évaluation
- Quelle alimentation pour l'hémochromatose ?D'EverandQuelle alimentation pour l'hémochromatose ?Évaluation : 4 sur 5 étoiles4/5 (1)
- 13 Arrêt Cardiaque - Collège Urgences 21Document18 pages13 Arrêt Cardiaque - Collège Urgences 21Oussama MokhtariPas encore d'évaluation
- Diabete Gestationnel SynthDocument12 pagesDiabete Gestationnel SynthDumas Tchibozo100% (1)
- Tumeurs de L'ovaireDocument58 pagesTumeurs de L'ovaireMohamedPas encore d'évaluation
- ObésitéDocument7 pagesObésitéMina StellaPas encore d'évaluation
- 02 OvogeneseDocument35 pages02 Ovogenesedjamila benaissaPas encore d'évaluation
- Petit Precis D'ophtalmo TropicalDocument47 pagesPetit Precis D'ophtalmo TropicalAbdou Benhadda100% (1)
- Sante Mag 51Document52 pagesSante Mag 51Cherraben Taha Amine100% (1)
- 5 La Perception de La Maladie Et Le Coping Chez Les Personnes FibromyalgiquesDocument97 pages5 La Perception de La Maladie Et Le Coping Chez Les Personnes Fibromyalgiques1harmoniePas encore d'évaluation
- ContraceptionDocument5 pagesContraceptionAndy HocinePas encore d'évaluation
- Soins Infirmiers en Psychiatrie - Encyclopédie Médicale - MedixDocument11 pagesSoins Infirmiers en Psychiatrie - Encyclopédie Médicale - Medixbbrunoissy100% (1)
- Particularites Des Avc Chez L'enfantDocument44 pagesParticularites Des Avc Chez L'enfantNTAKIRUTIMANA EZECHIELPas encore d'évaluation
- 9-Grossesse Et Médicament MED DENTAIRE 2022-2023Document29 pages9-Grossesse Et Médicament MED DENTAIRE 2022-2023makhlouf.farah02Pas encore d'évaluation
- Le CancerDocument81 pagesLe CancerCornelia IliePas encore d'évaluation
- Referentiel - Fievre PDT Travail - RSN Mars2019Document2 pagesReferentiel - Fievre PDT Travail - RSN Mars2019Pamela Aigbogun100% (1)
- Therapies Ciblees Ma PrésentationDocument18 pagesTherapies Ciblees Ma PrésentationAbdelhalim BensidhoumPas encore d'évaluation
- ChimioDocument22 pagesChimioharnadPas encore d'évaluation
- 2.mortalité MaternelleDocument51 pages2.mortalité MaternelledePas encore d'évaluation
- La Trisomie 18Document1 pageLa Trisomie 18Abdo BoukhartaPas encore d'évaluation
- TDMDocument13 pagesTDMTheodoraPas encore d'évaluation
- Suites de CouchesDocument14 pagesSuites de CouchesnissrinePas encore d'évaluation
- Paludisme Et GrossesseDocument25 pagesPaludisme Et GrossesseMouhamed Abdoulaye NiangPas encore d'évaluation
- 08 - Prolapsus Des Organes Pelviens (Pop)Document8 pages08 - Prolapsus Des Organes Pelviens (Pop)Iván ATPas encore d'évaluation
- 03 - Systematique Des Formes D IncontinenceDocument6 pages03 - Systematique Des Formes D IncontinenceIván ATPas encore d'évaluation
- 04 - AndrogenisationDocument18 pages04 - AndrogenisationIván ATPas encore d'évaluation
- 03 - Systematique Des Formes D IncontinenceDocument6 pages03 - Systematique Des Formes D IncontinenceIván ATPas encore d'évaluation
- 05 - SteriliteDocument26 pages05 - SteriliteIván ATPas encore d'évaluation
- 06 - Vessie Hyperactive - TraitementDocument5 pages06 - Vessie Hyperactive - TraitementIván ATPas encore d'évaluation
- 03 - Accouchement Et Post-Partum PhysiologiquesDocument16 pages03 - Accouchement Et Post-Partum PhysiologiquesIván ATPas encore d'évaluation
- 06 - ContraceptionDocument34 pages06 - ContraceptionIván ATPas encore d'évaluation
- 17 - Grossesses MultiplesDocument25 pages17 - Grossesses MultiplesIván ATPas encore d'évaluation
- 18 - Problèmes de Groupes SanguinsDocument9 pages18 - Problèmes de Groupes SanguinsIván ATPas encore d'évaluation
- 06 - Contraception Pendant La Periode D'allaitementDocument4 pages06 - Contraception Pendant La Periode D'allaitementIván ATPas encore d'évaluation
- 32 - Les Marqueurs Tumoraux en GynecologieDocument6 pages32 - Les Marqueurs Tumoraux en GynecologieIván ATPas encore d'évaluation
- 05 - Allaitement Maternel Les 10 Conditions deDocument11 pages05 - Allaitement Maternel Les 10 Conditions deIván ATPas encore d'évaluation
- 34 - Communication Et CounsellingDocument19 pages34 - Communication Et CounsellingIván ATPas encore d'évaluation
- 31 - Carcinome de La Vulve Et Du VaginDocument11 pages31 - Carcinome de La Vulve Et Du VaginIván ATPas encore d'évaluation
- 33 - Anomalies Du Developpement Des OrganesDocument5 pages33 - Anomalies Du Developpement Des OrganesIván ATPas encore d'évaluation
- 35 - Psycho-Oncologie en Cas de Tumeurs MalignesDocument14 pages35 - Psycho-Oncologie en Cas de Tumeurs MalignesIván ATPas encore d'évaluation
- QCM - AmenorrhéeDocument3 pagesQCM - AmenorrhéeOumaima MayaPas encore d'évaluation
- Troubles Des Conduites SexuellesDocument2 pagesTroubles Des Conduites SexuellesVichy PotchiraPas encore d'évaluation
- Dystocies Dynamiques MecaniquesDocument41 pagesDystocies Dynamiques MecaniquesVandal limited100% (3)
- 3CM2-EDHC-T4-L3-Les Grossesses PrécocesDocument3 pages3CM2-EDHC-T4-L3-Les Grossesses Précocesdiephor phorel hamanaPas encore d'évaluation
- AménorrhéeDocument8 pagesAménorrhéeAro MandaPas encore d'évaluation
- Cycle Ovarien Doc1 PDFDocument1 pageCycle Ovarien Doc1 PDFHk EhPas encore d'évaluation
- HSG Mali PDFDocument101 pagesHSG Mali PDFFrederic JeanPas encore d'évaluation
- Charles Melman - La Madre Como Agente Del PadreDocument17 pagesCharles Melman - La Madre Como Agente Del PadreAndrés OsorioPas encore d'évaluation
- 4 APPAREIL GENITAL MASCULIN WordDocument10 pages4 APPAREIL GENITAL MASCULIN WordFaïsole Adimou OlaPas encore d'évaluation
- Communiqué 8 Mars DumontDocument4 pagesCommuniqué 8 Mars Dumontlise dlslPas encore d'évaluation
- Recherche Documentaire Sur La Précarité-Cycle Emnstruelle-PrécaritémenstruelleDocument9 pagesRecherche Documentaire Sur La Précarité-Cycle Emnstruelle-PrécaritémenstruellePerillatPas encore d'évaluation
- INFERTILITE MASCULINE Cours 5ème Année Urologie PR LakmichiDocument51 pagesINFERTILITE MASCULINE Cours 5ème Année Urologie PR LakmichiQassifi Marwane100% (1)
- Observatoire SexualitéEuropéennesDocument1 pageObservatoire SexualitéEuropéennesdeskwebDDMPas encore d'évaluation
- Présentations Céphaliques Défléchies Ayoub YaiciDocument6 pagesPrésentations Céphaliques Défléchies Ayoub YaiciAmina AmiinaPas encore d'évaluation
- Devoir - de - Controle - N1-Bac-Sciences - SVT-2018-2019-M. Hatem Labaoui - Lycée de Kasserine PDFDocument3 pagesDevoir - de - Controle - N1-Bac-Sciences - SVT-2018-2019-M. Hatem Labaoui - Lycée de Kasserine PDFsonilolaPas encore d'évaluation
- Lacroix - Genève Quels Sont Les Outils Permettant D'évaluer Un t3 Prescrit Pour Dysfonction SexuelleDocument25 pagesLacroix - Genève Quels Sont Les Outils Permettant D'évaluer Un t3 Prescrit Pour Dysfonction SexuelleJonathan Nlandu NlanduPas encore d'évaluation
- SexualiteDocument40 pagesSexualiteafoussoulaPas encore d'évaluation
- Rapport de Stage de Gynecologie DefinitifDocument56 pagesRapport de Stage de Gynecologie DefinitifDi BenamoPas encore d'évaluation
- L'OvulationDocument4 pagesL'OvulationLim BunkimPas encore d'évaluation
- Magazine Les Bases de La Pipe - HTMLDocument3 pagesMagazine Les Bases de La Pipe - HTMLalpha999Pas encore d'évaluation
- Accouchement Du SiegeDocument17 pagesAccouchement Du SiegeAbdourahman AliPas encore d'évaluation
- Devoir de Contrôle N°1 (Corrigé) - SVT - 4ème SC Exp (2008-2009) MR Kordoghli MohamedDocument5 pagesDevoir de Contrôle N°1 (Corrigé) - SVT - 4ème SC Exp (2008-2009) MR Kordoghli MohamedMahdi Achbar100% (1)
- Femme2 Adoc PDFDocument5 pagesFemme2 Adoc PDFsonilolaPas encore d'évaluation
- Femme1 PDFDocument2 pagesFemme1 PDFsonilolaPas encore d'évaluation
- Série QCM Physiologie de La ReproductionDocument8 pagesSérie QCM Physiologie de La ReproductionBonhomme Desneiges100% (11)
- Version Finale 2 Sexy Lidy Libertine Ma Double VieDocument395 pagesVersion Finale 2 Sexy Lidy Libertine Ma Double ViesanogoPas encore d'évaluation
- Avis de RecrutementDocument2 pagesAvis de RecrutementLaurent BonkoungouPas encore d'évaluation
- 8 Présentation TransverseDocument14 pages8 Présentation TransversehalaPas encore d'évaluation
- Diagnostic D'une Douleur Pelvienne en GynecoDocument5 pagesDiagnostic D'une Douleur Pelvienne en GynecoWOGNINPas encore d'évaluation
- Controle RapideDocument4 pagesControle RapidequalbiPas encore d'évaluation