Académique Documents
Professionnel Documents
Culture Documents
Les Valeurs Du PH: Acidité Croissante
Transféré par
Thierry DucosTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Les Valeurs Du PH: Acidité Croissante
Transféré par
Thierry DucosDroits d'auteur :
Formats disponibles
C.
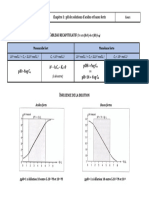
Les valeurs du pH
Pour caractériser une solution donnée, il est possible de définir son pH (concentration en ions
oxonium) ou son pOH (concentration en ions hydroxyle). En effet, le pH et le pOH d'une solution
sont unis par la relation : pH+ pOH = 14.
On choisit généralement de caractériser une solution par la valeur de son pH.
Le pH d'une solution exprime sa concentration en ions oxonium.
Le pH et la concentration molaire en ions oxonium sont liés par la relation :
[Hp+] = 1 o-pH mol.L:'
Solutions neutres
pH= 7
[Hp+J = [OH-J
Solutions acides Solutions basiques
0 <pH< 7 7<pH<14
[Hp+J > [OH-J [Hp+J < [OH-J
acidité croissante alcalinité croissante
pH 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
[Hp+J 100 10-1 10-2 10-3 10-4 10-s 10--6 10-1 10-s 10-9 10-10 10-11 10-12 10-13 10-14
en molL:'
[Hp+] [OH-] Produit ionique
Solutions pH pOH pH+ pOH
en mol.l," en mol.l," [Hp+J x [OH-]
0 1 o-14 14 1 o-14 0+14=14
1
10-1 1 1 o-13 13 1 o-14 1 + 13 = 14
10-2 2 10-12 12 1 o-14 2+12=14
10-3 10-11 11 10-14 3 + 11 = 14
3
acides 10-10 1 o-14 4+10=14
10-4 4 10
. 10-s 5 10-9 9 1 o-14 5 + 9 = 14
10-6 10-8 8 10-14 6 + 8 = 14
6
10-7 10-1 7 10-14 7 + 7 = 14
neutres 7
10-8 8 1 o-6 6 1 o-14 8 + 6 = 14
10-9 9 10-s 5 1 o-14 9 + 5 = 14
10-10 10-4 4 10-14 10+4= 14
10
basiques 10-14 11 + 3 = 14
10-11 11 10-3 3
10-12 12 10-2 2 10-14 12+2=14
1 o-13 13 10-1 1 10-14 13 + 1 = 14
1 o-14 14 1 0 1 o-14 14+0=14
g Partie "4 • L.:eau, solvant et milieu réactionnel
Vous aimerez peut-être aussi
- Livre PDFDocument166 pagesLivre PDFviviana100% (7)
- Electrochimie - TP - Compte Rendu TP PH Métrie 6609Document7 pagesElectrochimie - TP - Compte Rendu TP PH Métrie 6609Khezazna Seif67% (6)
- COURS PH DES SOLUTIONS AQUEUSES HADJ ALI BOUZIDDocument6 pagesCOURS PH DES SOLUTIONS AQUEUSES HADJ ALI BOUZIDMohamed Helmi Chebbi100% (5)
- 604 S - Eléments de Technologie CAT PDFDocument61 pages604 S - Eléments de Technologie CAT PDFHugo Tia100% (4)
- Expresiones Coloquiales en FrancésDocument5 pagesExpresiones Coloquiales en FrancésPaul DaugentePas encore d'évaluation
- Correction Des Exercices Acides-Bases PDFDocument4 pagesCorrection Des Exercices Acides-Bases PDFbenkrimaPas encore d'évaluation
- Exo 54 - Dosage Acide Benzoique CDocument3 pagesExo 54 - Dosage Acide Benzoique CAnis DahnenPas encore d'évaluation
- Acide BaseDocument14 pagesAcide Baseالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Acide-Base - Tableau de PHDocument1 pageAcide-Base - Tableau de PHIKHLASSE OUARDI100% (1)
- Corrigé Type TD N°8Document7 pagesCorrigé Type TD N°8Sofiane BousifePas encore d'évaluation
- Corrige Polynesie Spe2 14 Mars 2023Document5 pagesCorrige Polynesie Spe2 14 Mars 2023lucie.devarrewaerePas encore d'évaluation
- Corrige S Caledonie Nov 2002copieDocument6 pagesCorrige S Caledonie Nov 2002copieakcmerteyah1Pas encore d'évaluation
- Chapitre 3 - PH AF Et BF - CoursDocument1 pageChapitre 3 - PH AF Et BF - CoursGODANI PhilippePas encore d'évaluation
- Exo 05 Trace Second Ordre Racines ReellesDocument15 pagesExo 05 Trace Second Ordre Racines ReellesAsmaa KasmiPas encore d'évaluation
- Le Calcul Du PH D'une SolutionDocument1 pageLe Calcul Du PH D'une SolutionThierry DucosPas encore d'évaluation
- Devoir5 CorrectionDocument8 pagesDevoir5 CorrectionAmen RouissiPas encore d'évaluation
- 8 PHDocument7 pages8 PHAzumi ChanPas encore d'évaluation
- 03 Philippe-BondonDocument1 page03 Philippe-Bondonberami1009Pas encore d'évaluation
- Corr - Serie7 - ChimieDocument4 pagesCorr - Serie7 - ChimieJabri Imene0% (1)
- Brochure de Chimie TSM Tse (1) - 1Document46 pagesBrochure de Chimie TSM Tse (1) - 1Elhadj BahPas encore d'évaluation
- Corrigé de La Série N°2 - Équilibres Acido-BasiquesDocument7 pagesCorrigé de La Série N°2 - Équilibres Acido-Basiqueskim namjoon100% (1)
- Devoir ElectroooooDocument12 pagesDevoir ElectroooooOuu SsaamaPas encore d'évaluation
- STIC Envirt 2009 170Document8 pagesSTIC Envirt 2009 170Konrad SzafnickiPas encore d'évaluation
- Correction PH 1Document4 pagesCorrection PH 1mnasri.wassoPas encore d'évaluation
- Cahier Nombres cp1Document16 pagesCahier Nombres cp1MarionGaulierPas encore d'évaluation
- Exercices N 5 Et 6Document7 pagesExercices N 5 Et 6ahlemmPas encore d'évaluation
- GR Standard 711Document1 pageGR Standard 711ThibaultFranchiniPas encore d'évaluation
- TSpe TPC9 MesurepHForceAcideBase FicheDocument5 pagesTSpe TPC9 MesurepHForceAcideBase FicheMouhamed NadirPas encore d'évaluation
- Colmagiquehrissonaddinf 15Document1 pageColmagiquehrissonaddinf 15Romain ChenalPas encore d'évaluation
- Puzzle CalculsDocument3 pagesPuzzle CalculsgyvloirePas encore d'évaluation
- Methodes de Calcul de PH Des Solutions AqueusesDocument6 pagesMethodes de Calcul de PH Des Solutions AqueusesabalotouadjeiPas encore d'évaluation
- Université de Jijel Faculté Des Sciences Et de La Technologie Département D'electrotechnique Systèmes Asservis, L3, TD N 3Document8 pagesUniversité de Jijel Faculté Des Sciences Et de La Technologie Département D'electrotechnique Systèmes Asservis, L3, TD N 3fazfrito lacaviataPas encore d'évaluation
- C5Chim - Reactions - Acidobasiques - Exercices - Bronsted-Lowry PDFDocument4 pagesC5Chim - Reactions - Acidobasiques - Exercices - Bronsted-Lowry PDFAzizElheniPas encore d'évaluation
- Chapitre 2 PH Des Solutions Acides BasesDocument26 pagesChapitre 2 PH Des Solutions Acides BasesRottina RossyPas encore d'évaluation
- Correction Examen NationaleDocument10 pagesCorrection Examen NationaleYanrique RPas encore d'évaluation
- Livret Rituels Calcul Mental Ce1Document7 pagesLivret Rituels Calcul Mental Ce1berthenancyPas encore d'évaluation
- 18 NumerationDocument5 pages18 NumerationBakrim OumaimaPas encore d'évaluation
- Les PH Des Solutions Aqueuses PDFDocument4 pagesLes PH Des Solutions Aqueuses PDFAzizElheniPas encore d'évaluation
- BAC Serie D-2022 - Rempl...Document9 pagesBAC Serie D-2022 - Rempl...justsdedePas encore d'évaluation
- 2009 Antilles Exo3 Correction EauDistillee PH 4ptsDocument2 pages2009 Antilles Exo3 Correction EauDistillee PH 4ptsHassan El BarakaPas encore d'évaluation
- Docimologie 1Document6 pagesDocimologie 1emmanuel cerda adonaïPas encore d'évaluation
- Xercices:: A) Est Supérieur À 10 B) Est Inférieur À 10 C) Reste Égal À 10Document7 pagesXercices:: A) Est Supérieur À 10 B) Est Inférieur À 10 C) Reste Égal À 10yt StormPas encore d'évaluation
- Travail Damandé Botaba 2 BettyDocument13 pagesTravail Damandé Botaba 2 BettyKati AliPas encore d'évaluation
- 02 Ctrle Recurrence Limite Suites 14 10 2014 CorrectionDocument3 pages02 Ctrle Recurrence Limite Suites 14 10 2014 CorrectionLaurine JonierPas encore d'évaluation
- Acide Base Sel PH Neutralisation - MT 2022.23Document44 pagesAcide Base Sel PH Neutralisation - MT 2022.23Victor Pruteanu (Goose)Pas encore d'évaluation
- Cours Chap 8 Force des acides et des bases PMDocument8 pagesCours Chap 8 Force des acides et des bases PMLellia SEMMARPas encore d'évaluation
- 07 Titrage PH Vinaigre CorrectionDocument4 pages07 Titrage PH Vinaigre CorrectionChartier Julien86% (7)
- Marolet MaDocument5 pagesMarolet MamedsalemeddahPas encore d'évaluation
- C71 - TP 2 Chimie Minerale Reactions de Complexation: RougeDocument7 pagesC71 - TP 2 Chimie Minerale Reactions de Complexation: RougeMarck CadiilPas encore d'évaluation
- Chimie en SolutionDocument10 pagesChimie en SolutionMohamed EL FAGHLOUMIPas encore d'évaluation
- Ensembles TDDocument2 pagesEnsembles TDhamidonnPas encore d'évaluation
- Test Diagnostiques 2BAC MATHS 2021 - 2022 LA JOCDocument2 pagesTest Diagnostiques 2BAC MATHS 2021 - 2022 LA JOCEl Mehdi Belbacha83% (6)
- Diagrammes Potentiel PHDocument8 pagesDiagrammes Potentiel PHbizizapps100% (1)
- VERT DE BROMOCRÉSOL CorrectionDocument3 pagesVERT DE BROMOCRÉSOL CorrectionJuliette ALBANELPas encore d'évaluation
- Mat184 c05 CorrigeDocument1 pageMat184 c05 CorrigeNilaPas encore d'évaluation
- Calculs de PHDocument8 pagesCalculs de PHLaurent KeletaonaPas encore d'évaluation
- Cor DS24 M2020 FinieDocument5 pagesCor DS24 M2020 Finieelyes othmaniPas encore d'évaluation
- Définition Et Mesure Du PHDocument2 pagesDéfinition Et Mesure Du PHla physique selon le programme FrançaisPas encore d'évaluation
- 2005 Reunion Correction Exo2 Ammoniac 6 5ptsDocument2 pages2005 Reunion Correction Exo2 Ammoniac 6 5ptsالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Exercice1:: Corrigé Du Devoir de Synthèse N°2 ChimieDocument4 pagesExercice1:: Corrigé Du Devoir de Synthèse N°2 ChimieRiadh MarouaniPas encore d'évaluation
- CS Ensa 2020-21Document103 pagesCS Ensa 2020-213freefire 3gamePas encore d'évaluation
- Le Produit Ionique de L'eau Pure: Exemple de Neutralisation en CoiffureDocument1 pageLe Produit Ionique de L'eau Pure: Exemple de Neutralisation en CoiffureThierry DucosPas encore d'évaluation
- Le Calcul Du PH D'une SolutionDocument1 pageLe Calcul Du PH D'une SolutionThierry DucosPas encore d'évaluation
- Les Réactions Acido-Basiques Dans L'eau: - Nûii4t IIDocument1 pageLes Réactions Acido-Basiques Dans L'eau: - Nûii4t IIThierry DucosPas encore d'évaluation
- G - I:i4mii#8Document1 pageG - I:i4mii#8Thierry DucosPas encore d'évaluation
- G - Iriyiml H - : Dissolution D'Une Base Forte, L'Hydroxyde de Sodium NaohDocument1 pageG - Iriyiml H - : Dissolution D'Une Base Forte, L'Hydroxyde de Sodium NaohThierry DucosPas encore d'évaluation
- Fiche Torres Hugo Phase 4Document8 pagesFiche Torres Hugo Phase 4Thierry DucosPas encore d'évaluation
- Fiche KASSANDRA GROSJEAN Phase 4Document7 pagesFiche KASSANDRA GROSJEAN Phase 4Thierry DucosPas encore d'évaluation
- Fiche Signalétique CAP Phase 4Document8 pagesFiche Signalétique CAP Phase 4Thierry DucosPas encore d'évaluation
- Le PH Des Produits CapillairesDocument1 pageLe PH Des Produits CapillairesThierry DucosPas encore d'évaluation
- Progression Sciences Cap SciencesDocument2 pagesProgression Sciences Cap SciencesThierry DucosPas encore d'évaluation
- Fiche Torres Hugo Phase 4 Compte Rendu de Visite.Document7 pagesFiche Torres Hugo Phase 4 Compte Rendu de Visite.Thierry DucosPas encore d'évaluation
- Fiche Therion Léo Phase 4 Compte Rendu de VisiteDocument7 pagesFiche Therion Léo Phase 4 Compte Rendu de VisiteThierry DucosPas encore d'évaluation
- Maths Groupe C 2013Document8 pagesMaths Groupe C 2013francoisabj2004Pas encore d'évaluation
- Fiche Peano Siang Phase 4 Compte Rendue de Visite.Document6 pagesFiche Peano Siang Phase 4 Compte Rendue de Visite.Thierry DucosPas encore d'évaluation
- Controle N°1 - BPDocument2 pagesControle N°1 - BPThierry DucosPas encore d'évaluation
- La Structure de La MatièreDocument2 pagesLa Structure de La MatièreThierry DucosPas encore d'évaluation
- Cap Sphy Indust HachetteDocument64 pagesCap Sphy Indust HachetteThierry DucosPas encore d'évaluation
- 1 - 2 Le Chauffage CulinaireDocument13 pages1 - 2 Le Chauffage CulinaireThierry DucosPas encore d'évaluation
- Maths Groupe C 2013Document8 pagesMaths Groupe C 2013francoisabj2004Pas encore d'évaluation
- 1 - 1 Le Chauffage CulinaireDocument13 pages1 - 1 Le Chauffage CulinaireThierry DucosPas encore d'évaluation
- Fiche de Déroulement PédagogiqueDocument1 pageFiche de Déroulement PédagogiqueThierry DucosPas encore d'évaluation
- Sujet A10Document13 pagesSujet A10Thierry DucosPas encore d'évaluation
- Electricite1 1Document5 pagesElectricite1 1Thierry DucosPas encore d'évaluation
- Sujets Maths Groupe C - 2013 1Document5 pagesSujets Maths Groupe C - 2013 1Thierry DucosPas encore d'évaluation
- Sujet A10Document1 pageSujet A10Thierry DucosPas encore d'évaluation
- 2-3 Le Refrigerateur ResumeDocument3 pages2-3 Le Refrigerateur ResumeThierry DucosPas encore d'évaluation
- Sujet b3Document13 pagesSujet b3Thierry DucosPas encore d'évaluation
- Maths Groupe C 2013Document8 pagesMaths Groupe C 2013francoisabj2004Pas encore d'évaluation
- Sujet c12 Question 1.3.1Document1 pageSujet c12 Question 1.3.1Thierry DucosPas encore d'évaluation
- Sujet c12Document13 pagesSujet c12Thierry DucosPas encore d'évaluation
- Cei FRDocument2 pagesCei FRelmoummyPas encore d'évaluation
- H.248 Protocol FRDocument51 pagesH.248 Protocol FRAbdelilah Charboub100% (1)
- Ressources Formation PowerShell Niveau InitiationDocument89 pagesRessources Formation PowerShell Niveau InitiationHenri HemlePas encore d'évaluation
- OrangeMoney Terms FRDocument26 pagesOrangeMoney Terms FRMVOGO FabienPas encore d'évaluation
- Reussir Pas A Pas Dans LongrichDocument17 pagesReussir Pas A Pas Dans LongrichAbdoulaye OlaoyePas encore d'évaluation
- Đáp Án (Answer Key) Cuốn ETS 2019Document14 pagesĐáp Án (Answer Key) Cuốn ETS 2019Pham NguyenPas encore d'évaluation
- BclogoDocument31 pagesBclogonour1960Pas encore d'évaluation
- Grève de La SNAVDocument27 pagesGrève de La SNAV68ardenPas encore d'évaluation
- 2021 2022 V1 Applications1 Elements Finis J GasparouxDocument7 pages2021 2022 V1 Applications1 Elements Finis J GasparouxNawel23 MLKPas encore d'évaluation
- Recommandations Professionnelles Pour La Manutention en Sécurité Des Éléments Architecturaux 178P Octobre2008Document57 pagesRecommandations Professionnelles Pour La Manutention en Sécurité Des Éléments Architecturaux 178P Octobre2008Sénant Jean-MarcPas encore d'évaluation
- TP Final InitiationDocument10 pagesTP Final InitiationAgape LwanzoPas encore d'évaluation
- Plan de Ferraillage TablierDocument1 pagePlan de Ferraillage TablierFiras KorPas encore d'évaluation
- Cours MateriauxDocument6 pagesCours Materiauxbeey2001Pas encore d'évaluation
- Duo Pour Piano Et GuitareDocument4 pagesDuo Pour Piano Et Guitarecamilo sanabriaPas encore d'évaluation
- Reactualisation Etudes Impact Block CI PDFDocument252 pagesReactualisation Etudes Impact Block CI PDFAdikoDenzeyAnonhPas encore d'évaluation
- Management DES ORGANISATIONS PubliquesDocument42 pagesManagement DES ORGANISATIONS PubliquesRandom AccountPas encore d'évaluation
- Le Passage Du Résultat Comptable Au Résultat FiscalDocument138 pagesLe Passage Du Résultat Comptable Au Résultat Fiscalabouyoucef ABBAD100% (2)
- N18 - Fluidisation PCBDocument17 pagesN18 - Fluidisation PCBrania rejebPas encore d'évaluation
- Facteurs Dinfluences ExternesDocument2 pagesFacteurs Dinfluences ExternesJean-Luc BastinPas encore d'évaluation
- 04 Sigma Binome ChapitreDocument29 pages04 Sigma Binome ChapitrefbdbhdPas encore d'évaluation
- Cahier de Technologie 1er Sec CouleurDocument145 pagesCahier de Technologie 1er Sec CouleurZied BaccarPas encore d'évaluation
- CelluloseDocument36 pagesCelluloseYussef Daniel MontplaisirPas encore d'évaluation
- Administrateur Système & ApplicationDocument2 pagesAdministrateur Système & Applicationfokom talom gaetanPas encore d'évaluation
- (1905) Grammaire Annamite À L'usage Des Français de L'annam Et Du Tonkin - P. VallotDocument262 pages(1905) Grammaire Annamite À L'usage Des Français de L'annam Et Du Tonkin - P. Vallotnvh92Pas encore d'évaluation
- Communique Officiel Punaise de LitDocument2 pagesCommunique Officiel Punaise de LitMohamed InnekidenePas encore d'évaluation
- Propriétés Et Appropriation Des Lectures Numériques Au Sein Du Medium TabletteDocument98 pagesPropriétés Et Appropriation Des Lectures Numériques Au Sein Du Medium TabletteNoamNorkhat100% (1)