Académique Documents
Professionnel Documents
Culture Documents
G - Iriyiml H - : Dissolution D'Une Base Forte, L'Hydroxyde de Sodium Naoh
Transféré par
Thierry DucosTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
G - Iriyiml H - : Dissolution D'Une Base Forte, L'Hydroxyde de Sodium Naoh
Transféré par
Thierry DucosDroits d'auteur :
Formats disponibles
•
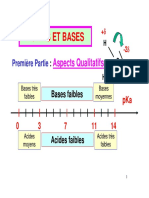
■ Dissolution d'une base forte, l'hydroxyde de sodium NaOH
Une base forte est une base qui réagit totalement avec l'eau. li apparaît en solution autant
I'
,\ d'ions oH- que de molécules de base introduites.
1
1
Exemple: l'introduction de 0,1 mole d'hydroxyde de sodium NaOH dans un litre d'eau donne
une solution de pH= 13 qui contient 0,1 mole d'ions Na+ et 0,1 mole d'ions OH-.
NaOH (hydroxyde de sodium) ___. Na++ OH- (soude)
■ Dissolution d'une base faible, l'ammoniac NH 3
Une base faible est une base qui réagit partiellement avec l'eau. La réaction entre l'eau et
l'ammoniac produit environ 1 % d'ions ammonium NH/ et 1 % d'ions hydroxyle OH-.
NH + Hp NH/ + OH- (ammoniaque)
3
li G•iriYIMl·h•
• La dissolution d'une base dans l'eau fait apparaître des ions hydroxyle OH-.
• Une base forte réagit totalement avec l'eau. Une base faible réagit partiellement avec l'eau.
• L'ion hydroxyle OH- est la base la plus forte qui puisse exister dans l'eau.
Les ampholytes
••NMNi.Ui
Un ampholyte est une espèce à comportement amphotère, c'est-à-dire un composé qui se
comporte tantôt comme un acide, tantôt comme une base.
L'eau est un exemple d'ampholyte.
• En présence d'une base (ici l'ammoniac), l'eau se comporte comme un acide:
NH3 + Hp
base + acide ,c:
NH/ + OH-
acide + base
- +
• En présence d'un acide (ici l'acide acétique), l'eau se comporte comme une base:
CH3COOH + Hp ,( ► CH3coo- + Hp+
acide + base • ► base + acide
La réaction acido-basique
■ Mécanisme de la réaction acido-basique
L'acide est un donneur de protons, la base un accepteur de protons. Lorsqu'un acide et une
base sont en présence, l'acide cède son (ou ses protons) à la base qui le(s) fixe.
~
acide 1 + base 2 - base 1 + acide 2
La réaction acido-basique (neutralisation) est un transfert de proton(s}.
La réaction de neutralisation entre une solution acide et une solution basique s'écrit:
(A-+ H30+) + (BW + OH-) -+- (A-+ BW) + 2 HP
solution acide solution basique sel de l'acide et de la base+ eau
0 Partie 4 • t.:eau, solvant et milieu réactionnel
Vous aimerez peut-être aussi
- G - I:i4mii#8Document1 pageG - I:i4mii#8Thierry DucosPas encore d'évaluation
- 6.reaction AcidobasiqueDocument20 pages6.reaction AcidobasiqueDim LifyPas encore d'évaluation
- Les Réactions Acido-Basiques Dans L'eau: - Nûii4t IIDocument1 pageLes Réactions Acido-Basiques Dans L'eau: - Nûii4t IIThierry DucosPas encore d'évaluation
- NYB PT Chapitre4 A08Document60 pagesNYB PT Chapitre4 A08abderrahimn100% (1)
- Chimie BI T8 Acides Et BasesDocument20 pagesChimie BI T8 Acides Et Basesmwambatshibanda04Pas encore d'évaluation
- Cours III Acides - Bases-A. BENAMARDocument60 pagesCours III Acides - Bases-A. BENAMARMed Seghir YounesPas encore d'évaluation
- Acide and BaseDocument80 pagesAcide and BaseMBOTAKE LawsonPas encore d'évaluation
- Acide Et BasesDocument38 pagesAcide Et BasesmedPas encore d'évaluation
- Chap I-2 CSDocument18 pagesChap I-2 CSSimo MaroPas encore d'évaluation
- MMCh3 Les Réactions Acido-Basiques CoursDocument4 pagesMMCh3 Les Réactions Acido-Basiques CoursegozeelowPas encore d'évaluation
- Chapitre 1-2Document14 pagesChapitre 1-2Hassna OuifkiPas encore d'évaluation
- 2-Équilibres IoniquesDocument14 pages2-Équilibres IoniquesNour el houdaPas encore d'évaluation
- SMPC s2 CHP 2Document31 pagesSMPC s2 CHP 2Abdelhakim BailalPas encore d'évaluation
- 01 - Les Acides Et BasesDocument34 pages01 - Les Acides Et BasesBsissaSoltaniPas encore d'évaluation
- Chapitre 2 - PH Des Solutions AqueusesDocument11 pagesChapitre 2 - PH Des Solutions AqueusesBeatrice Florin100% (1)
- Les Reactions Acido Basiques Cours 3Document4 pagesLes Reactions Acido Basiques Cours 3Brahimi AssalaPas encore d'évaluation
- AciabaseDocument15 pagesAciabaseMoustapha SallPas encore d'évaluation
- Les ReactionsDocument18 pagesLes ReactionsChaymae AyatiPas encore d'évaluation
- Analyse Equilibres Reactions Acide Base PrecipitationDocument50 pagesAnalyse Equilibres Reactions Acide Base PrecipitationCyril GaillardPas encore d'évaluation
- 6-Les Équilibres Acido-BasiquesDocument50 pages6-Les Équilibres Acido-BasiqueslilybarachantPas encore d'évaluation
- Séance 9Document13 pagesSéance 9SantamitoPas encore d'évaluation
- Cours Transformation Acide-BaseDocument5 pagesCours Transformation Acide-BaseRaphaël VILLARETPas encore d'évaluation
- Cours - Sciences Physiques Exemple de Réaction Acido-Basique - 3ème Sciences Exp (2010-2011) MR Slim PDFDocument4 pagesCours - Sciences Physiques Exemple de Réaction Acido-Basique - 3ème Sciences Exp (2010-2011) MR Slim PDFfsfqsPas encore d'évaluation
- Acide BaseDocument35 pagesAcide BaseKhoudia Sy CamaraPas encore d'évaluation
- Reactions Acide BaseDocument14 pagesReactions Acide BaseDjonba PaguerePas encore d'évaluation
- Chap I Equilibres AcidobasiquesDocument28 pagesChap I Equilibres Acidobasiqueselguerchsara68Pas encore d'évaluation
- Reactivité Chimique - Chapitre 2Document69 pagesReactivité Chimique - Chapitre 2abraham LincolnPas encore d'évaluation
- Chapitre IV - L2 PDFDocument15 pagesChapitre IV - L2 PDFSa Mi UniVPas encore d'évaluation
- TP Force D'un Couple Acide-BaseDocument8 pagesTP Force D'un Couple Acide-BaseKhalil OukebdanePas encore d'évaluation
- 3 Acides Et Bases en Solution Aqueuse - 1GCV - LOKO 2022-2023Document6 pages3 Acides Et Bases en Solution Aqueuse - 1GCV - LOKO 2022-2023Said Said AkandjiPas encore d'évaluation
- Cours de Chimie Des Solutions Chapitre 2 Acides Et BasesDocument58 pagesCours de Chimie Des Solutions Chapitre 2 Acides Et Basesmeriemg912Pas encore d'évaluation
- Partie I - Cours Acides Bases 2019Document68 pagesPartie I - Cours Acides Bases 2019Youssef AouinPas encore d'évaluation
- Définitions Des Acides Et Des BasesDocument7 pagesDéfinitions Des Acides Et Des BasesMaria ConstantinoPas encore d'évaluation
- Les Acides Et Les BasesDocument3 pagesLes Acides Et Les BasesRemy HebertPas encore d'évaluation
- Chapitre 2 Acide BaseDocument17 pagesChapitre 2 Acide BaseSouFien MabroukPas encore d'évaluation
- Chimir PHDocument16 pagesChimir PHImane KaPas encore d'évaluation
- Chap 2 Les Acides Et Les BasesDocument4 pagesChap 2 Les Acides Et Les BasessaliPas encore d'évaluation
- Chap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDocument74 pagesChap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDylanPas encore d'évaluation
- Equilibres Acido-BasiquesDocument43 pagesEquilibres Acido-Basiquesattentatalabombe100% (5)
- PH Et SolubilitéDocument34 pagesPH Et SolubilitésafemindPas encore d'évaluation
- Chap1 Acide BaseDocument43 pagesChap1 Acide BaseBtn Princii IsraëlPas encore d'évaluation
- Equilibre Acido-BasiqueDocument44 pagesEquilibre Acido-BasiqueKhaoula OthmaniPas encore d'évaluation
- # 02 Cours Chap 1 Réactions Acide-Base ProfDocument2 pages# 02 Cours Chap 1 Réactions Acide-Base ProfLouisPas encore d'évaluation
- Equilibres Acido-BasiqueDocument38 pagesEquilibres Acido-BasiqueMouniratou NazéPas encore d'évaluation
- Tab 3Document11 pagesTab 3deziri mohamedPas encore d'évaluation
- Chapitre 2Document64 pagesChapitre 2ILHAM AMRAOUIPas encore d'évaluation
- C7 Cours T°S Acide Faible Base Faible Couple Acide Base Et Constante D AciditéDocument11 pagesC7 Cours T°S Acide Faible Base Faible Couple Acide Base Et Constante D AciditéBabacar NdiayePas encore d'évaluation
- C9 ForceDesAcidesEtBasesEleveDocument13 pagesC9 ForceDesAcidesEtBasesEleveYann FourteauPas encore d'évaluation
- Séance 1.091 Acide Base StagiairesDocument7 pagesSéance 1.091 Acide Base Stagiairesaita.kane6Pas encore d'évaluation
- Capture D'écran . 2022-01-29 À 23.52.15 PDFDocument11 pagesCapture D'écran . 2022-01-29 À 23.52.15 PDFAymen NamanePas encore d'évaluation
- Les Acides Et Les BasesDocument59 pagesLes Acides Et Les BasesCarter JeanPas encore d'évaluation
- AcibaseDocument35 pagesAcibaseAbdessamad EttariqiPas encore d'évaluation
- Solutionaqueusechap 2Document6 pagesSolutionaqueusechap 2Kawthar MokhtarPas encore d'évaluation
- C1 - Transformations Acide-BaseDocument2 pagesC1 - Transformations Acide-Basepxy6nghtysPas encore d'évaluation
- Chapitre I Partie 1Document8 pagesChapitre I Partie 1Amna TahriPas encore d'évaluation
- Calcul Du PH Des Solutions AqueusesDocument5 pagesCalcul Du PH Des Solutions AqueusesHassen JinyorPas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Le Produit Ionique de L'eau Pure: Exemple de Neutralisation en CoiffureDocument1 pageLe Produit Ionique de L'eau Pure: Exemple de Neutralisation en CoiffureThierry DucosPas encore d'évaluation
- Fiche Therion Léo Phase 4 Compte Rendu de VisiteDocument7 pagesFiche Therion Léo Phase 4 Compte Rendu de VisiteThierry DucosPas encore d'évaluation
- Le PH Des Produits CapillairesDocument1 pageLe PH Des Produits CapillairesThierry DucosPas encore d'évaluation
- Le Calcul Du PH D'une SolutionDocument1 pageLe Calcul Du PH D'une SolutionThierry DucosPas encore d'évaluation
- Fiche Torres Hugo Phase 4Document8 pagesFiche Torres Hugo Phase 4Thierry DucosPas encore d'évaluation
- Fiche Torres Hugo Phase 4 Compte Rendu de Visite.Document7 pagesFiche Torres Hugo Phase 4 Compte Rendu de Visite.Thierry DucosPas encore d'évaluation
- Fiche KASSANDRA GROSJEAN Phase 4Document7 pagesFiche KASSANDRA GROSJEAN Phase 4Thierry DucosPas encore d'évaluation
- Controle N°1 - BPDocument2 pagesControle N°1 - BPThierry DucosPas encore d'évaluation
- Fiche Signalétique CAP Phase 4Document8 pagesFiche Signalétique CAP Phase 4Thierry DucosPas encore d'évaluation
- Cap Sphy Indust HachetteDocument64 pagesCap Sphy Indust HachetteThierry DucosPas encore d'évaluation
- Fiche Peano Siang Phase 4 Compte Rendue de Visite.Document6 pagesFiche Peano Siang Phase 4 Compte Rendue de Visite.Thierry DucosPas encore d'évaluation
- Progression Sciences Cap SciencesDocument2 pagesProgression Sciences Cap SciencesThierry DucosPas encore d'évaluation
- 1 - 2 Le Chauffage CulinaireDocument13 pages1 - 2 Le Chauffage CulinaireThierry DucosPas encore d'évaluation
- La Structure de La MatièreDocument2 pagesLa Structure de La MatièreThierry DucosPas encore d'évaluation
- Electricite1 1Document5 pagesElectricite1 1Thierry DucosPas encore d'évaluation
- Maths Groupe C 2013Document8 pagesMaths Groupe C 2013francoisabj2004Pas encore d'évaluation
- Maths Groupe C 2013Document8 pagesMaths Groupe C 2013francoisabj2004Pas encore d'évaluation
- Fiche de Déroulement PédagogiqueDocument1 pageFiche de Déroulement PédagogiqueThierry DucosPas encore d'évaluation
- Maths Groupe C 2013Document8 pagesMaths Groupe C 2013francoisabj2004Pas encore d'évaluation
- 2-3 Le Refrigerateur ResumeDocument3 pages2-3 Le Refrigerateur ResumeThierry DucosPas encore d'évaluation
- 1 - 1 Le Chauffage CulinaireDocument13 pages1 - 1 Le Chauffage CulinaireThierry DucosPas encore d'évaluation
- Sujet A10Document1 pageSujet A10Thierry DucosPas encore d'évaluation
- Sujets Maths Groupe C - 2013 1Document5 pagesSujets Maths Groupe C - 2013 1Thierry DucosPas encore d'évaluation
- Sujet b3Document13 pagesSujet b3Thierry DucosPas encore d'évaluation
- Sujet c12 Question 1.3.1Document1 pageSujet c12 Question 1.3.1Thierry DucosPas encore d'évaluation
- Sujet A10Document13 pagesSujet A10Thierry DucosPas encore d'évaluation
- Sujet c12Document13 pagesSujet c12Thierry DucosPas encore d'évaluation
- FNAC AnalyseDocument9 pagesFNAC Analyseboonaertb100% (2)
- Recyclage Et Valorisation de Sédiments Fins de Dragage À Usage de Matériaux RoutiersDocument11 pagesRecyclage Et Valorisation de Sédiments Fins de Dragage À Usage de Matériaux RoutiersSaid MOHAFIDPas encore d'évaluation
- Catalogue Techni-Contact - Broyeur de PlastiqueDocument13 pagesCatalogue Techni-Contact - Broyeur de PlastiquewidadPas encore d'évaluation
- 04-La Malveillance PDFDocument41 pages04-La Malveillance PDFRachid Richard100% (2)
- Imparfait de LDocument2 pagesImparfait de LNastja VogrincPas encore d'évaluation
- Geometrie Analytique de L Espace Corrige Serie D Exercices 1Document6 pagesGeometrie Analytique de L Espace Corrige Serie D Exercices 1Mohamed WidadPas encore d'évaluation
- Caifanes - Afuera (G2)Document4 pagesCaifanes - Afuera (G2)Víctor IbarraPas encore d'évaluation
- LACROIXCity Sogexi FestilumDocument2 pagesLACROIXCity Sogexi FestilumSchwobPas encore d'évaluation
- Instructions de CréationDocument4 pagesInstructions de CréationMimi DzPas encore d'évaluation
- Activité N°3 A3 Vitesse Et DéplacementDocument2 pagesActivité N°3 A3 Vitesse Et DéplacementEmmanuel VionPas encore d'évaluation
- 2016 17.TD - td1 4.sujet Copie - InfoDocument22 pages2016 17.TD - td1 4.sujet Copie - Infofifi foufouPas encore d'évaluation
- Analyse Urbaine MiramarDocument13 pagesAnalyse Urbaine MiramarSkruuu LyPas encore d'évaluation
- 165 12092010Document18 pages165 12092010elmoudjahid_dzPas encore d'évaluation
- Amélioration Des Plantes 2022Document15 pagesAmélioration Des Plantes 2022Brahim GharbiPas encore d'évaluation
- Formation Continue Vieillissement Et Stabilisation Des Polymeres Et ElastomeresDocument1 pageFormation Continue Vieillissement Et Stabilisation Des Polymeres Et ElastomeresAtomer FormationPas encore d'évaluation
- La Scence Et La CriseDocument8 pagesLa Scence Et La CriseNicolas VantisPas encore d'évaluation
- A-TESE 1976 - PesquisaDocument400 pagesA-TESE 1976 - PesquisaBelchiorCosta0% (1)
- Notice - Nesivine Enfant Sine Conservans 10 ML SprayDocument6 pagesNotice - Nesivine Enfant Sine Conservans 10 ML SpraynsssPas encore d'évaluation
- Fondements Psycho-Sociaux de La Définition Des Méssages Éducatifs - S3 - 19Document30 pagesFondements Psycho-Sociaux de La Définition Des Méssages Éducatifs - S3 - 19Mohamed TliliPas encore d'évaluation
- La Nouvelle Norme 5 Les Nouveautés Et Les EnjeuxDocument47 pagesLa Nouvelle Norme 5 Les Nouveautés Et Les EnjeuxSami JaballahPas encore d'évaluation
- Transformations Acide - Base Eleve NDocument2 pagesTransformations Acide - Base Eleve Nblack HPas encore d'évaluation
- 11-Comment Tuer PompeDocument15 pages11-Comment Tuer Pompelee marvin BilongPas encore d'évaluation
- Compendium 2008 FDocument6 pagesCompendium 2008 Fyves2022sahaPas encore d'évaluation
- Tabeau de FluxDocument7 pagesTabeau de FluxZakaria AchirPas encore d'évaluation
- COCOMODocument28 pagesCOCOMOmerde12Pas encore d'évaluation
- ApacheDocument31 pagesApacheAbdelmoumene BoulghalghPas encore d'évaluation
- L2 - B G 1" Examen Écrit 2 Session: PARTIE BIOLOGIE MOLECULAIRE (Note Sur 20 Durée Conseillée: 45 MN)Document3 pagesL2 - B G 1" Examen Écrit 2 Session: PARTIE BIOLOGIE MOLECULAIRE (Note Sur 20 Durée Conseillée: 45 MN)Mohamed SdikPas encore d'évaluation
- Modele Gratuit de Suivi StockDocument16 pagesModele Gratuit de Suivi StockABDOURAHMANE BERETEPas encore d'évaluation
- A QCM Système Nationale de Santé - CS - SROSDocument112 pagesA QCM Système Nationale de Santé - CS - SROSasmae chadli100% (5)
- Contexte de LDocument3 pagesContexte de LKonan Richard Kouassi100% (1)