Académique Documents
Professionnel Documents
Culture Documents
Le Calcul Du PH D'une Solution
Transféré par
Thierry DucosTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Le Calcul Du PH D'une Solution
Transféré par
Thierry DucosDroits d'auteur :
Formats disponibles
D.
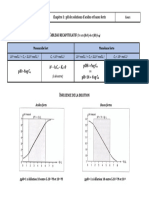
Le calcul du pH d'une solution
■ Calcul du pH d'après la concentration molaire en ions oxonium
Si [Hp+J = 10-11 rnol.l.:' ➔ pH= 11 solution basique
Si [Hp+J = 10-5.92 mol.l.:' ➔ pH= 6,92 solution acide
■ Calcul de la concentration molaire en ions oxonium et hydroxyle
Si Solution pH = 5 ➔ [Hp+J = 1 o-s rnol.L:' [OH-J = 10-9 rnol.l.:'
Si Solution pH = 7, 1 ➔ [Hp+J = 10-1,1 rnol.l.:' [OH-J = 10-5,9 rnol.l.:'
■ Calcul du pH d'après la concentration molaire en ions hydroxyle
On peut calculer le pH d'une solution dont on connaît la concentration molaire en ions OH-,
soit (1) en utilisant la relation pH+ pOH = 14, soit (2) en calculant la concentration molaire de
cette solution en ions oxonium.
(1) Si [OH-J = 10-11 rnol.l.:' ➔ pOH= 11 pl+= 14-11 = 3
(2) Si [OH-J = 10-11 rnol.l.:' ➔ [Hp+J = 10-3 mol.l.:' pH= 3
■ Comparaison du pH de deux solutions
Solution (1) [Hp+J = 10-5 mol.l.:' pH =6
Solution (2) [OH-J = 10-12 mol.l.:' pl+= 14- 12 = 2
Les deux solutions sont acides. Chaque unité sur l'échelle décuple la force ou la faiblesse. La
solution (2) est 10 x 1Ox10 x 10 = 10 000 fois plus acide que la solution (1 ).
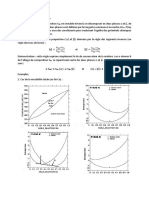
E. L'effet de la dilution sur le pH
La dilution d'une solution rapproche son pH de 7.
• Lorsqu'on dilue par 1 0 une solution d'acide fort, le pH de la solution est augmenté de 1 unité.
Attention, le diluant (eau) étant neutre, le pH restera toujours inférieur à 7.
Exemple: soit une solution d'acide chlorhydrique pH = 1 à diluer 10 fois.
La concentration initiale en ions oxonium est [Hp+J = 10-1 rnol.l.:'. La dilution par 10 rend la
solution 10 fois moins concentrée. La nouvelle concentration molaire en ions oxonium est
[Hp+J = 10-2 rnol.l.:'. Le pH de la solution diluée est 2, il a augmenté d'l unité.
• Lorsqu'on dilue par 10 une solution de base forte, le pH de la solution est diminué de 1 unité.
Attention : le pH restera toujours supérieur à 7.
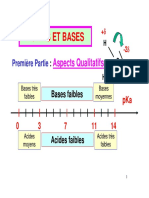
F. L'effet tampon, régulateur du pH
Une solution tampon est une solution dont le pH ne varie pas de façon significative lorsqu'on
ajoute une quantité modérée d'eau, d'acide ou de base.
En coiffure, certaines permanentes sont tamponnées à un pH compris entre 7,5 et 8,5 avec du
bicarbonate d'ammonium. Celui-ci joue le rôle de tampon; de plus il dégage du CO2 sur le cheveu,
ce qui favorise son gonflement. Les permanentes tamponnées sont presque aussi actives mais
moins agressives que les permanentes classiques de pH supérieur.
Chapitre 2 • Les réactions acido-basiques dans l'eau 8
Vous aimerez peut-être aussi
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Exercices Corrigés en ChromatographieDocument13 pagesExercices Corrigés en ChromatographiePeti' Pou89% (66)
- Série Dexercices Corrigés N°2Document7 pagesSérie Dexercices Corrigés N°2chada100% (1)
- Corrigé Série 1Document5 pagesCorrigé Série 1Mohamed ECHAMAI100% (2)
- Electrochimie - TP - Compte Rendu TP PH Métrie 6609Document7 pagesElectrochimie - TP - Compte Rendu TP PH Métrie 6609Khezazna Seif71% (7)
- 7 - La-Force-Des-Acides-Et-Des-Bases-En-Solution-AqueuseDocument15 pages7 - La-Force-Des-Acides-Et-Des-Bases-En-Solution-AqueuseLamia IberoualenePas encore d'évaluation
- 2-Série Acide Base + CorrigéDocument14 pages2-Série Acide Base + Corrigémimi mimiPas encore d'évaluation
- Transformations Associés A Des Reactions Acido Basiques en Solution AqueusesDocument8 pagesTransformations Associés A Des Reactions Acido Basiques en Solution AqueusesJosé Ahanda NguiniPas encore d'évaluation
- Chapitre 3 Le Potentiel Hydrogene Ou PHDocument15 pagesChapitre 3 Le Potentiel Hydrogene Ou PHSimier NoéPas encore d'évaluation
- SEQUENCE06 Acidefortbaseforte 1 STLDocument6 pagesSEQUENCE06 Acidefortbaseforte 1 STLMed BriniPas encore d'évaluation
- Le Produit Ionique de L'eau Pure: Exemple de Neutralisation en CoiffureDocument1 pageLe Produit Ionique de L'eau Pure: Exemple de Neutralisation en CoiffureThierry DucosPas encore d'évaluation
- Les PH Des Solutions Aqueuses PDFDocument4 pagesLes PH Des Solutions Aqueuses PDFAzizElheniPas encore d'évaluation
- Acide 2 Calculs de PH 2Document11 pagesAcide 2 Calculs de PH 2ezezaeaPas encore d'évaluation
- Potentiel HydrogèneDocument13 pagesPotentiel HydrogèneFoudil LaouiciPas encore d'évaluation
- Chapitre 5Document43 pagesChapitre 5Ghady HaidarPas encore d'évaluation
- TP01 Mesures de PH CorrectionDocument3 pagesTP01 Mesures de PH CorrectionPauline LairiePas encore d'évaluation
- Brochure de Chimie TSM Tse (1) - 1Document46 pagesBrochure de Chimie TSM Tse (1) - 1Elhadj BahPas encore d'évaluation
- Acidite D Un VinaigreDocument6 pagesAcidite D Un Vinaigreboudriat ahmedPas encore d'évaluation
- 9-TD Chimie Solution Acide BaseDocument9 pages9-TD Chimie Solution Acide BasePAKOU atoyodi lucPas encore d'évaluation
- Acides Bases TDDocument5 pagesAcides Bases TDSalihou AlhadjiPas encore d'évaluation
- Solutions Acides Et BasiquesDocument6 pagesSolutions Acides Et BasiquesThe BestPas encore d'évaluation
- TD 9 AB I CorrecDocument4 pagesTD 9 AB I CorrecSoukainaBenBoualamPas encore d'évaluation
- Chimie Des Solutions 2022Document26 pagesChimie Des Solutions 2022Mohsine DriowyaPas encore d'évaluation
- Les Solutions Aqueuses IoniquesDocument18 pagesLes Solutions Aqueuses IoniquesMétatron GamesPas encore d'évaluation
- Cours Acide Base 2022Document12 pagesCours Acide Base 2022Aurélie PierratPas encore d'évaluation
- S 245Document4 pagesS 245lyna7otsPas encore d'évaluation
- Chimir PHDocument16 pagesChimir PHImane KaPas encore d'évaluation
- PH Et Équilibre Acido-BasiqueDocument9 pagesPH Et Équilibre Acido-BasiqueAdamPas encore d'évaluation
- Fichier Produit 2232Document48 pagesFichier Produit 2232FlorinaPas encore d'évaluation
- Le PH SuperprofDocument1 pageLe PH Superprofkalinux78brgPas encore d'évaluation
- Les Reactions Chimiques-Uua8Document113 pagesLes Reactions Chimiques-Uua8bafoa.ifmPas encore d'évaluation
- Activités Acide FlorenceDocument9 pagesActivités Acide FlorenceChristophe GourbeyrePas encore d'évaluation
- Faculté Pluridisciplinaire de Nador SVIDocument4 pagesFaculté Pluridisciplinaire de Nador SVIZakaria AsbaiPas encore d'évaluation
- Cours de Biochimie L2BCGSDocument21 pagesCours de Biochimie L2BCGSMamadou lamine DiattaPas encore d'évaluation
- C7 Af BF WahabDiopDocument5 pagesC7 Af BF WahabDiopGaye BachirPas encore d'évaluation
- Cours EtudiantDocument8 pagesCours EtudiantJeremie MangoumbaPas encore d'évaluation
- LC13 - Acides Et Bases (Lycée) : Niveau: TS BibliographieDocument13 pagesLC13 - Acides Et Bases (Lycée) : Niveau: TS BibliographieDiallo SafaiouPas encore d'évaluation
- TP I Analyse de Problèmes Réels Chi Analytique SOLUTION TAMPON CORRIGEEDocument7 pagesTP I Analyse de Problèmes Réels Chi Analytique SOLUTION TAMPON CORRIGEEbouaiedanissa61Pas encore d'évaluation
- TAT Équilibre Acido-BasiqueDocument17 pagesTAT Équilibre Acido-Basiquedrakox.fortnitePas encore d'évaluation
- Correction Dev c2 n2 Bac 2017Document3 pagesCorrection Dev c2 n2 Bac 2017Anis DahnenPas encore d'évaluation
- Acides Faibles Bases FaiblesDocument7 pagesAcides Faibles Bases FaiblesBouaouiche KarimPas encore d'évaluation
- Mission N°2 Mesues Ph& EqDocument4 pagesMission N°2 Mesues Ph& EqAmélie D.Pas encore d'évaluation
- 4 - Chimie TLeDocument52 pages4 - Chimie TLeAnas IsmailPas encore d'évaluation
- Les Solutions Acides Et Basiques Cours 1Document5 pagesLes Solutions Acides Et Basiques Cours 1Amir AliPas encore d'évaluation
- Chapitre 5 PH Des Solutions AqueusesDocument16 pagesChapitre 5 PH Des Solutions AqueusesSyryne DridiPas encore d'évaluation
- DS 7 735 2019-2020 25Document2 pagesDS 7 735 2019-2020 25Joliette KplokaPas encore d'évaluation
- PH 2020 BiragoDocument2 pagesPH 2020 Biragobara ndiayePas encore d'évaluation
- Brochure de Chimie PDFDocument12 pagesBrochure de Chimie PDFAbdoul karim DansokoPas encore d'évaluation
- C9 ForceDesAcidesEtBasesEleveDocument13 pagesC9 ForceDesAcidesEtBasesEleveYann FourteauPas encore d'évaluation
- TP Chimie Compte Rendu Preparation Dune SolutionDocument6 pagesTP Chimie Compte Rendu Preparation Dune SolutionAbdellah BerrouachdiPas encore d'évaluation
- Exposé Sur DosageDocument30 pagesExposé Sur DosageFaiçalEssabery100% (2)
- Equilibre Acido-Basique 2019Document44 pagesEquilibre Acido-Basique 2019Théophile NAMOINEPas encore d'évaluation
- 5-Transformations Acide-Base Solution AqueuseDocument4 pages5-Transformations Acide-Base Solution AqueusesdoulajPas encore d'évaluation
- Chapitre 3 - PH AF Et BF - CoursDocument1 pageChapitre 3 - PH AF Et BF - CoursGODANI PhilippePas encore d'évaluation
- Correction de La Série 1Document3 pagesCorrection de La Série 1zohirPas encore d'évaluation
- Brochure de Chimie Tle Chimie MinéraleDocument60 pagesBrochure de Chimie Tle Chimie MinéraleokouejeanjuniorPas encore d'évaluation
- Transformation Et Réaction Acido-BasiqueDocument15 pagesTransformation Et Réaction Acido-BasiqueaffanefatimaezzahraaPas encore d'évaluation
- C5Chim - Reactions - Acidobasiques - Exercices - Bronsted-Lowry PDFDocument4 pagesC5Chim - Reactions - Acidobasiques - Exercices - Bronsted-Lowry PDFAzizElheniPas encore d'évaluation
- TP 04 Dosage Volumetrique de Deux Produit Domestiques Esprit de Sel Et DeboucherDocument4 pagesTP 04 Dosage Volumetrique de Deux Produit Domestiques Esprit de Sel Et DeboucherManel SiaciPas encore d'évaluation
- TP 04 Dosage Volumetrique de Deux Produit Domestiques Esprit de Sel Et DeboucherDocument4 pagesTP 04 Dosage Volumetrique de Deux Produit Domestiques Esprit de Sel Et Deboucherinc onnue100% (1)
- Bac Blanc (Chimie) GSFADocument3 pagesBac Blanc (Chimie) GSFAahmed amilPas encore d'évaluation
- Acide BaseDocument35 pagesAcide BaseKhoudia Sy CamaraPas encore d'évaluation
- Les Réactions Acido-Basiques Dans L'eau: - Nûii4t IIDocument1 pageLes Réactions Acido-Basiques Dans L'eau: - Nûii4t IIThierry DucosPas encore d'évaluation
- Fiche Torres Hugo Phase 4 Compte Rendu de Visite.Document7 pagesFiche Torres Hugo Phase 4 Compte Rendu de Visite.Thierry DucosPas encore d'évaluation
- G - I:i4mii#8Document1 pageG - I:i4mii#8Thierry DucosPas encore d'évaluation
- Le PH Des Produits CapillairesDocument1 pageLe PH Des Produits CapillairesThierry DucosPas encore d'évaluation
- G - Iriyiml H - : Dissolution D'Une Base Forte, L'Hydroxyde de Sodium NaohDocument1 pageG - Iriyiml H - : Dissolution D'Une Base Forte, L'Hydroxyde de Sodium NaohThierry DucosPas encore d'évaluation
- Fiche Therion Léo Phase 4 Compte Rendu de VisiteDocument7 pagesFiche Therion Léo Phase 4 Compte Rendu de VisiteThierry DucosPas encore d'évaluation
- Fiche Signalétique CAP Phase 4Document8 pagesFiche Signalétique CAP Phase 4Thierry DucosPas encore d'évaluation
- Fiche Torres Hugo Phase 4Document8 pagesFiche Torres Hugo Phase 4Thierry DucosPas encore d'évaluation
- Fiche KASSANDRA GROSJEAN Phase 4Document7 pagesFiche KASSANDRA GROSJEAN Phase 4Thierry DucosPas encore d'évaluation
- Controle N°1 - BPDocument2 pagesControle N°1 - BPThierry DucosPas encore d'évaluation
- Maths Groupe C 2013Document8 pagesMaths Groupe C 2013francoisabj2004Pas encore d'évaluation
- Cap Sphy Indust HachetteDocument64 pagesCap Sphy Indust HachetteThierry DucosPas encore d'évaluation
- Progression Sciences Cap SciencesDocument2 pagesProgression Sciences Cap SciencesThierry DucosPas encore d'évaluation
- Fiche de Déroulement PédagogiqueDocument1 pageFiche de Déroulement PédagogiqueThierry DucosPas encore d'évaluation
- Fiche Peano Siang Phase 4 Compte Rendue de Visite.Document6 pagesFiche Peano Siang Phase 4 Compte Rendue de Visite.Thierry DucosPas encore d'évaluation
- La Structure de La MatièreDocument2 pagesLa Structure de La MatièreThierry DucosPas encore d'évaluation
- Maths Groupe C 2013Document8 pagesMaths Groupe C 2013francoisabj2004Pas encore d'évaluation
- Electricite1 1Document5 pagesElectricite1 1Thierry DucosPas encore d'évaluation
- 2-3 Le Refrigerateur ResumeDocument3 pages2-3 Le Refrigerateur ResumeThierry DucosPas encore d'évaluation
- 1 - 2 Le Chauffage CulinaireDocument13 pages1 - 2 Le Chauffage CulinaireThierry DucosPas encore d'évaluation
- 1 - 1 Le Chauffage CulinaireDocument13 pages1 - 1 Le Chauffage CulinaireThierry DucosPas encore d'évaluation
- Maths Groupe C 2013Document8 pagesMaths Groupe C 2013francoisabj2004Pas encore d'évaluation
- Sujet A10Document1 pageSujet A10Thierry DucosPas encore d'évaluation
- Sujet c12 Question 1.3.1Document1 pageSujet c12 Question 1.3.1Thierry DucosPas encore d'évaluation
- Sujet A10Document13 pagesSujet A10Thierry DucosPas encore d'évaluation
- Sujet c12Document13 pagesSujet c12Thierry DucosPas encore d'évaluation
- Sujet b3Document13 pagesSujet b3Thierry DucosPas encore d'évaluation
- Sujets Maths Groupe C - 2013 1Document5 pagesSujets Maths Groupe C - 2013 1Thierry DucosPas encore d'évaluation
- Vitesse de CorrosionDocument3 pagesVitesse de CorrosionAmirPas encore d'évaluation
- Demande Inscription Oncours 2022Document4 pagesDemande Inscription Oncours 2022Ibrahima Mamadou DramePas encore d'évaluation
- TP ChaleurDocument20 pagesTP ChaleurKaoutar CrusPas encore d'évaluation
- Cours Absorption +extraction Liquide Liquide 24-01-2021Document32 pagesCours Absorption +extraction Liquide Liquide 24-01-2021Fouad MihoubPas encore d'évaluation
- Les PolymeresDocument9 pagesLes PolymeresfatihamPas encore d'évaluation
- Chimie Minérale Cours 23-24Document31 pagesChimie Minérale Cours 23-24Yvon mezuiPas encore d'évaluation
- SGE M1 Physico Chimie 2 3 2006Document51 pagesSGE M1 Physico Chimie 2 3 2006Mohamed CHIBANPas encore d'évaluation
- BiochimieDocument3 pagesBiochimieb9rgpvqvmpPas encore d'évaluation
- Techniques D'analyseDocument7 pagesTechniques D'analysesusCities75% (4)
- Unité de Réfrigeration IndustrielleDocument7 pagesUnité de Réfrigeration Industriellemarwan2nouichiPas encore d'évaluation
- IntroductionDocument5 pagesIntroductionDometanhan TuoPas encore d'évaluation
- Procédure de CalculDocument17 pagesProcédure de CalculBaha-Eddine ElmoufadalPas encore d'évaluation
- Orniformation Probatoire 1999 A PhysiqueDocument2 pagesOrniformation Probatoire 1999 A PhysiqueBoniface KouamPas encore d'évaluation
- 1 - ESIReims - Froid Dans Le Monde - 2020 - v2Document21 pages1 - ESIReims - Froid Dans Le Monde - 2020 - v2Ibrahim ZouinePas encore d'évaluation
- Partie-Iii Cours Solaire Thermique M1ermDocument10 pagesPartie-Iii Cours Solaire Thermique M1ermpenda gueyePas encore d'évaluation
- TP Chimie PhysiqueDocument9 pagesTP Chimie PhysiquekhaledrevialPas encore d'évaluation
- Cours de Chromatographie L3 Pro Synthese PDFDocument20 pagesCours de Chromatographie L3 Pro Synthese PDFbdh20045450Pas encore d'évaluation
- EVALUATION N1 2023 PCT 3eme-1Document2 pagesEVALUATION N1 2023 PCT 3eme-1salahoud-dine soulayePas encore d'évaluation
- Modèle Weatherland DZABANA Phys 2Document22 pagesModèle Weatherland DZABANA Phys 2Presli KprtinoPas encore d'évaluation
- Fonctionnement D Un Congelateur EnonceDocument5 pagesFonctionnement D Un Congelateur EnonceAbdePas encore d'évaluation
- CM AtoL1 1 PDFDocument66 pagesCM AtoL1 1 PDFNicaise Amani YaoPas encore d'évaluation
- Physique 1ère D&C 2019Document4 pagesPhysique 1ère D&C 2019Oumarou AbdouPas encore d'évaluation
- Principes de La Lyophilisation - Le LyophilisateurDocument250 pagesPrincipes de La Lyophilisation - Le Lyophilisateurjose sanchezPas encore d'évaluation
- Dai Fichesureindustrie Reseauvapeur Edition2010Document22 pagesDai Fichesureindustrie Reseauvapeur Edition2010tazi kokoPas encore d'évaluation
- Tableau ChimieDocument38 pagesTableau Chimieemilie cyrPas encore d'évaluation
- Règle Des Segments InversesDocument5 pagesRègle Des Segments InversesMouad GuendouzPas encore d'évaluation
- Révision Cristallo 01 - CorrigéDocument8 pagesRévision Cristallo 01 - Corrigéabdeladimelgouryani2023Pas encore d'évaluation
- TP Méthodologie de Biologie Moléculaire PDFDocument8 pagesTP Méthodologie de Biologie Moléculaire PDFyounes chouaiPas encore d'évaluation