Académique Documents
Professionnel Documents
Culture Documents
Chapitre 10
Transféré par
Gabriel Lapointe-GuayTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Chapitre 10
Transféré par
Gabriel Lapointe-GuayDroits d'auteur :
Formats disponibles
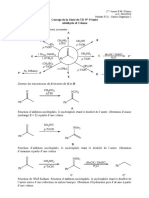
Solutionnaire – Chapitre 10
Page 469 du manuel
10.1 La classification des alcools dépend du nombre de groupements alkyles (R) liés au carbone α, soit le
carbone sp3 porteur du groupement hydroxyle.
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 1
Reproduction interdite © TC Média Livres Inc.
Page 473 du manuel
10.2 Dans le cas de la solubilité, plus la portion non polaire est compacte (↑ ramifications, ↓ de la
surface de contact), moins cette région a des répercussions sur le réseau de ponts hydrogène de
la fonction alcool avec l’eau. Elle sera donc plus soluble. Dans le tableau 10.2 (voir p. 445), le
2,2-diméthylpropan-1-ol est plus soluble que le 2-méthylbutan-1-ol et que le pentan-1-ol, car il
est le plus ramifié de ces trois isomères alcools. En ce qui concerne le point d’ébullition, il
augmente à mesure que la chaîne de carbones s’allonge (avec le moins grand nombre de
ramifications possible), car les forces de dispersion de London sont de plus en plus nombreuses.
Donc, le pentan-1-ol possède un point d’ébullition plus élevé que le 2-méthylbutan-1-ol et que
le 2,2-diméthylpropan-1-ol, car il est non ramifié.
Page 477 du manuel
10.3 Le substituant électroattracteur aldéhyde (—CHO) doit être localisé en position ortho ou para du
groupement — OH du phénol pour que l’effet de la résonance soit plus marqué. Étant donné un
plus grand nombre de formes limites de résonance, les isomères ortho et para sont plus acides
que le méta. Par ailleurs, c’est la proximité de l’effet inductif attractif de l’aldéhyde qui permet
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 2
Reproduction interdite © TC Média Livres Inc.
d’expliquer que l’isomère ortho est plus acide que l’isomère para, car ces deux isomères ont le
même nombre de formes limites de résonance.
Formes limites de résonance de la fonction aldéhyde en position ortho (il y en a six) :
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 3
Reproduction interdite © TC Média Livres Inc.
Formes limites de résonance de la fonction aldéhyde en position méta (il y en a cinq) :
Formes limites de résonance de la fonction aldéhyde en position para (il y en a six) :
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 4
Reproduction interdite © TC Média Livres Inc.
Page 478 du manuel
10.4 Tout d’abord, les alcools sont de moins bons acides que les phénols, puisqu’il y a résonance possible
dans les ions phénolate.
Parmi les deux alcools, le 2, 2, 2-trifluoroéthanol est un acide plus fort que le 3, 3, 3-trifluoropropan-
1-ol en raison de la proximité de l’effet inductif attractif généré par l’électronégativité des atomes de
fluor.
En ce qui concerne les trois phénols, plus un substituant attire les électrons du cycle (où plus d’un
substituant est électroattracteur), plus il facilite la rupture de la liaison O—H, et donc meilleur est
l’acide. De ce fait, les substituants nitros sont plus électroattracteurs que les substituants chloros ; le 2,
4, 6-trinitrophénol est donc un meilleur acide que le 2, 4, 6-trichlorophénol. Ce dernier est à son tour
un meilleur acide que le
2, 4, 6-triméthylphénol en raison de l’effet inductif répulsif des groupements — CH3 (↓ caractère
acide).
L’ordre croissant d’acidité est donc :
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 5
Reproduction interdite © TC Média Livres Inc.
Page 479 du manuel
10.5
Page 485 du manuel (exercices 10.6-10.7)
10.6 a)
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 6
Reproduction interdite © TC Média Livres Inc.
b)
c)
d) Puisqu’il s’agit d’un alcool tertiaire, le 1-méthylcyclopentanol réagit selon un mécanisme de
SN1. Comme cela a été démontré dans le chapitre 9, l’étape qui détermine la vitesse d’une
réaction de SN1 dépend du substrat seulement, d’où la loi de vitesse suivante :
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 7
Reproduction interdite © TC Média Livres Inc.
e) Il n’y aura aucune incidence, car la vitesse de cette réaction ne dépend pas de l’acide utilisé.
La vitesse ne dépend que de la nature de l’alcool et donc de sa facilité à former le
carbocation (étape limitante).
10.7 a)
b) Dans ce cas, la première étape est la protonation du pentan-1-ol, suivie de l’attaque
nucléophile de l’ion halogénure sur le carbone lié au groupe partant selon un mécanisme de
type SN2, car le pentan-1-ol est un alcool primaire. La loi de vitesse est donc :
v=k O X
H
Comme cela a été démontré dans le chapitre 9, la réaction de SN2 est dépendante non
seulement du réactif, mais également du substrat. Un des paramètres qui influence la vitesse
est la force du nucléophile. Plus ce dernier est fort, plus la réaction est rapide. Ainsi, étant
donné que I− est un meilleur nucléophile que Cl−, la réaction se déroulera plus rapidement
avec HI.
Remarque : Le Cl− est un nucléophile trop faible pour permettre une attaque efficace sur les
alcools primaires par un mécanisme de SN2.
c) Bien que le Cl− soit un moins bon nucléophile que le I−, la présence du catalyseur ZnCl2
augmente la vitesse de la réaction en fragilisant la liaison C—O. L’ajout du catalyseur rend
donc la réaction possible avec l’acide chlorhydrique.
Page 486 du manuel (exercices 10.8-10.10)
10.8 a) Réaction globale
OH Cl
HCl
ZnCl2
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 8
Reproduction interdite © TC Média Livres Inc.
Mécanisme
b) Réaction globale
HO HCl HO
OH Cl
Les alcools primaires ne réagissent pas avec le HCl à la
température ambiante et sans catalyseur. +
HO
Cl
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 9
Reproduction interdite © TC Média Livres Inc.
Mécanisme
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 10
Reproduction interdite © TC Média Livres Inc.
10.9 a)
b)
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 11
Reproduction interdite © TC Média Livres Inc.
10.10
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 12
Reproduction interdite © TC Média Livres Inc.
Page 489 du manuel (exercices 10.11-10.12)
10.11
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 13
Reproduction interdite © TC Média Livres Inc.
10.12 a) Les alcools primaires sont déshydratés en employant des conditions réactionnelles plus
vigoureuses telles que de l’acide sulfurique concentré et des températures élevées.
Remarque : Il est intéressant de constater qu’il peut exister plusieurs voies de synthèse pour
une même molécule telle que le styrène. Dans l’exercice 9.24 (voir p. 463), le styrène a été
synthétisé à partir du benzène et d’un réactif de Grignard.
b) Après la conversion de l’alcool en un bon groupe partant, le styrène est obtenu selon un
mécanisme de type E2.
Mécanisme de la déshydratation du 2-phényléthanol
Après la conversion de l’alcool en un bon groupe partant, le styrène est obtenu selon un
mécanisme de type E1.
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 14
Reproduction interdite © TC Média Livres Inc.
Mécanisme de la déshydratation du 1-phényléthanol
c) Même si le 2-phényléthanol est un alcool primaire, l’élimination est énergétiquement
favorable, car l’alcène obtenu est conjugué avec le cycle aromatique.
Page 492 du manuel
10.13
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 15
Reproduction interdite © TC Média Livres Inc.
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 16
Reproduction interdite © TC Média Livres Inc.
Page 500 du manuel (exercices 10.14-10.16)
10.14
Remarque: Dans le cas de la réaction avec l'acide sulfurique concentré, il est également possible
d'obtenir le produit provenant de la sulfonation du phénol en position ortho (voir tableau 10.4).
Toutefois, si l'on chauffe au-delà de 100 °C, la sulfonation du phénol se fait majoritairement en para,
mais cette possibilité doit être rejetée, car la position para est déjà occupée.
10.15 Puisque le groupe hydroxyle —OH est un meilleur activant (activant fort) que les groupements alkyles
(activants faibles), la substitution électrophile aromatique du thymol peut avoir lieu soit en para, soit
en ortho du groupe hydroxyle. Or, la position para est privilégiée afin d’éviter quatre substituants
adjacents (isomère moins stable, ayant un plus grand encombrement stérique). De plus, dans le cas de
la sulfonation, l’isomère para est d’autant plus favorisé si la température est élevée (voir tableau
10.4).
10.16 a) Comme cela a été discuté dans le chapitre 8, le groupement le plus activant dirige la
réaction. Puisque le groupe hydroxyle —OH est un activant fort et que le groupe bromo —
Br est un désactivant faible, la substitution électrophile peut avoir lieu en positon ortho et
para du groupement —OH.
Le groupe hydroxyle étant un activant fort, des conditions réactionnelles beaucoup plus
douces que celles employées avec le benzène sont utilisées d’où l’absence de AlCl3 ou de
FeCl3.
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 17
Reproduction interdite © TC Média Livres Inc.
b) Puisque le groupe hydroxyle est un meilleur activant (activant fort) que le groupe méthyle
(activant faible), la substitution aura lieu en ortho du groupe hydroxyle (la position en para
ne subit pas de substitution, puisqu’elle est déjà occupée par le —CH3).
Le groupe hydroxyle étant un activant fort, des conditions réactionnelles beaucoup plus
douces que celles employées avec le benzène sont utilisées d’où l’absence du
catalyseur FeBr3.
Exercices récapitulatifs
Propriétés physiques des alcools
Page 507 du manuel (exercices 10.1-10.5)
10.1 Les molécules d’alcool renferment une liaison covalente O—H fortement polaire en raison de la
grande différence d’électronégativité entre l’atome d’hydrogène et l’atome d’oxygène. Cette
importante polarisation permet aux molécules d’alcool de réaliser de fortes attractions
intermoléculaires de type ponts hydrogène. Par conséquent, les alcools ont des points d’ébullition
relativement plus élevés comparativement aux éthers de masses molaires similaires, car ces
derniers ne peuvent pas réaliser de ponts hydrogène entre leurs molécules.
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 18
Reproduction interdite © TC Média Livres Inc.
L’ordre croissant du point d’ébullition est donc :
10.2 En raison du grand nombre de ponts hydrogène, les polyols ont une grande solubilité dans l’eau.
D’autre part, bien que les composés halogénés soient en général polaires, ils ne sont toutefois pas
solubles dans l’eau ou, du moins, très peu (voir le chapitre 9). Les alcanes, quant à eux, sont
insolubles dans l’eau.
L’ordre décroissant de solubilité dans l’eau est donc :
Caractères acide et basique des alcools et des phénols
10.3 L’alcool peut agir comme une base en milieu acide.
Les phénols (pKa ≈ 10) sont de bons acides par rapport aux alcools (pKa ≈ 15). La protonation
sera plus difficile en milieu acide. Leur caractère basique est plus faible, car le doublet
d’électrons sur l’oxygène est délocalisé par résonance avec le cycle aromatique.
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 19
Reproduction interdite © TC Média Livres Inc.
10.4 Le phénol possède une acidité beaucoup plus forte (pKa = 10) que l’alcool benzylique
(pKa = 15,40). Cela s’explique par l’obtention d’une base conjuguée, soit l’ion phénolate, plus stable
que l’ion alcoolate, car l’ion phénolate possède un grand nombre de formes limites de résonance. En
effet, contrairement à l’ion alcoolate, la charge négative sur l’atome d’oxygène de l’ion phénolate est
délocalisée par résonance, ce qui favorise la dissociation du proton H+.
10.5
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 20
Reproduction interdite © TC Média Livres Inc.
Page 508 du manuel (exercices 10.6-10.8)
Réactions des alcools et des phénols
10.6 a) Il s’agit du butan-2-ol.
b) Il faut avoir recours à l’oxydation des alcools.
c) OH O
CrO3
CH3 CH CH2 CH3 CH3 C CH2 CH3
H2SO4, acétone
(réactif de Jones)
OH O
K2Cr2O7
CH3 CH CH2 CH3 CH3 C CH2 CH3
H2SO4, H2O
OH O
KMnO4 conc.
CH3 CH CH2 CH3 CH3 C CH2 CH3
OH O
PCC
CH3 CH CH2 CH3 CH3 C CH2 CH3
O O O
OH O
CH3 S CH3 , Cl C C Cl
CH3 CH CH2 CH3 CH3 C CH2 CH3
Et3N, CH2Cl2, −60 °C
(oxydation de Swern)
d) L’oxydation de Swern et l’oxydation au KMnO4 seraient de bonnes options. En effet, employant le
diméthylsulfoxyde (DMSO) et le chlorure d’oxalyle, l’oxydation de Swern permet des conditions
réactionnelles douces, telles qu’une basse température, et évite d’avoir recours au chrome, un
métal toxique. Notons cependant que la réaction de Swern entraîne la formation de sulfure de
diméthyle, un produit très malodorant.
Pour sa part, le KMnO4 serait une alternative intéressante, puisqu’il évite également d’avoir
recours au chrome.
e) En plus de la chromatographie, de l’utilisation de révélateurs chimiques, des points d’ébullition,
etc., il pourrait se servir d’une technique de spectroscopie. Par exemple, avec la spectroscopie
infrarouge, il serait possible de voir la disparition de la bande d’absorption caractéristique de
l’alcool de départ entre 3550 et 3200 cm− 1 et la formation de la bande caractéristique de la
fonction cétone entre 1725 et 1705 cm− 1.
10.7 Étant donné que le carbone porteur du groupement hydroxyle est tertiaire, il ne peut pas s’oxyder.
Toutefois, comme cela a été vu dans le chapitre 7, la présence du permanganate de potassium
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 21
Reproduction interdite © TC Média Livres Inc.
concentré permet de faire une oxydation forte des fonctions alcènes présentes.
OH OH
OH O
KMnO4 conc.
+
H 3O +
HO O
O
O
10.8
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 22
Reproduction interdite © TC Média Livres Inc.
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 23
Reproduction interdite © TC Média Livres Inc.
Page 509 du manuel (exercices 10.9-10.11)
10.9 a) L’alizarine subit une oxydation comme les benzènediols.
O O
b) Ag2O, Et2O et Na2SO4
10.10
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 24
Reproduction interdite © TC Média Livres Inc.
10.11 a)
b)
c)
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 25
Reproduction interdite © TC Média Livres Inc.
Page 510 du manuel (exercices 10.12-10.15)
10.12 a)
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 26
Reproduction interdite © TC Média Livres Inc.
b)
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 27
Reproduction interdite © TC Média Livres Inc.
10.13
10.14 A : O B: O
OH OH
O OH
O OH
C: O D: H
O
OH
OH OH
OH
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 28
Reproduction interdite © TC Média Livres Inc.
E: F:
Br OH OH
ou
OH O MgBr OH
OH OH O MgBr
G:
OH
OH
10.15 a)
b)
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 29
Reproduction interdite © TC Média Livres Inc.
c) OH O
PCC
OMgCl
OH Cl MgCl
HCl Mg
ZnCl2 Et2O
H2O
H O+
3
OH
Il existe plusieurs autres manières de réaliser cette synthèse. Tout d’abord, l’oxydation de
l’alcool secondaire en cétone peut se faire également avec les réactifs de Jones ou de Swern.
Ensuite, il est également possible de synthétiser des composés halogénés à partir d’alcools en
ayant recours au HBr, au HI, au chlorure de thionyle (SOCl2) ou à un halogénure de phosphore
(PBr3 ou PI3).
d) OH O
1) BH3 PCC
2) H2O2, OH−
OH O
L’oxydation d’un alcool primaire en aldéhyde peut également être réalisée avec le réactif de
Swern.
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 30
Reproduction interdite © TC Média Livres Inc.
e) Cl
H2 Cl2 NaOH
Ni de Raney h
ou
Pd/C, forte
pression et
température KMnO4 dilué
très élevée MCPBA
OH
OH
H2O
H2SO4
En milieu acide, l’oxygène de
OH
l’époxyde se protone et
devient un bon groupe partant.
Une molécule d’eau peut
attaquer l’un des carbones de
l’époxyde (pour de plus OH
amples explications, voir la
section 11.5.1.2., p. 502)
f)
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 31
Reproduction interdite © TC Média Livres Inc.
Autre possibilité de synthèse :
La dernière étape de cette synthèse n’est pas avantageuse, car elle ne donne qu’un rendement
de 50 %, car le brome a autant de chance de se fixer en position 2 qu’en position 3.
g)
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 32
Reproduction interdite © TC Média Livres Inc.
Page 511 du manuel (exercices 10.16-10.17)
10.16
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 33
Reproduction interdite © TC Média Livres Inc.
10.17
Page 512 du manuel (exercices 10.18-10.19)
Problèmes à indices
10.18 1) La formule moléculaire du composé est C5H12O.
Il faut reprendre les règles vues dans le chapitre 3 dans le cadre du calcul du nombre
d’insaturation dans un composé organique.
Règle 1 : CnH2n + 2 = C5H2 × 5 + 2 = C5H12
Règle 2 et Règle 3 : [12 H − (12 + 0) H] / 2 H = 0
Il n’y a donc aucune insaturation et aucun cycle.
2) Puisque la réaction avec le HCl est très lente, l’alcool ne peut pas être tertiaire. De plus, puisque
l’alcool réagit en quelques minutes en présence de ZnCl2, il s’agit d’un alcool secondaire (l’alcool
primaire réagissant très lentement, même en présence de ZnCl 2). Il s’agit bel et bien d’un alcool,
puisqu’une déshydratation possible est confirmée au point 4).
3) Si un mélange racémique est obtenu à la suite de la réaction avec le test de Lucas, c’est qu’il y a
présence d’un carbone stéréogénique dans le produit obtenu. Le carbone qui porte le groupement
alcool se doit donc de porter quatre substituants différents. Les possibilités sont donc :
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 34
Reproduction interdite © TC Média Livres Inc.
4) Selon la règle de Zaïtzev, la déshydratation de la première molécule (celle de gauche) donne un
produit disubstitué, alors que la déshydratation de la seconde molécule (celle de droite) donne un
produit trisubstitué. La première molécule est donc le composé A inconnu.
10.19 1) La formule moléculaire du composé est C5H12O2.
Il faut reprendre les règles vues dans le chapitre 3 dans le cadre du calcul du nombre
d’insaturation dans un composé organique.
Règle 1 : CnH2n + 2 = C5H2 × 5 + 2 = C5H12
Règle 2 et Règle 3 : [12 H − (12 + 0) H] / 2 H = 0
Il n’y a donc aucune insaturation et aucun cycle.
2) Puisque l’oxydation au PCC donne un aldéhyde et un alcool, il faut en déduire que la molécule
de départ possède un alcool tertiaire (qui ne s’oxyde pas) et un alcool primaire ; les alcools
secondaires s’oxydent en cétone. Ainsi, il reste deux possibilités de structure, soit :
OH OH
ou OH
OH
3) Dans le cas de la seconde molécule (celle de droite au point 2), il est impossible de déshydrater
l’alcool primaire, car il n’y a pas d’hydrogène sur le carbone en position β. Par opposition, la
déshydratation de la première molécule (celle de gauche) mène bien à la structure proposée :
La molécule de gauche est donc le composé.
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 35
Reproduction interdite © TC Média Livres Inc.
OH
OH
Remarque : Il est possible d’observer dans la molécule déshydratée que la liaison double la plus
substituée n’a pas été obtenue dans le cas de l’alcool tertiaire. Cela s’explique par le fait que les
diènes conjugués permettent une résonance au sein de la molécule, ce qui offre une plus grande
stabilité pour la molécule.
Chimie organique 1, 2e édition – Solutionnaire du chapitre 10 36
Reproduction interdite © TC Média Livres Inc.
Vous aimerez peut-être aussi
- ExercicesChimieOrganique PDFDocument85 pagesExercicesChimieOrganique PDFDaniel Cameron89% (9)
- CHIMIEDocument108 pagesCHIMIEdazePas encore d'évaluation
- Glucides: Les Grands Articles d'UniversalisD'EverandGlucides: Les Grands Articles d'UniversalisPas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Chimie Organique 1année MedecineDocument217 pagesChimie Organique 1année MedecineSomah DOUMBIA100% (1)
- Le Système National de Santé.Document20 pagesLe Système National de Santé.mouaaline100% (5)
- ReformingDocument243 pagesReformingSarah sarah100% (2)
- A 1 3 Mecanisme sn2Document5 pagesA 1 3 Mecanisme sn2Yc YacinePas encore d'évaluation
- Catalogo de Parte L70e PDFDocument1 218 pagesCatalogo de Parte L70e PDFFernando Granizo100% (1)
- Chapitre 11Document34 pagesChapitre 11Gabriel Lapointe-GuayPas encore d'évaluation
- Chapitre 9Document69 pagesChapitre 9Gabriel Lapointe-GuayPas encore d'évaluation
- Chapitre 8Document41 pagesChapitre 8Gabriel Lapointe-GuayPas encore d'évaluation
- ResineDocument16 pagesResineHenadi GhomrianePas encore d'évaluation
- 4 Chimie Orga ch5 Partie2Document22 pages4 Chimie Orga ch5 Partie2Youssef Ell AmriPas encore d'évaluation
- Hydrocarbures Insatures MedDocument12 pagesHydrocarbures Insatures MedousmaneditbakoresyllaPas encore d'évaluation
- Chimie Organique Cours Sur Les AlcoolsDocument12 pagesChimie Organique Cours Sur Les AlcoolsKone KouweltonPas encore d'évaluation
- Chim 306 - Notes de CoursDocument43 pagesChim 306 - Notes de Coursnatural recipePas encore d'évaluation
- A 4 Addition Nucleophile PDFDocument9 pagesA 4 Addition Nucleophile PDFimadePas encore d'évaluation
- Chimie Organométallique Application À La Catalyse HomogèneDocument4 pagesChimie Organométallique Application À La Catalyse HomogèneBouloudani100% (1)
- Cours Grandes Fonctions 2022-2023Document39 pagesCours Grandes Fonctions 2022-2023Kossivi issa SALOUFOUPas encore d'évaluation
- Al7sp02tepa0213 Sequence 09Document63 pagesAl7sp02tepa0213 Sequence 09Oussam OuadidiPas encore d'évaluation
- Cinetique Chapitre3Document12 pagesCinetique Chapitre3Khalil YoucefPas encore d'évaluation
- SFC36104 TD 5e71ed80be770Document42 pagesSFC36104 TD 5e71ed80be770Abdou AdPas encore d'évaluation
- Document AP Mecanismes Reactionnels Correction FinalDocument8 pagesDocument AP Mecanismes Reactionnels Correction FinalSilento SwordPas encore d'évaluation
- Chap 4 Notion de Catalyse-1Document47 pagesChap 4 Notion de Catalyse-1fadoua lakouissiPas encore d'évaluation
- Alcool 1Document25 pagesAlcool 1Cecile SpykilinePas encore d'évaluation
- 2010 Lyon Walchshofer Radix AlcanesCoursDocument2 pages2010 Lyon Walchshofer Radix AlcanesCoursAlisson AlainPas encore d'évaluation
- Document AP Mecanismes Reactionnels Correction Final 2Document7 pagesDocument AP Mecanismes Reactionnels Correction Final 2louloute2883Pas encore d'évaluation
- Gpis2chorga Part3 Etud2122Document23 pagesGpis2chorga Part3 Etud2122belkacemPas encore d'évaluation
- Cours de Chimie Orga DESC I-1Document45 pagesCours de Chimie Orga DESC I-1emmanuel cerda adonaïPas encore d'évaluation
- L2 Cours Chimie OrganiqueDocument14 pagesL2 Cours Chimie OrganiqueBeny MaboundaPas encore d'évaluation
- Les AlcèneDocument11 pagesLes AlcèneŚặł Ặĥ ßŏukĥíặřPas encore d'évaluation
- Sebti Cours Chimie Organique 2 SMC S3 2013-2014Document39 pagesSebti Cours Chimie Organique 2 SMC S3 2013-2014ilyasarmy100% (1)
- Aldehydes Et CetonesDocument14 pagesAldehydes Et CetonesSamba BarhamPas encore d'évaluation
- Additions Électrophiles Sur La Double-Liaison C C (1710)Document6 pagesAdditions Électrophiles Sur La Double-Liaison C C (1710)AxellePas encore d'évaluation
- TD 13Document4 pagesTD 13ra kaPas encore d'évaluation
- B 2 2 Exemples de Substitution Elec 2Document7 pagesB 2 2 Exemples de Substitution Elec 2mohsatPas encore d'évaluation
- Chimie organiqueNMDocument7 pagesChimie organiqueNMAhmedPas encore d'évaluation
- Chimie OrganiqueDocument16 pagesChimie OrganiqueNour Allah tabibPas encore d'évaluation
- Mecanisme SN1Document5 pagesMecanisme SN1Blondet RomaricPas encore d'évaluation
- Chim311-2021-Mécanismes RéactionelsDocument51 pagesChim311-2021-Mécanismes RéactionelsKornichonPas encore d'évaluation
- 1 alcanes-LFSNADocument3 pages1 alcanes-LFSNAmohsatPas encore d'évaluation
- 2016 AmSud Exo2 Sujet Benzaldehyde 9ptsDocument7 pages2016 AmSud Exo2 Sujet Benzaldehyde 9ptsRichad NaziralyPas encore d'évaluation
- Épreuve de Chimie MCBDocument12 pagesÉpreuve de Chimie MCBayissi JeanPas encore d'évaluation
- Cours Egfo Pc2!20!21Document77 pagesCours Egfo Pc2!20!21akissiyapi555Pas encore d'évaluation
- Chimie TleD SommativeDocument2 pagesChimie TleD SommativeNehete BarkaPas encore d'évaluation
- Réaction ChimiqueDocument6 pagesRéaction ChimiqueYves-donald MakoumbouPas encore d'évaluation
- Acides Carboxyliques Et Leurs DerivesDocument12 pagesAcides Carboxyliques Et Leurs DerivesSamba BarhamPas encore d'évaluation
- Mécanismes de SN2019Document14 pagesMécanismes de SN2019benjamin.arfi06Pas encore d'évaluation
- Chim Orga 2 (Suite Du Dernier Chapitre)Document24 pagesChim Orga 2 (Suite Du Dernier Chapitre)Hk Eh100% (1)
- UE1 - Chimie Organique - 24/08/2017Document64 pagesUE1 - Chimie Organique - 24/08/2017John BasicPas encore d'évaluation
- Chimie Organique Chap1 2Document69 pagesChimie Organique Chap1 2Mira MaroPas encore d'évaluation
- Mecanismes Reactionnels Cours LeconteDocument16 pagesMecanismes Reactionnels Cours LeconteNajimou Alade Tidjani100% (1)
- Corrig+® Des TRAVAUX DIRIGES de CHIMIE ORGANIQUEDocument4 pagesCorrig+® Des TRAVAUX DIRIGES de CHIMIE ORGANIQUEnajla910% (1)
- Exercices Dérivés Carbonylés Partie 1: Exercice 1: Pour DébuterDocument13 pagesExercices Dérivés Carbonylés Partie 1: Exercice 1: Pour DébuterMoncef AbbesPas encore d'évaluation
- TD #9 Suite Corrigé 2018-2019Document4 pagesTD #9 Suite Corrigé 2018-2019Ikram GrPas encore d'évaluation
- Chimie Organomet CatalyseDocument29 pagesChimie Organomet CatalyseRimaArmine100% (1)
- Universite Cheikh Anta Diop de Dakar - Faculte Des Sciences Et Techniques - Departement de ChimieDocument9 pagesUniversite Cheikh Anta Diop de Dakar - Faculte Des Sciences Et Techniques - Departement de Chimieyasmine joopPas encore d'évaluation
- Synthese Organique 1impDocument5 pagesSynthese Organique 1impHabiba LaraouiPas encore d'évaluation
- Travaux Dirigés Chimie Organique DR TallaDocument9 pagesTravaux Dirigés Chimie Organique DR TallaJordan MpeckPas encore d'évaluation
- Chap6 AlcanesDocument57 pagesChap6 AlcanesSel MaPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Nivellement Direct: 1.généralitésDocument4 pagesNivellement Direct: 1.généralitésWï ÃämPas encore d'évaluation
- C-Sharp - Appli MultiFenetresDocument14 pagesC-Sharp - Appli MultiFenetresHyacinthe KOSSIPas encore d'évaluation
- GP IntroductionDocument32 pagesGP IntroductionDjibril DIALLOPas encore d'évaluation
- DNB Exosquelette 1Document3 pagesDNB Exosquelette 102KommPas encore d'évaluation
- FSE - Cours Beta02 C PDFDocument24 pagesFSE - Cours Beta02 C PDFSoulef AmraniPas encore d'évaluation
- POS Audit & Reporting Analysis SupervisorDocument3 pagesPOS Audit & Reporting Analysis Supervisorabdelaziz.meriPas encore d'évaluation
- MaatalahDocument31 pagesMaatalahBilal TichoutPas encore d'évaluation
- Rapport Semestriel Du Suivi Des CoulagesDocument3 pagesRapport Semestriel Du Suivi Des CoulagesNkukummaPas encore d'évaluation
- Nosographie PhilosophiqueDocument354 pagesNosographie PhilosophiquerocolmarPas encore d'évaluation
- BUSINESS PLAN CAPE - B (1) - ConvertiDocument14 pagesBUSINESS PLAN CAPE - B (1) - ConvertiLouis Marcel IngoudouPas encore d'évaluation
- Mix MarketingDocument3 pagesMix Marketingmad daxPas encore d'évaluation
- C.G.1 - Partie2Document36 pagesC.G.1 - Partie2zineb bePas encore d'évaluation
- Labarere Jose p01Document16 pagesLabarere Jose p01youness.khalfaouiPas encore d'évaluation
- XMLDocument29 pagesXMLyounesrguigPas encore d'évaluation
- Devoirs Cas 4 ChineDocument3 pagesDevoirs Cas 4 ChinezouggarPas encore d'évaluation
- Fiche WOW v4Document1 pageFiche WOW v4Anthony ZedPas encore d'évaluation
- Analyse Du Bilan CoursDocument3 pagesAnalyse Du Bilan CoursigmimoPas encore d'évaluation
- Cours SVT Tle D Ecole OnlineDocument188 pagesCours SVT Tle D Ecole OnlineEnfant de Dieu KidsPas encore d'évaluation
- CYJSF Formation La Programmation JSF Java Server Faces PDFDocument2 pagesCYJSF Formation La Programmation JSF Java Server Faces PDFCertyouFormationPas encore d'évaluation
- 8 Astuces Pour Être Heureux Au TravailDocument10 pages8 Astuces Pour Être Heureux Au Travailyounessebai34Pas encore d'évaluation
- Automatique TPDocument7 pagesAutomatique TProot ccnaPas encore d'évaluation
- Comment Calculer Les Cubatures de TerrassementDocument2 pagesComment Calculer Les Cubatures de Terrassement4geniecivilPas encore d'évaluation
- Community Management 11 Outils IndispensablesDocument28 pagesCommunity Management 11 Outils IndispensablesMeriem BelgacemPas encore d'évaluation
- HP 10Document2 pagesHP 10Alban GOUNYPas encore d'évaluation
- INTLDocument104 pagesINTLLotfi Ben MalekPas encore d'évaluation
- M08. Matrice Des RisquesDocument6 pagesM08. Matrice Des Risqueslai.harakatPas encore d'évaluation
- 2017 Tiens Compensation Plan-Fr-1Document7 pages2017 Tiens Compensation Plan-Fr-1KOUNOUHEHOUAPas encore d'évaluation