Académique Documents
Professionnel Documents
Culture Documents
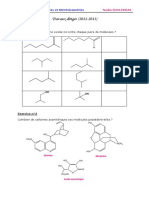
Exercices CHM144 FSS TD4
Transféré par
Omega SigmaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Exercices CHM144 FSS TD4
Transféré par
Omega SigmaDroits d'auteur :
Formats disponibles
CHM144 : CHIMIE ORGANIQUE LICENCES MEDECINE & OFFICINE
SERIE 4 : EXERCICES SUR POLARISATION ET EFFETS ELECTRONIQUES
POLARISATION
1) Prédire si chacune des molécules suivantes à un moment dipolaire: (a) BrCl, (b) BF3 (plan
trigonal), (c) CH2Cl2 (tétraédrique).
2) Le tableau des électronégativités de PAULING est le suivant
2.2
Li Be B C N O F
1.0 1.5 2.0 2.5 3.0 3.5 4.0
Na Mg Al Si P S Cl
0.9 1.2 1.5 1.8 2.1 2.5 3.0
0.8
Servez-vous du tableau pour indiquer les sens de la polarisation dans les molécules ci-
après HBr; ICl; Cl2; H2O; CO2; CCl4; CH3Cl; CH2Cl2; NF3; NH3
3) Le trifluorure d'azote NF3 a une structure presque similaire à celle de l'ammoniac NH3, toute
fois NF3 possède un moment dipolaire égal 0.24D. Expliquer pourquoi;
4) Le trifluorure de bore BF3 est-il polaire? Justifier votre réponse
5) Calculer le moment dipolaire de H2O sachant que µ = 1.5D et HÔH = 105°
6) Indiquer le sens de la polarisation des liaisons dans les molécules suivantes puis déduire si la
molécule est polaire ou non : SO ; IBr ; SCO ; F2O ; CH3Cl ; CH2Cl2 ; CHCl3
7) Dans une liaison covalence, la polarisation de cette liaison se traduit par le passage du doublet
de la liaison dans la couche externe de l’atome le plus électronégatif. Vrai ou faux ? Justifier.
8) Une liaison entre deux atomes identiques n’est pas polarisée. Vrai ou faux ?.
9) Attribuer les signes +∂ et -∂ sur les sites déficitaire ou excédentaire en densité électronique dans
les molécules suivantes. Puis préciser si la molécule est polaire ou apolaire.
A) H3C CH2 Zn CH2 CH3 B) FH C CH2F C) Cl C
2 3 CH2Cl
D) H3C CH2 BH2 E) H3C CH2 CH2 Li
Dr Oudjaniyobi SIMALOU (MC), Enseignant- Chercheur, Chimie-FDS-UL 9
CHM144 : CHIMIE ORGANIQUE LICENCES MEDECINE & OFFICINE
10) Indiquer parmi les molécules suivantes, les moments dipolaires de toutes les liaisons, en
dessinant une flèche pointant dans la direction de l’extrémité la plus électronégative de la
liaison en partant par son extrémité la moins électronégative :
CH2Cl2 ; naphtalène ; OCS ; HN3 ; (CH3)2O ; p-Fluoronitrobenzène ; COCl2 ; o-
chlorotoluène ; iodoacétylène ; pyrrole ; p-diméthoxybenzène.
12) Prédire parmi les paires de composés suivant celui qui possède le moment dipolaire le
plus élevé et justifier votre réponse.
a) NH3 et PH3 b) CCl4 et CHI3 c) CH3NO2 et (CH3)2 CHNO2
13) Le moment dipolaire d’une molécule H-X est de 0.80 D. Le caractère ionique partiel de la
liaison H-X est de 11,4%. Calculer la longueur de la liaison H-X. On donne : charge de l’électron
= 1,6 10-19 C ; 1D = 0,33 10-30 C.m
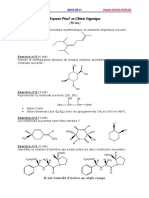
EFFETS ELECTRONIQUES
1) Ecrire les formules limites de l’aniline (C6H5NH2) et de l’ion anilium (C6H5NH3+) puis prédire
le composé le plus stable des deux molécules
2) Ecrire les formules mésomères les plus importantes affectant l’ensemble de la molécule suivante
H C C NO2
3) Classer par ordre de stabilité croissante les ions suivants. Justifier votre réponse.
CH2+
O CH2+ +
O Me
H2C O C
H Et C+
Me
4) Lequel de ces deux composés est le plus basique? Pourquoi?
N N
Pyridine
Pyrrole
5) La force d’une base peut être caractérisée soit par:
- un atome plus électronégatif
- un atome moins électronégatif
Dr Oudjaniyobi SIMALOU (MC), Enseignant- Chercheur, Chimie-FDS-UL 10
CHM144 : CHIMIE ORGANIQUE LICENCES MEDECINE & OFFICINE
- les effets donneurs
- les effets accepteurs
- les effets d’encombrement stérique
Trouver le facteur qui a permis de classer les bases suivantes
Me Me
1) C N Me O X
Me Me
Me
Me
Me H O
CH O H3CH2C O H3C O
C O
2) Me Me
Me
O O
C6H5 O H3C C O Cl3C C O
H O
3)
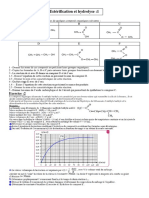
6) a) Classer les acides suivants par ordre décroissant de leur force.
O O O
H2 H2
H3C C OH Me C C C OH HO C C C OH
O O
A
O B O C
O Me O
NC H2C C OH Me S H2C C OH
Me N H2C C OH
O Me
D
E
F
b) Quel facteur prépondérant avez-vous utilisé pour ce classement?
Dr Oudjaniyobi SIMALOU (MC), Enseignant- Chercheur, Chimie-FDS-UL 11
Vous aimerez peut-être aussi
- Exercices CHM144 FSS TD6Document9 pagesExercices CHM144 FSS TD6beau AdjeiPas encore d'évaluation
- Série-3-Corrigée Chimie4Document15 pagesSérie-3-Corrigée Chimie4poly educationPas encore d'évaluation
- exo-ISI-effet électronique-réaction et mécanismeDocument5 pagesexo-ISI-effet électronique-réaction et mécanismeJoseph 27Pas encore d'évaluation
- TD Éffets Électroniques 2020Document3 pagesTD Éffets Électroniques 2020Berthe AmiPas encore d'évaluation
- Exercices Reaction ChimiqueDocument9 pagesExercices Reaction ChimiquePride Algerian ツPas encore d'évaluation
- TD L2 Suite New 2015 2016Document18 pagesTD L2 Suite New 2015 2016Najimou Alade TidjaniPas encore d'évaluation
- Chimie Organique Licence 1 Année 2004-2005: Effet Inductif, Effet MésomèreDocument2 pagesChimie Organique Licence 1 Année 2004-2005: Effet Inductif, Effet MésomèreGomez Bakoua PegaPas encore d'évaluation
- Exercices Reaction ChimiqueDocument8 pagesExercices Reaction ChimiqueJean-François Abena100% (1)
- TD CHM13220 Physicien PDFDocument6 pagesTD CHM13220 Physicien PDFArsène KekpenaPas encore d'évaluation
- TD Ch2Document13 pagesTD Ch2youray716Pas encore d'évaluation
- UCC Exercices de Chimie OrganiqueDocument3 pagesUCC Exercices de Chimie OrganiqueHogla KamwashPas encore d'évaluation
- Série 1Document2 pagesSérie 1samiraPas encore d'évaluation
- Série TD N3-S3-20-21Document2 pagesSérie TD N3-S3-20-21فيصل البلخلفيPas encore d'évaluation
- Car Bony Les Alpha-Beta InsaturesDocument7 pagesCar Bony Les Alpha-Beta InsaturesJean-François Abena100% (2)
- 1 Éxamen de Chimie Organique-SMP-s3.Ratt-2017Document6 pages1 Éxamen de Chimie Organique-SMP-s3.Ratt-2017Ghizlane KarimPas encore d'évaluation
- Serie de TD ChimieDocument5 pagesSerie de TD Chimieraouf teach 04Pas encore d'évaluation
- Chimie organique2TD 1Document2 pagesChimie organique2TD 1bouthain.guessab07Pas encore d'évaluation
- Exam Biomol A Automne 2020Document4 pagesExam Biomol A Automne 2020ashPas encore d'évaluation
- UntitledDocument3 pagesUntitledAbdeldjalil MayachePas encore d'évaluation
- Série 2 Chimie OrganiqueDocument2 pagesSérie 2 Chimie Organiquetahayaha81Pas encore d'évaluation
- Chimie Organique TD Corr 01 1 - CompressedDocument3 pagesChimie Organique TD Corr 01 1 - CompressedMoustapha Mbow100% (1)
- Session 2 2016Document6 pagesSession 2 2016Abdelhak Wiń'şPas encore d'évaluation
- Planche TD 2009Document8 pagesPlanche TD 2009Natacha N'GUESSANPas encore d'évaluation
- Série 2 Isomérie 2020-2021Document3 pagesSérie 2 Isomérie 2020-2021Ayoub HmPas encore d'évaluation
- 2020 2021 S3 y (Session Rattr Version Déf)Document2 pages2020 2021 S3 y (Session Rattr Version Déf)nablacity05Pas encore d'évaluation
- TD Stereochimie Corrige 3Document3 pagesTD Stereochimie Corrige 3Audrey Fulda Aukte100% (1)
- TD Stereochimie Corrige 3Document3 pagesTD Stereochimie Corrige 3taha ainouchPas encore d'évaluation
- TD-CHORG-SVTTU-S2-2018-2019-version-site-web-universitéDocument28 pagesTD-CHORG-SVTTU-S2-2018-2019-version-site-web-universitésamsam100098Pas encore d'évaluation
- TD N 6 CH Orga Générale M. SAFI-convertiDocument2 pagesTD N 6 CH Orga Générale M. SAFI-convertiAya FarahPas encore d'évaluation
- Exam IIDocument3 pagesExam IIBaya HalitimPas encore d'évaluation
- TD Effets Electroniques 8Document3 pagesTD Effets Electroniques 8HenAbdoPas encore d'évaluation
- SERIE 4 CorrigéDocument8 pagesSERIE 4 CorrigéMouflehPas encore d'évaluation
- Epreuve Juin smc6 14 15Document2 pagesEpreuve Juin smc6 14 15santaPas encore d'évaluation
- Epreuve Juin smc6 14 15Document2 pagesEpreuve Juin smc6 14 15cvbn100% (1)
- Organique 13-14 SolutionDocument2 pagesOrganique 13-14 Solutiondrisszekraoui14Pas encore d'évaluation
- CH Org TD 10 PDFDocument11 pagesCH Org TD 10 PDFMohammed MaalalPas encore d'évaluation
- Session 1 2016Document7 pagesSession 1 2016Yc YacinePas encore d'évaluation
- TD Séries N°1 Et 2Document3 pagesTD Séries N°1 Et 2Rim AbouttiPas encore d'évaluation
- TD Stereochimie 5Document5 pagesTD Stereochimie 5Jean TellPas encore d'évaluation
- Cours Chimie Organique FSF 2007-2008Document52 pagesCours Chimie Organique FSF 2007-2008Mahfoud ZakiPas encore d'évaluation
- Wa0025Document1 pageWa0025MariettePas encore d'évaluation
- Examen Finaux Et Corrigé - 230516 - 232706Document37 pagesExamen Finaux Et Corrigé - 230516 - 232706bensalimyoussef94Pas encore d'évaluation
- Top Exos ChimieDocument54 pagesTop Exos ChimieAlban tienouPas encore d'évaluation
- smc5 Session 1 2020Document7 pagessmc5 Session 1 2020adnanPas encore d'évaluation
- Exercices de Chimie OrganiqueDocument7 pagesExercices de Chimie OrganiqueAy ManPas encore d'évaluation
- 2019-2020-S3-y (Session Norm - Version Déf)Document2 pages2019-2020-S3-y (Session Norm - Version Déf)nablacity05Pas encore d'évaluation
- Cours de Chimie Organique S1 Master MEPCDocument52 pagesCours de Chimie Organique S1 Master MEPCOumayma El YamaniPas encore d'évaluation
- Exercice I: Chimie I: Structure de La Matière Série N°4 TDDocument2 pagesExercice I: Chimie I: Structure de La Matière Série N°4 TDnouhad.chan23Pas encore d'évaluation
- ds5 CorrigeDocument16 pagesds5 Corrigeakissiyapi555Pas encore d'évaluation
- Serie N°02 Chimie OrganiqueDocument4 pagesSerie N°02 Chimie Organiqueyacine habbiPas encore d'évaluation
- Liaison ChimDocument26 pagesLiaison ChimEL MOSTAFA EL MAZOUZYPas encore d'évaluation
- Chim303atd00 02Document2 pagesChim303atd00 02Kader MilanoPas encore d'évaluation
- CAHIER D'Exercices ChimieDocument67 pagesCAHIER D'Exercices ChimieAdama MaigaPas encore d'évaluation
- Exam I 2Document1 pageExam I 2Anonymous sdeGjzXETG100% (2)
- Série No 6 L2PCSM 2022Document2 pagesSérie No 6 L2PCSM 2022NgagneseckPas encore d'évaluation
- Estérification SerieDocument1 pageEstérification SerieNouhaila ChairPas encore d'évaluation
- Exercices Corrigés NomenclatureDocument4 pagesExercices Corrigés NomenclatureMalek abidi100% (5)
- Introduction à la physique de la matièreD'EverandIntroduction à la physique de la matièreÉvaluation : 3 sur 5 étoiles3/5 (1)
- Exercices Semaine7Document2 pagesExercices Semaine7Omega SigmaPas encore d'évaluation
- Chimie OrganiqueDocument15 pagesChimie OrganiqueOmega SigmaPas encore d'évaluation
- Exercices CHM144 FSS TD5Document9 pagesExercices CHM144 FSS TD5Omega SigmaPas encore d'évaluation
- Kirchhoff3 CorrDocument5 pagesKirchhoff3 CorrTheodore JimenezPas encore d'évaluation
- TransiDocument5 pagesTransinouredine akliPas encore d'évaluation
- 16 Les AC MarquésDocument70 pages16 Les AC MarquésDr BENOUADFELPas encore d'évaluation
- DM Nâ°1Document8 pagesDM Nâ°1grégoire beraudPas encore d'évaluation
- TD Transferts de Chaleur Et de Matière FPN Master Chimie Des Matériaux S2 PDFDocument35 pagesTD Transferts de Chaleur Et de Matière FPN Master Chimie Des Matériaux S2 PDFAbir AbkariPas encore d'évaluation
- Dossier Energies RenouvelablesDocument5 pagesDossier Energies RenouvelablesskitocPas encore d'évaluation
- PrincipéchangeurDocument5 pagesPrincipéchangeurAyoub Magroud100% (1)
- HH MergedDocument12 pagesHH Mergedbenaoua nourPas encore d'évaluation
- DS-051004 EnonceDocument6 pagesDS-051004 EnonceIhsan MokhlissePas encore d'évaluation
- Chrome PresentationDocument5 pagesChrome PresentationNesrinePas encore d'évaluation
- 3.1-Série de TD BDocument2 pages3.1-Série de TD Byugensh2Pas encore d'évaluation
- Bougies de Prechauffage: NGK France MFBP0905Document71 pagesBougies de Prechauffage: NGK France MFBP0905OS DiagnosticAutoPas encore d'évaluation
- Ex RCDocument4 pagesEx RCPc KawtarPas encore d'évaluation
- Classification Périodique PDFDocument2 pagesClassification Périodique PDFRaja BenabPas encore d'évaluation
- TD Transformateurs Électriques LVDocument5 pagesTD Transformateurs Électriques LVIhssane IdrissiPas encore d'évaluation
- Activité 2 Maille de Chlorure de Sodium CorrigéDocument3 pagesActivité 2 Maille de Chlorure de Sodium Corrigéschepes0% (1)
- Cours de Geologie Petroliere OriDocument13 pagesCours de Geologie Petroliere OriSamba Koukouare ProsperPas encore d'évaluation
- Chap1 VetdDocument3 pagesChap1 VetdDialloPas encore d'évaluation
- TD1 Diagrammes Déquilibres Des Alliagess-1Document4 pagesTD1 Diagrammes Déquilibres Des Alliagess-1jihed korbiPas encore d'évaluation
- Cours Cycles Biogéochimique M2 BiodiversitéDocument10 pagesCours Cycles Biogéochimique M2 BiodiversitéFATIMA-ZAHRA JAPas encore d'évaluation
- Livre Seconde 2019Document86 pagesLivre Seconde 2019www.guipelbejeanPas encore d'évaluation
- Corrigé 06Document2 pagesCorrigé 06lmd200975% (4)
- Rapport Geotechnique CompletDocument65 pagesRapport Geotechnique CompletGORGUI SOWPas encore d'évaluation
- 3D3 JNM2003Document5 pages3D3 JNM2003NigerPas encore d'évaluation
- THERMODYNAMIQUEDocument15 pagesTHERMODYNAMIQUESAIDPas encore d'évaluation
- Fiche05 Finition ZINTEKDocument1 pageFiche05 Finition ZINTEKValtessPas encore d'évaluation
- Interrogation 01 Avec Corrigé - Physique 02 - 2020-2021Document5 pagesInterrogation 01 Avec Corrigé - Physique 02 - 2020-2021Ayoub FekharPas encore d'évaluation
- Sommaire: Le Soudage Au Gaz (Au Chalumeau)Document27 pagesSommaire: Le Soudage Au Gaz (Au Chalumeau)Menad Salah100% (1)
- Fiche Technique de Sécurité 93/112/CEE M 220: 883816.0, 883816.00010, 9.3027.0 Oel - D.DotDocument6 pagesFiche Technique de Sécurité 93/112/CEE M 220: 883816.0, 883816.00010, 9.3027.0 Oel - D.DotSMM ENTREPRISEPas encore d'évaluation
- Chapitre 1 Objectifs de La MaintenanceDocument40 pagesChapitre 1 Objectifs de La MaintenanceAhmed ELBOUZIDIPas encore d'évaluation
- Ondes Electromagnetiques Dans Le Vide CoursDocument7 pagesOndes Electromagnetiques Dans Le Vide Coursbadr pedroPas encore d'évaluation