Académique Documents
Professionnel Documents
Culture Documents
Acide Base
Transféré par
PhilzyTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Acide Base
Transféré par
PhilzyDroits d'auteur :
Formats disponibles
Partie III : Chimie (Ch.
1 et 8)
Ch. 7 : Transformations Acide-Base 1. Définition du pH
2. Théorie de Brönsted-Lowry
3. Constante d’acidité
4. Quelques propriétés des acides faibles.
1. pH d’une solution aqueuse potentiel Hydrogène
pH
1.1. Autoprotolyse de l’eau 14
Une solution aqueuse est une solution dont le solvant majoritaire est l’eau H2O Milieu basique [H3O +]
(exemples : jus de fruit, lait, sang, vin,…). Dans toutes ces solutions aqueuses existent ou alcalin
+ –
obligatoirement deux ions dont la présence est liée à celle de la molécule d’eau : [H3O ] < [HO ]
+
• les ions oxonium H3O (anciennement nommés hydronium)
-
• les ions hydroxyde HO Milieu neutre
+ – 7
Chercher à supprimer l’un de ces deux ions d’une solution aqueuse conduira [H3O ] = [HO ]
inévitablement l’eau à reformer un nouvel équilibre selon l’équation bilan :
+ –
2 H2O(L) H3O (aq) + HO (aq) c’est la réaction d’autoprotolyse de l’eau. Milieu acide
+ –
[H3O ] > [HO ]
La constante d’équilibre de cette réaction notée KE vaut à 25°C : KE (25°C) = 1,0⋅10
-14
. [HO –]
avec K =
[H O ] ⋅ [HO ]
3
+
éq
−
éq
KE =
[H O ] ⋅ [HO ]
3
+
éq
−
éq 0
E
[H 2O]éq 2
(C ) 0 2
A retenir :
Dans toute solution aqueuse, les ions hydroxyde et oxonium obéissent à un état
d’équilibre définit par la constante de réaction d’autoprotolyse de l’eau KE tel que : [
K E = H 3O + ] × [HO ]
éq
−
éq = 1,0 ⋅10 −14
1.2. Définition du pH
pH-mètre
La valeur du pH d’une solution aqueuse est directement [
H O+
pH = − log 3 0
]
liée à la concentration des ions oxonium : Sonde
0
Avec C la concentration standard égale à 1,0 mol/L. C
pHmétrique
Le pH est une grandeur adimensionnelle. Papier pH Sonde de
La mesure du pH d’une solution aqueuse peut se faire de
manière approximative (± 1) avec le papier pH et de [H O ] = C
3
+ 0
× 10 − pH température
manière plus précise (± 0,1) avec un pH-mètre.
Exercice 1 :
+
1. Déterminer l’expression donnant la concentration des ions hydroxyde en fonction de [H3O ] dans une solution de pH connu.
2. Calculer la concentration des ions oxonium à pH = 7,0.
3. En déduire celle des ions hydroxyde à pH = 7,0.
4. Quelle est, en théorie, la concentration des ions oxonium à pH = 0 ?
5. Même question pour les ions hydroxyde.
6. Déterminer la concentration en ions hydroxyde et en ions oxonium pour une solution aqueuse de pH = 4,2.
7. Sachant qu’une concentration devient négligeable devant une autre si elle est au moins 1000 fois inférieure, que peut-on en déduire
pour cette solution de pH = 4,2 ?
2. Théorie de Brönsted-Lowry
2.1. Définitions
A retenir :
+
• Une espèce dite acide dans la théorie de Brönsted est une espèce moléculaire ou ionique capable de céder un proton H .
+
• Une espèce dite basique dans la théorie de Brönsted est une espèce moléculaire ou ionique capable de capter un proton H .
Exemples :
+ -
- L’acide éthanoïque CH3COOH est capable de donner un proton H pour devenir une base nommée ion éthanoate de formule CH3COO
- +
- L’ion éthanoate est une base car il est capable de capter un proton selon la demi-équation : CH3COO + H = CH3COOH
+ + +
- L’ion ammonium NH4 est un acide car capable de donner un proton selon la demi-équation : NH4 = NH3 + H
- +
- L’eau H2O est un acide car elle peut réagir en donnant un proton selon la demi-équation : H2O = HO + H
+ +
- L’eau H2O est aussi une base car elle peut réagir en captant un proton selon la demi-équation : H2O + H = H3O
1 / 4 - TERMINALE SPECIALITÉ Partie III - Chapitre 7
A noter :
+ +
• Certaines espèces chimiques peuvent, selon le contexte, jouer le rôle d’un NH3 + H = NH4 NH3 se comporte comme une base
acide ou celui d’une base. On parle alors d’espèce amphotère ou - +
NH3 = NH2 + H NH3 se comporte comme une acide
ampholyte.
• Toutes les espèces chimiques possédant de l’hydrogène ne peuvent pas forcément libérer un proton. Groupement
+ H
Les protons H pouvant facilement se détacher d’un acide sont appelés protons labiles. La plupart des O carboxyle
atomes d’hydrogène dans une molécule ne sont pas labiles. H
H O H
C
Exercice 2 : C
C
1. Dans la liste d’entités suivantes, encercler en vert celles qui peuvent jouer le rôle d’un acide, en bleu H
H O
celle qui peuvent jouer le rôle d’une base et en rouge celles qui sont amphotères.
2- - - + - 2- - -
S ; HCOOH ; CH3COO ; HCl ; HO ; H3O ; HCO3 ; SO4 ; H2O ; NO3 ; C6H5-COOH ; OOC-CH2OH
Acide lactique
–
2. Sachant que l’ion hydrogénosulfate HSO4 est une espèce amphotère, écrire les deux demi- Dans cette molécule seul
équations traduisant son côté acide et son côté basique. l’hydrogène de la fonction
carboxyle est labile
A retenir :
– + – –
Un couple acido-basique noté AH / A est constitué d’un acide AH AH = H + A Notation du couple : AH / A
–
et d’une base A liés par l’équation de l’équilibre de Brönsted :
L’acide AH et sa base A– sont dits « conjugués »
2.2. Réaction acido-basique
Une réaction acido-basique se produit lorsque l’acide d’un couple cède un proton à la base d’un autre couple. Une réaction acido-basique fait
donc toujours intervenir deux couples, à l’instar d’une réaction d’oxydo-réduction.
Exemple :
+ –
On mélange de l’acide éthanoïque CH3 – COOH avec de la soude Na + HO (hydroxyde de sodium). Les deux couples engagés dans
+ – cette réaction sont :
L’acide cède un proton à l’ion hydroxyde : CH3 – COOH = H + CH3 – COO
–
L’ion hydroxyde capte alors ce proton : + HO
–
+ H
+
= H2O CH3 – COOH / CH3 – COO
–
H2O / HO
→ CH3 – COO + H2O
– –
L’équation bilan de cette réaction est donc : CH3 – COOH + HO
Exercice 3 :
Avec la hausse des émissions du dioxyde de carbone par le monde industriel, l’eau des océans s’acidifie lentement avec la formation
d’acide carbonique de formule H2CO3 (aq) selon l’équation bilan : CO2 (g) + H2O (L) H2CO3 (aq)
1. Ecrire la demi-équation qui montre le caractère acide de l’espèce H2CO3 (aq).
2. La coquille des mollusques marins est constituée d'un assemblage intime et complexe de carbonate de calcium (CaCO3 appelé
calcaire lorsqu'il s'agit d'une roche) et de matière organique. L’augmentation de l’acide carbonique dans les océans fragilise entre
2-
autre cette coquille en réagissant avec l’ion carbonate CO3 qu’elle contient. Ecrire l’équation bilan de cette réaction acido-basique.
3. Préciser les deux couples mis en jeu et conclure sur la nature précise de l’ion hydrogénocarbonate produit par cette réaction.
3. Constante d’acidité
3.1. Définition
La constante d’acidité KA d’un acide quelconque noté AH est la constante de - +
réaction de cet acide lorsqu’il réagit avec l’eau, le corps pris comme référence AH + H2O A + H3O
pour tous les acides. L’expression de cette constante d’acidité s’écrit donc :
[ A− ]éq × [ H 3O + ]éq
A chaque KA on associe une grandeur logarithmique KA = car [H2O] = C = 1,0 mol/L
0
et sans dimension, notée pKA, telle que : pK A = − log K A [ AH ]éq × C 0
Exercice 4 :
1. Ecrire l’équation bilan de la réaction chimique permettant d’établir l’expression de la constante d’acidité KA de l’acide méthanoïque.
2. Etablir l’expression de cette constante en fonction des concentrations des espèces présentes.
3. Sachant que le pKA de l’acide méthanoïque à 25°C est égal à 3,7 déterminer la valeur de son KA.
4.1. Sachant que l’eau est une espèce amphotère et qu’elle peut donc aussi jouer le rôle d’un acide, écrire l’équation bilan de la
réaction de cet acide sur l’eau.
4.2 . En déduire l’expression de la constante d’acidité de l’eau. Que remarque-t-on ?
4.3. Quelle est alors la valeur de cette constante d’acidité à 25°C ? Comment la note-t-on habituellement ? Que vaut le pKA ?
A retenir :
-14
La constante d’acidité KA de l’eau est la constante d’équilibre de sa réaction sur l’eau. On la note aussi KE de valeur 1,0⋅10 à 25°C.
On a alors : pKE = -log (KE) = 14,0 à 25°C.
2 / 4 - TERMINALE SPECIALITÉ Partie III - Chapitre 7
3.2. Détermination d’une constante d’acidité
Exercice 5 :
-2
On prépare une solution d’acide méthanoïque de concentration en soluté apporté égale à C1 = 1,0⋅10 mol/L et de volume V1 = 0,20 L.
La solution, une fois stabilisée, a un pH de 2,9 à 25°C.
1. Compléter le tableau d’avancement ci-contre avec uniquement des expressions littérales (aucune valeur).
Etat du système Avancement HCOOH + H2O HCOO - + H3O+
initial x= 0 n1 = C1 × V1 Excès 0 0
intermédiaire x n1 - x Excès
final xéq Excès
2. Déterminer l’expression littérale de la concentration finale (ou à l’équilibre) des ions oxonium en fonction de V1 et xéq.
* 3. Faire de même avec la concentration finale des ions méthanoate et celle de l’acide méthanoïque.
4. Montrer que l’on peut écrire : [HCOOH]éq = C1 - [H3O+]éq.
5. Déterminer l’expression littérale de la constante d’acidité de l’acide méthanoïque uniquement en fonction de C1 et [H3O+]éq.
6. Calculer la valeur de KA et en déduire celle de son pKA.
7. Déterminer la valeur de l’avancement final xf = xéq et en déduire la valeur du tau d’avancement de cette réaction.
8. Quelle est la quantité finale d’acide méthanoïque restant en solution une fois cette dernière stabilisée ?
3.3. Force d’un acide
D’une manière générale, on distingue deux types d’acide :
• Les acides FORTS, qui réagissent complètement avec l’eau • Les acides FAIBLES, qui réagissent partiellement avec l’eau
en se dissociant totalement et pour lesquels τ = 1,0. en ne se dissociant pas totalement et pour lesquels τ < 1,0.
Exemple : Exemple :
Le chlorure d’hydrogène HCl(g) est un acide fort. L’acide méthanoïque HCOOH vu précédemment et pour lequel :
Sa réaction sur l’eau est donc totale :
xéq < xmax
-
H2O(L) →
+
HCl(g) + Cl (aq) + H3O (aq) xéq / xmax < 1,0
x=0 n1 excès 0 0
τ < 1,0
x n1 - x excès x x
xéq = xmax n1 - xéq = 0 excès xéq = n1 xéq = n1 + +
• Calcul du pKA de l’acide H3O du couple H3O / H2O :
Comme tout l’acide réagit avec l’eau, on a à l’état final : Réaction de cet acide sur l’eau : H3O + H2O
+
H2O + H3O
+
n1 - xéq = 0 n1 = xéq = xmax
[ H 3O + ]éq × C 0
KA = =1 pK A = − log(1) = 0
Ainsi donc τ = xéq / xmax = 1,0 [ H 3O + ]éq × C 0
-
Exemples d’acides forts souvent utilisés en chimie de synthèse : • Calcul du pKA de l’acide H2O du couple H2O / HO :
- +
nom Formule pKA En solution aqueuse Réaction de cet acide sur l’eau : H2O + H2O HO + H3O
Acide chlorhydrique HCl(g) - 4,0 H3O
+
(aq) + Cl
-
(aq)
K A = K E = 1,0 ⋅ 10 −14 pK A = pK E = 14
+ -
Acide sulfurique H2SO4(L) - 3,0 H3O (aq) + HSO4 (aq)
–
Acide nitrique HNO3(L) - 1,37 +
H3O (aq) + NO3
- HCl / Cl
(aq)
ACIDE – BASE
FORT HNO3 / NO3 INERTE
+
L’acide le plus fort qui existe dissout dans l’eau est l’ion oxonium H3O 0
10 = 1 +
H3O / H2O 0
Un acide plus fort (pKA < 0) se dissociera complètement dans l’eau et
il ne restera donc que sa base conjuguée et des ions oxonium. Peu faible –
Très faible
HCOOH / HCOO
Exercice 6 : ACIDE – BASE
CH3COOH / CH3COO
1. Quelle condition doit vérifier le pKA d’un acide pour être qualifié FAIBLE FAIBLE
d’acide fort ? +
NH4 / NH3
2. Quel est, de l’acide méthanoïque ou de l’acide acétique celui qui Très faible Peu faible
est le plus fort ? – 14 –
3.1. Si l’on mélange de l’éthanol C2H5OH avec de l’eau, observe-t- 10 H2O / HO 14
on une réaction ? Pourquoi ? ACIDE BASE
–
3.2. Mêmes questions pour sa base conjuguée, l’ion éthanolate. INERTE C2H5OH / C2H5O FORTE
4. Quel type de base est conjugué à un acide faible ?
5. Quel type d’acide est conjugué à une base forte ?
KA pKA
3 / 4 - TERMINALE SPECIALITÉ Partie III - Chapitre 7
4. Quelques propriétés des acides faibles
4.1. Diagramme de distribution
Exercice 7 :
[ A− ]éq × [ H 3O + ]éq
Si l’on considère la réaction d’un acide faible AH sur l’eau, on a donc : K A = et pK A = − log K A
[ AH ]éq × C 0
pH = pK AA + log
[ ]
−−
[ AA ]éqéq
1. Montrer que l’on peut alors écrire que : pH
[ [AH
AH]]éqéq
-
2. Quelle relation a-t-on entre [A ]éq et [AH] éq si le pH de la solution est égal au pKA de l’acide ?
-
3. Quelle inégalité existe-t-il entre le pH et le pKA si [A ] éq > [AH] éq ?
-
4. Même question si [A ] éq < [AH] éq ?
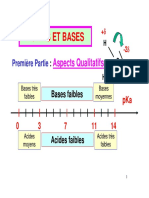
5. On considère une solution aqueuse d’acide éthanoïque de pKA = 4,8. Indiquer sur le schéma ci-dessous appelé diagramme de
distribution ou domaine de prédominance qui, de la forme acide ou de la forme basique, prédomine en solution en fonction du pH.
pH
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
A retenir :
R O R O
Un acide α-aminé est une molécule possédant sur un même atome de carbone une eau
fonction acide carboxylique - COOH et une fonction amine - NH2.
CH C CH C
En fonction du pH de la solution, l’acide α-aminé peut exister sous différentes formes :
-
- - H2N OH H 3N + O
R HC COOH R HC COO R CH COO (S) (Aq)
+
pKA1 +
pKA2 Un acide α-aminé sous forme solide est une molécule.
NH 3 NH 3 NH 2 pH Au contact de l’eau, la molécule s’autoprotolyse et
devient un amphion (ou zwitterion).
Cation Zwitterion ou amphion Anion
L’amphion est une espèce amphotère
4.2. Indicateur coloré
Un indicateur coloré est un couple acido-basique dont la forme acide AH a une
% Bleu de bromothymol
- 100
couleur différente de la forme basique A en solution aqueuse.
Pour cette raison, on note généralement un tel couple : IndH / Ind
-
IndH Ind -
Exemple :
En solution aqueuse, le bleu de bromothymol (ou BBT) a une forme acide IndH de
-
couleur jaune et une forme basique Ind de couleur bleue. 50
Le pKA de ce couple est voisin de 6,8.
Zone de
A pH = 4,0 par exemple, on peut voir graphiquement que le couple du BBT est à virage
plus de 99 % représenté par l’espèce IndH jaune. La couleur de la solution sera
-
donc jaune vu que l’espèce Ind de couleur bleue est très négligeable. 0
-
A l’inverse, pour un pH de 10, c’est l’espèce Ind de couleur bleue qui est ultra- 0 2 4 6 8 10 pH
majoritaire. La solution sera donc bleue. pKA
Enfin, lorsque le pH de la solution est voisin du pKA du couple du BBT, les deux Autres exemples :
–
espèces IndH et Ind ont des concentrations voisines, et leurs couleurs 3,7 Hélianthine
s’additionnent : c’est la zone de virage de l’indicateur coloré.
Phénolphtaléine 9,1
4.3. Solution tampon
–
La présence simultanée de l’espèce AH et de l’espèce A en solution aqueuse empêche le pH de varier sensiblement lors d’un ajout modéré
d’acide fort ou de base forte, ou encore lors d’une dilution. C'est pour cette raison qu'une telle solution est qualifiée de solution tampon.
En d’autres termes, si le pH d’une solution est tel que l’espèce AH et l’espèce A ont
– Zone tampon
%
des concentrations non négligeables l’une par rapport à l’autre (et donc des
concentrations voisines), on a une solution tampon. 100
–
AH A
C’est à l’aide de plusieurs couples de solutions tampons que le sang du corps humain
peut maintenir un pH stable toujours compris entre 7,38 et 7,42 malgré la formation de
certains acides par le métabolisme comme l’acide lactique lors d’efforts musculaires.
Exemple : 50
–
On considère un couple AH / A dont le pKA vaut 5,0. Si le pH de la solution aqueuse
contenant ces espèces est compris entre 4,0 (pKA – 1) et 6,0 (pKA + 1), alors la solution
est tampon.
Si le pH de la solution est supérieur à 6,0 ou inférieur à 4,0, une des deux espèces est pH
devenue négligeable par rapport à l’autre et la solution n’a plus sont pouvoir tampon. 0
Ainsi, en cas d’ajout modéré d’un acide ou d’une base, son pH variera notablement. 0 2 4 6 8 10
4 / 4 - TERMINALE SPECIALITÉ Partie III - Chapitre 7
Vous aimerez peut-être aussi
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Chimie Solutions Aqueuses MPSI Et ApplicationsDocument20 pagesChimie Solutions Aqueuses MPSI Et ApplicationsmissmaymounaPas encore d'évaluation
- PH MetrieDocument14 pagesPH MetrieMeriem KeddadPas encore d'évaluation
- I. PH D Une Solution AqueuseDocument5 pagesI. PH D Une Solution AqueuseJean-Loïc BauchetPas encore d'évaluation
- Les Solutions Aqueuses IoniquesDocument18 pagesLes Solutions Aqueuses IoniquesMétatron GamesPas encore d'évaluation
- 6-Les Équilibres Acido-BasiquesDocument50 pages6-Les Équilibres Acido-BasiqueslilybarachantPas encore d'évaluation
- Chapitre IV 1Document37 pagesChapitre IV 1sidiPas encore d'évaluation
- Fascicule 2007-2008-2eme Partie Chi PhysikDocument96 pagesFascicule 2007-2008-2eme Partie Chi PhysikHenri Elias HabibPas encore d'évaluation
- Acide BaseDocument4 pagesAcide BaseRafika SalmiPas encore d'évaluation
- Acide BaseDocument35 pagesAcide BaseKhoudia Sy CamaraPas encore d'évaluation
- Chimie Générale 9 - Equilibres Chimiques Et Réactions Acido-Basiques (Part 1)Document41 pagesChimie Générale 9 - Equilibres Chimiques Et Réactions Acido-Basiques (Part 1)AliEle2013Pas encore d'évaluation
- Bioelectronique - Vincent U. Schreier PDFDocument5 pagesBioelectronique - Vincent U. Schreier PDFjoel_tetard100% (1)
- Chapitre 1-3Document18 pagesChapitre 1-3Hassna OuifkiPas encore d'évaluation
- Tle Cours C1Document3 pagesTle Cours C1Thouria ELPas encore d'évaluation
- Chapitre 2 - PH Des Solutions AqueusesDocument11 pagesChapitre 2 - PH Des Solutions AqueusesBeatrice Florin100% (1)
- Chap I-3 CSDocument11 pagesChap I-3 CSSimo MaroPas encore d'évaluation
- Chapitre I Partie 1Document8 pagesChapitre I Partie 1Amna TahriPas encore d'évaluation
- 2eme Partie Du Cours Chimie en Solution 2023 ''ENSA''Document32 pages2eme Partie Du Cours Chimie en Solution 2023 ''ENSA''Malak elPas encore d'évaluation
- Reactions Acide-BaseDocument8 pagesReactions Acide-BaseMahmoud GazzahPas encore d'évaluation
- Acide BaseDocument14 pagesAcide Baseالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Methodes de Calcul de PH Des Solutions AqueusesDocument6 pagesMethodes de Calcul de PH Des Solutions AqueusesabalotouadjeiPas encore d'évaluation
- PH2SCH06Document3 pagesPH2SCH06chadaPas encore d'évaluation
- Capture D'écran . 2022-01-29 À 23.52.15 PDFDocument11 pagesCapture D'écran . 2022-01-29 À 23.52.15 PDFAymen NamanePas encore d'évaluation
- Cours 14 L'eau Et Les Solutions AqueusesDocument3 pagesCours 14 L'eau Et Les Solutions AqueusesArti100% (1)
- Chapitre 5B Complété Force Des Acides Et Des BasesDocument5 pagesChapitre 5B Complété Force Des Acides Et Des Basesairfann67Pas encore d'évaluation
- # 02 Cours Chap 1 Réactions Acide-Base ProfDocument2 pages# 02 Cours Chap 1 Réactions Acide-Base ProfLouisPas encore d'évaluation
- Chapitre 2 Acide BaseDocument17 pagesChapitre 2 Acide BaseSouFien MabroukPas encore d'évaluation
- Cours de Chimie en Solution Les Acides Et Les Bases: 1 Année Biologie 2019-2020Document37 pagesCours de Chimie en Solution Les Acides Et Les Bases: 1 Année Biologie 2019-2020kheddirachidPas encore d'évaluation
- Chapitre - 1 Les Acides Et Les BasesDocument14 pagesChapitre - 1 Les Acides Et Les Baseseduardo3000Pas encore d'évaluation
- Analyse Equilibres Reactions Acide Base PrecipitationDocument50 pagesAnalyse Equilibres Reactions Acide Base PrecipitationCyril GaillardPas encore d'évaluation
- COURS PH DES SOLUTIONS AQUEUSES HADJ ALI BOUZIDDocument6 pagesCOURS PH DES SOLUTIONS AQUEUSES HADJ ALI BOUZIDMohamed Helmi Chebbi100% (5)
- Chimie en SolutionDocument166 pagesChimie en Solutionjawad izallalenPas encore d'évaluation
- Chap I Acide BaseDocument81 pagesChap I Acide BaseyoussefPas encore d'évaluation
- Chapitre IV, L1PCSM FSTDocument21 pagesChapitre IV, L1PCSM FSTbandiaye2002Pas encore d'évaluation
- Chapitre Iv Les Acides Et Les Bases FinalDocument15 pagesChapitre Iv Les Acides Et Les Bases FinalEl HadiPas encore d'évaluation
- Equilibre Acide Base Fiche CoursDocument2 pagesEquilibre Acide Base Fiche CoursArchange StevithPas encore d'évaluation
- C9 ForceDesAcidesEtBasesEleveDocument13 pagesC9 ForceDesAcidesEtBasesEleveYann FourteauPas encore d'évaluation
- 5-Transformations Acide-Base Solution AqueuseDocument4 pages5-Transformations Acide-Base Solution AqueusesdoulajPas encore d'évaluation
- Chapitre 5 PH Des Solutions AqueusesDocument16 pagesChapitre 5 PH Des Solutions AqueusesSyryne DridiPas encore d'évaluation
- 27Tlf-SMP2 Cours Chimie en Solution Chapitres 2 Et 3 PR OUACHTAKDocument46 pages27Tlf-SMP2 Cours Chimie en Solution Chapitres 2 Et 3 PR OUACHTAKHhhhppp MikPas encore d'évaluation
- Micro MDocument28 pagesMicro Ml3bsectionbPas encore d'évaluation
- Reactions Acide BaseDocument14 pagesReactions Acide BaseDjonba PaguerePas encore d'évaluation
- Villa Alessandro p02Document58 pagesVilla Alessandro p02bougetPas encore d'évaluation
- Resume Acides Et Bases PDFDocument2 pagesResume Acides Et Bases PDFAnonymous nbHyrU81Pas encore d'évaluation
- Equilibres Acido-BasiquesDocument43 pagesEquilibres Acido-Basiquesattentatalabombe100% (5)
- Rappels Chimie Des SolutionsDocument24 pagesRappels Chimie Des SolutionsDavid KientegaPas encore d'évaluation
- Chimie en SolutionDocument54 pagesChimie en SolutionFRANCK ARMAND JOSIAS BONKOUNGOU WENDBENEDOPas encore d'évaluation
- Chsol - Chapitre IiDocument28 pagesChsol - Chapitre IielkhiatmohammedaminePas encore d'évaluation
- Chap I Equilibres AcidobasiquesDocument28 pagesChap I Equilibres Acidobasiqueselguerchsara68Pas encore d'évaluation
- Les Acides Et Les BasesDocument59 pagesLes Acides Et Les BasesCarter JeanPas encore d'évaluation
- Chap1 Acide BaseDocument43 pagesChap1 Acide BaseBtn Princii IsraëlPas encore d'évaluation
- Chap I-2 CSDocument18 pagesChap I-2 CSSimo MaroPas encore d'évaluation
- Chap 2 Les Acides Et Les BasesDocument4 pagesChap 2 Les Acides Et Les BasessaliPas encore d'évaluation
- Equilibres Acidobasiques1Document49 pagesEquilibres Acidobasiques1lahcen essPas encore d'évaluation
- Calcul Du PH Des Solutions AqueusesDocument5 pagesCalcul Du PH Des Solutions AqueusesHassen JinyorPas encore d'évaluation
- Les Reactions AcidoDocument18 pagesLes Reactions AcidoMamadou DiagnePas encore d'évaluation
- Equilibre de Dissociation Dans Les Solutions Aqueuses Vrarie VersionDocument30 pagesEquilibre de Dissociation Dans Les Solutions Aqueuses Vrarie Versionmatar sagnaPas encore d'évaluation
- LunetteDocument4 pagesLunettePhilzyPas encore d'évaluation
- Analyses ChimiquesDocument4 pagesAnalyses ChimiquesPhilzyPas encore d'évaluation
- Analyses PhysiquesDocument4 pagesAnalyses PhysiquesPhilzyPas encore d'évaluation
- 01 - Transfrormeer Un Texte en CroquisDocument3 pages01 - Transfrormeer Un Texte en CroquisPhilzyPas encore d'évaluation
- Préparation Métallographique Des Pièces en MétalDocument6 pagesPréparation Métallographique Des Pièces en MétalVicbeau3Pas encore d'évaluation
- انزيموDocument5 pagesانزيموhadjer.laamariPas encore d'évaluation
- Glaçures CeladonDocument18 pagesGlaçures CeladonLeland Stanford100% (1)
- Rapport StageDocument48 pagesRapport Stagemohammed.dahrPas encore d'évaluation
- These 636930155902386042Document297 pagesThese 636930155902386042bedaPas encore d'évaluation
- Schéma F - L3 TGP PDFDocument17 pagesSchéma F - L3 TGP PDFMamane BachirPas encore d'évaluation
- Industrie Textile: (Figure 975) Les Stades Décrits Ci-AprèsDocument4 pagesIndustrie Textile: (Figure 975) Les Stades Décrits Ci-AprèsabdelbarrPas encore d'évaluation
- Catalogue MaltepDocument75 pagesCatalogue MaltepAnonymous WQjBsd6Pas encore d'évaluation
- Exercices 9 Les Piles Et Récupération D'énergieDocument1 pageExercices 9 Les Piles Et Récupération D'énergieMajed GharibPas encore d'évaluation
- B A D C Q: Transformations Spontanés Dans Les PilesDocument1 pageB A D C Q: Transformations Spontanés Dans Les PilesSOUFIANE SAMAKAPas encore d'évaluation
- Exercice 1Document3 pagesExercice 1Omar GhPas encore d'évaluation
- Portefolio Chimie Organique Expérimental AvancéeDocument8 pagesPortefolio Chimie Organique Expérimental AvancéeRaptor Cocles (RaptorCocles)Pas encore d'évaluation
- Pulverisation Tableau Buses NormesisoDocument2 pagesPulverisation Tableau Buses Normesisoabid sofienPas encore d'évaluation
- Cours Pollution Des EauxDocument8 pagesCours Pollution Des Eauxjesus de jesusPas encore d'évaluation
- Hardox ExtremeDocument2 pagesHardox ExtremeThameur KamounPas encore d'évaluation
- TPE FinalDocument30 pagesTPE Finalemergency_100% (1)
- Les Grandes Classes Des Réactions Organiques (Ubcod)Document53 pagesLes Grandes Classes Des Réactions Organiques (Ubcod)baid ezzahraPas encore d'évaluation
- Les Formules de PHDocument2 pagesLes Formules de PHmohamigo2100% (1)
- PRYAP51004Document2 pagesPRYAP51004BOUZIANE MessaoudPas encore d'évaluation
- Cas BloomDocument8 pagesCas Bloombasmaher123Pas encore d'évaluation
- Charbon ActifDocument113 pagesCharbon Actiffatimaezzahra.ahssiniPas encore d'évaluation
- TD Purification Des EnzymeDocument4 pagesTD Purification Des EnzymeChenini TayebPas encore d'évaluation
- Differentes Formes Galeniques Des P.C.H.C. Eleves-2Document6 pagesDifferentes Formes Galeniques Des P.C.H.C. Eleves-2MarwaaPas encore d'évaluation
- Parker Legris - Poster - Tubes Et Tuyaux Techniques - 2003Document1 pageParker Legris - Poster - Tubes Et Tuyaux Techniques - 2003ZorbanfrPas encore d'évaluation
- Introduction Aux Materiaux CompositesDocument2 pagesIntroduction Aux Materiaux CompositesOuahes HoudaifaPas encore d'évaluation
- L'oxydation Catalytique Des Composés Organique Des Composés Organiques Volatils Par Des CatalyseuDocument62 pagesL'oxydation Catalytique Des Composés Organique Des Composés Organiques Volatils Par Des CatalyseuKevin RavelondrambalaPas encore d'évaluation
- Tableau Comparatif Des NormesDocument6 pagesTableau Comparatif Des NormesKarim Abousselham100% (1)
- Devoir N°1 Du Premier Semestre Sciences Physiques 3ème 2022-2023 SénégalDocument2 pagesDevoir N°1 Du Premier Semestre Sciences Physiques 3ème 2022-2023 SénégalAmadou BaPas encore d'évaluation
- XE SDE PR FR QM Pré&Désinfection Modes Opératoires 130712Document12 pagesXE SDE PR FR QM Pré&Désinfection Modes Opératoires 130712Mada GemmaPas encore d'évaluation
- Phytoprotection de L'huile D'olive Vierge (H.O.V)Document127 pagesPhytoprotection de L'huile D'olive Vierge (H.O.V)mokhtarkan100% (2)