Académique Documents
Professionnel Documents
Culture Documents
Résumé Enzymologie
Transféré par
SERIGNE MAYORO THIAMTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Résumé Enzymologie
Transféré par
SERIGNE MAYORO THIAMDroits d'auteur :
Formats disponibles
Idées dans les qcm : imene.sderradji@gmail.
com
Petit disclaimer : ceci n’est pas un résumé du cours mais
un recueil des idées fréquentes dans les QCM + quelques
Notions en plus que je trouve importantes
-Les cofacteurs se lient de façon transitoire (non covalente )
Les coenzymes :
Se dissocient de l’enzyme à chaque réaction
Forment de faibles liaisons avec l’enzyme
Ont une concentration de même ordre de grandeur que le substrat
Existe les coenzymes libres qui lorsqu’ils s’associeront à une partie protéique
appelée « apoenzyme »pour former un complexe nommée « Holoenzyme » ;
dans ce cas le coenzyme est nommé coenzyme VRAI ( ex : NAD+ et NADP+ )
Il existe aussi des enzymes qui comportent dans leur structure un coenzyme ce
dernier lié à l’apoenzyme par une liaison covalente le coenzyme est alors appelé
GROUPEMENT PROSTHETHIQUE ( ex :FAD et FMN )
- les groupements prosthétiques ne se dissocient pas de l’enzyme ( sont liés de
façon covalente )
- Classification des enzymes :
Les transférases : transfèrent un groupement
Les hydrolases : assurent la destruction d’une substance par l’eau H2O
Les lyases : capables de casser des liaisons covalentes en créant souvent de
nouvelles doubles liaisons ( ex : décarboxylase )
Les isomérases : catalysent l’isomérisation
Les ligases : catalysent la jonction de 2 molécules
le numéro de code d’une enzyme :
1er chiffre : la classe de l’enzyme
2éme chiffre : la sous classe ; nature du groupement chimique donneur
3éme chiffre : la sous sous classe ; la nature chimique de l’accepteur
4éme chiffre : groupe numéro d’ordre de l’enzyme (dans la sous sous classe )
- Enzyme allostérique :
structure quaternaire + la forme sigmoide de la courbe v=f(t) est caractéristque
du phénomène de coopérativité + a un site actif pour le substrat et un autre site
pour l’effecteur allostérique ( différents )
La transition allostérique :
La molécule apparait soit dans un état Tendu ou relâché, qui diffère par leur
affinité au substrat :
T: Faible affinité pour S
R: Forte affinité pour S
La coopérativité :
La fixation d’un effecteur allostérique influe sur la fixation du substrat
- Le site actif :
Comporte 2 sites : un site de fixation et un site catalytique
Est situé dans la zone hydrophobe de l’enzyme
Les acides aminés qui le constitue sont des AA de contact (forment des liaisons
avec le substrat et assurent la catalyse ) , auxiliaires ( assure la mobilité des
zones au voisinage du site actif ), contributeurs ( ou collaborateurs assurent la
stabilité de l’enzyme en lui donnant la structure idéale )
_ Les isoenzymes :
==catalysent la même réaction / possèdent le même substrat
== différent par :
* le tissu où ils sont retrouvés
* par quelques propriétés physico chimique (pH, température )
*la cinétique (km , vmax ),
*sensibilité à certains effecteurs ( inhibiteurs ou activateurs )
-les enzymes ne SONT PAS TOUTE DES PROTEINES : comme la ribonucléase
- les enzymes DIMINUENT l’énergie libre d’activation de la réaction .
- L’enzyme se retrouve TOJOURS intacts à la fin de la réaction
E + S = ES = E + P
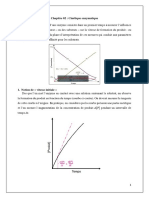
La cinétique michaelienne :
Hyperbole
Vi=vmax.([s]
-La constante de Michaelis et menten :
Représente l’affinité de l’enzyme pour son substrat ( plus km est faible plus
l’affinité augmente )
Différent d’une enzyme à une autre quand [S]=km : v=vmax/2
Km à la même unité que la concentration du substrat
L’unité internationale « UI » est la quantité d’enzyme qui catalyse la
transformation d’une micromole de substrat par minute dans les conditions
optimal de mesure UI= μmol/min
-pour mesurer l’activité d’une enzyme il faut travailler en excès de substrat
à pH et à température optimales .
-Les inhibiteurs :
Compétitif : km augmente / vmax constante ( se lie au site actif )
Non compétitif : km constant / vmax diminue ( se lie a l’enzyme dans un endroit
autre que le site actif )
incompétitif : km augmente / vmax diminue (se lie au complexe ES )
sont les 3 réversibles ;)
cinétique à 2 substrats :
2 mécanismes :
*Séquentiels : ordonnés et aléatoires
1/bi-bi aléatoire :
Aucun ordre n’est observé le substrat A peut se fixer en 1er comme en 2ème
2/bi-bi ordoné :
Ordre bien précis :
Fixation du substrat A puis du substrat B ENSUIIIITE libération Du produit ISSU
DE B puis du produit issu de A
*Ping pong un ou plusieurs produits sont libérés
par l’enzyme avant que les substrats ne soient fixés
Vous aimerez peut-être aussi
- EnzymologieDocument12 pagesEnzymologieBasmã AlilechePas encore d'évaluation
- Bilan Chapitre - Les EnzymesDocument2 pagesBilan Chapitre - Les EnzymesElMamoun.FILALIPas encore d'évaluation
- Généralités Sur Les EnzymesDocument70 pagesGénéralités Sur Les EnzymesDidaLalou100% (2)
- Chapitre 01Document7 pagesChapitre 01BENYAHIA NESRINEPas encore d'évaluation
- Cours Enzymologie 2022Document86 pagesCours Enzymologie 2022Adja Aïta BaPas encore d'évaluation
- Introduction EnzymatologieDocument9 pagesIntroduction Enzymatologiefiras7Pas encore d'évaluation
- Cours EnzymologieDocument80 pagesCours EnzymologieLinda KoundziPas encore d'évaluation
- Bioch1an16-Enzymologie GhoualiDocument67 pagesBioch1an16-Enzymologie Ghoualiahlemm100% (1)
- Cours Enzymes AlloDocument8 pagesCours Enzymes AlloAlexandre OuffouePas encore d'évaluation
- 2 лекция ферментыDocument10 pages2 лекция ферментыE BPas encore d'évaluation
- Enzyme AllostériqueDocument2 pagesEnzyme Allostériqueelsa.rose180Pas encore d'évaluation
- EnzymesDocument24 pagesEnzymesLectorPas encore d'évaluation
- DéfinitionDocument8 pagesDéfinitionelsa.rose180Pas encore d'évaluation
- EnzymologieDocument16 pagesEnzymologieFanny GrouxPas encore d'évaluation
- Enzymologie 9Document31 pagesEnzymologie 9Dr.Zakaria MFTPas encore d'évaluation
- Enzymologie PDFDocument28 pagesEnzymologie PDFTCHEMMIK NazihaPas encore d'évaluation
- Cours 3 EnzymologiesDocument49 pagesCours 3 EnzymologiesGarantigui SyllaPas encore d'évaluation
- Chapitre 3Document22 pagesChapitre 3MariemBoujmalPas encore d'évaluation
- Bioréacteurs Ou Réacteurs Enzymatiques: Chapitre IIIDocument22 pagesBioréacteurs Ou Réacteurs Enzymatiques: Chapitre IIIBøũdįāf KhäwlåPas encore d'évaluation
- 2 - Introduction A L - Enzymologie PDFDocument9 pages2 - Introduction A L - Enzymologie PDFGabrielle NnomoPas encore d'évaluation
- Propriétés Générales Des EnzymesDocument28 pagesPropriétés Générales Des EnzymesliliPas encore d'évaluation
- Cours de Biologie Les EnzymesDocument10 pagesCours de Biologie Les EnzymesOussamaPas encore d'évaluation
- ChapI ENZYMOLOGIE COENZYMES ET VITAMINESDocument49 pagesChapI ENZYMOLOGIE COENZYMES ET VITAMINESbessama84100% (2)
- Enzymologie Partie 1Document9 pagesEnzymologie Partie 1LIBRAIRIE DAHMANI TOUATPas encore d'évaluation
- Les EnzymesDocument17 pagesLes EnzymesAbdo AichaPas encore d'évaluation
- CourtelineDocument4 pagesCourtelineHugo Bertrand BeyneixPas encore d'évaluation
- 07-Mécanismes de La Catalyse EnzymatiqueDocument12 pages07-Mécanismes de La Catalyse EnzymatiquenasrotesnimePas encore d'évaluation
- UE 1 EnzymologieDocument11 pagesUE 1 EnzymologieJulien CoguicPas encore d'évaluation
- Enzymes Allostã - RiquesDocument29 pagesEnzymes Allostã - RiquesAmine DidoPas encore d'évaluation
- Séance VI - COURS. Enzymologie UE-SF 2Document51 pagesSéance VI - COURS. Enzymologie UE-SF 2Lamisse AbedPas encore d'évaluation
- Chapitre N 6 SuiteDocument3 pagesChapitre N 6 SuiteHou HoPas encore d'évaluation
- Chapitre 1 Définition, Classification Et StructureDocument10 pagesChapitre 1 Définition, Classification Et Structureryadh2203Pas encore d'évaluation
- Réacteurs-3Document4 pagesRéacteurs-3Asma LalamaPas encore d'évaluation
- 10.03.2016 Les EnzymesDocument14 pages10.03.2016 Les EnzymesEaPas encore d'évaluation
- Les EnzymeDocument24 pagesLes Enzymemalak zerizerPas encore d'évaluation
- EnzymesDocument6 pagesEnzymesRoudaina BenzeguirPas encore d'évaluation
- La Cinétique EnzymatiqueDocument6 pagesLa Cinétique EnzymatiqueTCHEMMIK NazihaPas encore d'évaluation
- 2 Enzymologie LAS 2020Document56 pages2 Enzymologie LAS 2020Adjinsala PantouinPas encore d'évaluation
- Correction TD Enzymologie 5 PDFDocument29 pagesCorrection TD Enzymologie 5 PDFSalah Eddine Msiky90% (10)
- Resumé ENZYMOLOGIEDocument13 pagesResumé ENZYMOLOGIEislamouahabiPas encore d'évaluation
- 5 EnzymeDocument64 pages5 EnzymesafidylalainarazafimahatratraPas encore d'évaluation
- 4 - Enzymes AllosteriquesDocument4 pages4 - Enzymes Allosteriquesoran comptPas encore d'évaluation
- 6 Les EnzymesDocument6 pages6 Les EnzymeshessasPas encore d'évaluation
- 4 - Enzymes AllosteriquesDocument4 pages4 - Enzymes Allosteriquesoran comptPas encore d'évaluation
- Enzymes Allostérique, Vitamines Et CoenzymesDocument6 pagesEnzymes Allostérique, Vitamines Et Coenzymesgogo82100% (4)
- Tpebhs 4346Document20 pagesTpebhs 4346Staline DonkengPas encore d'évaluation
- SBI4U_M1_T25_28_29_81à 83_F2018PUDocument233 pagesSBI4U_M1_T25_28_29_81à 83_F2018PUsahar.yasna.mPas encore d'évaluation
- Chapitre 02 Cinétique EnzymatiqueDocument5 pagesChapitre 02 Cinétique Enzymatiqueamina44Pas encore d'évaluation
- Cours de Cinetique A Deux SubstratsDocument8 pagesCours de Cinetique A Deux Substratsmistic JayPas encore d'évaluation
- Les Enzymes 21Document58 pagesLes Enzymes 21Rania Maddah100% (1)
- Cours de BCH 301 Nomenclature Et Classification Des EnzymesDocument13 pagesCours de BCH 301 Nomenclature Et Classification Des Enzymesmistic JayPas encore d'évaluation
- Chap.01 Proprites Et Clasification Des EnzymesDocument14 pagesChap.01 Proprites Et Clasification Des EnzymesFatïma ZohraPas encore d'évaluation
- Cours Theme 1A5Les EnzymesDocument3 pagesCours Theme 1A5Les Enzymesqphzqf5mj9Pas encore d'évaluation
- Theme 1A Cours 2019 Chap 4Document7 pagesTheme 1A Cours 2019 Chap 4flo bilPas encore d'évaluation
- Chapitre 1 Propeiétés Des EnzymesDocument8 pagesChapitre 1 Propeiétés Des Enzymeskgu yryrtyPas encore d'évaluation
- Catalyse EnzymatiqueDocument4 pagesCatalyse Enzymatiqueryadh2203Pas encore d'évaluation
- Chapitre 4 Elèves Les Enzymes, Des Biocatalyseurs 2023-2024Document3 pagesChapitre 4 Elèves Les Enzymes, Des Biocatalyseurs 2023-2024cloe.garrotPas encore d'évaluation
- Chap 4 EnzymesDocument38 pagesChap 4 Enzymesflo bilPas encore d'évaluation
- Chap 4 EnzymesDocument38 pagesChap 4 Enzymesflo bilPas encore d'évaluation
- Note Des Services Secrets Français Sur La Pénétration Économique Pays Bloc Soviétique en Afrique en 1959Document25 pagesNote Des Services Secrets Français Sur La Pénétration Économique Pays Bloc Soviétique en Afrique en 1959SERIGNE MAYORO THIAMPas encore d'évaluation
- Note Du Ministère Français Des Colonies Sur La Conférence de Brazza 28 Février 1944Document4 pagesNote Du Ministère Français Des Colonies Sur La Conférence de Brazza 28 Février 1944SERIGNE MAYORO THIAMPas encore d'évaluation
- Livret de Recettes Pour Une Bonne Sant 1703529597Document60 pagesLivret de Recettes Pour Une Bonne Sant 1703529597oumy kebePas encore d'évaluation
- Guide-Methodo - PROJET D'ECOLEDocument7 pagesGuide-Methodo - PROJET D'ECOLESERIGNE MAYORO THIAMPas encore d'évaluation
- Proprietes ColligativesDocument46 pagesProprietes ColligativesSERIGNE MAYORO THIAMPas encore d'évaluation
- 06 - Electrophysiologie Cellulaire DR BATHILY (77) - CopieDocument50 pages06 - Electrophysiologie Cellulaire DR BATHILY (77) - CopieIbrahima tallPas encore d'évaluation
- Proteomic Travaux DirigesDocument4 pagesProteomic Travaux DirigesAbde AssaidiPas encore d'évaluation
- Mémoire Fares NasfiDocument19 pagesMémoire Fares NasfiTomPas encore d'évaluation
- Le Marquage Des Acides NucléiquesDocument5 pagesLe Marquage Des Acides NucléiquesBechir DjazouliPas encore d'évaluation
- Présentation CIMV - Boulogne - MasivetDocument51 pagesPrésentation CIMV - Boulogne - MasivetvetideoPas encore d'évaluation
- La Cytogénétique - Partie2Document24 pagesLa Cytogénétique - Partie2chai maPas encore d'évaluation
- Fiches de Revision SVT 1e Semestre 1Document32 pagesFiches de Revision SVT 1e Semestre 1zineb IhsanePas encore d'évaluation
- Métabolisme Des Protéines Et Des Acides Aminés: Chapitre ChapitreDocument14 pagesMétabolisme Des Protéines Et Des Acides Aminés: Chapitre ChapitreZineb DahmaniPas encore d'évaluation
- Le Noyau InterphasiqueDocument45 pagesLe Noyau Interphasiquealibenhamida5725100% (5)
- Corrigé 06Document2 pagesCorrigé 06lmd200975% (4)
- Structure Et Classification Des Acides AminésDocument9 pagesStructure Et Classification Des Acides Aminésoussama bouchoukaPas encore d'évaluation
- TDTM DWDocument83 pagesTDTM DWEl-Kaber HachemPas encore d'évaluation
- La Nature de L'information GenetiqueDocument6 pagesLa Nature de L'information Genetiqueyassirfaddali2008Pas encore d'évaluation
- Les Methodes Electrophoretique - Rochdi Mouad - 1293 PDFDocument36 pagesLes Methodes Electrophoretique - Rochdi Mouad - 1293 PDFHary John Tsivery Rakotonjak'sParowPas encore d'évaluation
- Chapitre 3 Génie Génétique - PPT Version 1Document8 pagesChapitre 3 Génie Génétique - PPT Version 1ahmed rachdiPas encore d'évaluation
- 2 Cours Cyto Les Transports MBNDocument21 pages2 Cours Cyto Les Transports MBNegos013Pas encore d'évaluation
- Resultats Analyse InterpretationDocument12 pagesResultats Analyse InterpretationCedric HeviefoPas encore d'évaluation
- HémoglobinebisDocument49 pagesHémoglobinebissouraley kouamePas encore d'évaluation
- Cours Effec de R Enzym-2Document58 pagesCours Effec de R Enzym-2gaming passion100% (1)
- El Aziz, HDocument127 pagesEl Aziz, HROKNI yahyaPas encore d'évaluation
- Brassage Genetique Bilan 2023 - Copie ÉlèveDocument3 pagesBrassage Genetique Bilan 2023 - Copie ÉlèveWijdene SassiPas encore d'évaluation
- Métabolisme Du FerDocument75 pagesMétabolisme Du FerOUMAIMA EL CHAAL100% (2)
- 12-Stabilité Du Génome HumainDocument38 pages12-Stabilité Du Génome HumainwissalabPas encore d'évaluation
- Biologie Cellulaire - PR KHANFRI Jamal Eddine - 16102020 - Schémas I PDFDocument98 pagesBiologie Cellulaire - PR KHANFRI Jamal Eddine - 16102020 - Schémas I PDFHamza BaibaiPas encore d'évaluation
- 069 116 Chap4 GenomesDocument48 pages069 116 Chap4 GenomesOwassiPas encore d'évaluation
- Biochimie Microbienne - 9-Voie-Pentoses-Phosphates PDFDocument19 pagesBiochimie Microbienne - 9-Voie-Pentoses-Phosphates PDFliliPas encore d'évaluation
- Fiches de Revision SP 1e SemestreDocument25 pagesFiches de Revision SP 1e SemestreAourras NourdinPas encore d'évaluation
- TD SignalisationDocument5 pagesTD Signalisationmido benPas encore d'évaluation
- Introduction A L Etude Des Enzymes 2012Document40 pagesIntroduction A L Etude Des Enzymes 2012Jamal BerrichePas encore d'évaluation
- Neurophysiologie CompletDocument33 pagesNeurophysiologie CompletClémence PrévostPas encore d'évaluation