Académique Documents
Professionnel Documents
Culture Documents
07 Item 294 Cancers de L - Enfant - Medline Cancéro 20
Transféré par
DAVID THYTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
07 Item 294 Cancers de L - Enfant - Medline Cancéro 20
Transféré par
DAVID THYDroits d'auteur :
Formats disponibles
UElO Item 294
........................... . . .
CHAPITRE ►,________________________________________
Cancers de l'enfant
Particularités épidémiologiques, diagnostiques
et thérapeutiques
Dr Maryline Poirée', Pr Nicolas Sirvent2, Dr Guillaume Vogin3, Pr Gilles Vassal4, Pr Marc-André Mahé'
'Unité d'Oncohématologie pédiatrique, CHU Nice
'Unité d'Oncologie pédiatrique, CHU Montpellier
•Département de Radiothérapie, Institut de Cancérologie de Lorraine -Alexis Vautrin, Vandoeuvre-lès-Nancy
•Département de Recherche clinique, Institut Gustave Roussy, Villejuif
'Département de Radiothérapie, Institut de Cancérologie de l'Ouest-René Gauducheau, Nantes-Saint-Herblain
1. Épidémiologie OBJECTIFS iECN
2. Facteurs étiologiques ➔ Cancers de l'enfant, particularités épidémiologiques,
2.1. Rôle de l'environnement diagnostiques et thérapeutiques
2.2. Facteurs génétiques - Connaître les principaux types histologiques
3. Particularités diagnostiques - Connaître les particularités diagnostiques et thérapeu-
3.1. La clinique tiques
3.2. Les examens complémentaires - Justifier l'intérêt du suivi à long terme
4. Particularités thérapeutiques
4.1. La chimiothérapie
4.2. La radiothérapie
4.3. La chirurgie Mots clés: Épidémiologie - Génome - Marqueurs
4.4. Les soins palliatifs tumoraux - Chimiothérapie - Chirurgie -
5. Les conséquences à long terme Radiothérapie - Soins palliatifs - Suivi à long terme
1. Épidémiologie
• Les cancers de l'enfant et de l'adolescent sont des maladies rares qui représentent 1 % de l'ensemble des cancers,
en France et dans les pays comparables au plan socio-économique.
• Leur incidence est en moyenne de 120/million d'enfants par an, répartis en 1 700 nouveaux cas entre O et 15 ans
et 700 nouveaux cas chez les AJA (Adolescents et Jeunes Adultes) entre 15 et 20 ans. Ainsi, un enfant sur 440 va
développer un cancer avant l'âge de 15 ans et un sur 300 avant l'âge de 20 ans.
• Ils représentent la deuxième cause de mortalité entre 1 et 14 ans, après les accidents, soit 20 % des décès.
• Certaines formes de cancers sont spécifiques à l'enfant et, inversement, la plupart des cancers de l'adulte
n'existent pas chez l'enfant. Globalement, les cancers de l'enfant diffèrent de ceux de l'adulte par leurs caractéris
tiques cliniques, biologiques, anatomo-pathologiques et leur sensibilité thérapeutique élevée.
• Leur pronostic est bien meilleur que celui des cancers de l'adulte puisque le taux de guérison, tous cancers
confondus, est de l'ordre de 80 %. Une maladie métastatique peut être curable. On estime actuellement en France
à 50 000 le nombre d'adultes survivants d'un cancer traité avant l'âge de 20 ans et concernés par les possibles effets
tardifs de la maladie et des thérapeutiques reçues.
• La répartition des principaux cancers de l'enfant est indiquée dans le tableau suivant:
-- Tableau 1. RÉPARTITION DES PRINCIPAUX CANCERS DE L'ENFANT
--------�------ -�-
--·---�--� - --- -
Leucémies et lymphomes 40% Néphroblastomes 8%
Tumeurs cérébrales 20% Tumeurs osseuses 5%
Tumeurs germinales,
Neuroblastomes 9 °/o 3,5%
trophoblastiques et gonadiques
Tumeurs des tissus mous 7 °/o Rétinoblastomes 3 °/o
LJE 1 Ü - ITEM 294 CANCERS DE L'ENFANT 1 21 ◄
• Il s'agit principalement de leucémies aiguës, de tumeurs cérébrales et de tumeurs embryonnaires spécifiques de
l'enfant (néphroblastomes, neuroblastomes). Après l'âge de 10 ans, les lymphomes, les tumeurs cérébrales et les
tumeurs osseuses et conjonctives prédominent.
• Il existe globalement une prédominance masculine, avec un sexe-ratio évalué à 1, 2/1. L'incidence et la réparti
tion des cancers de l'enfant varient selon l'origine ethnique et géographique de l'enfant.
SYNTHÈSE
• L'incidence des cancers de l'enfant et de l'adolescent est de 2 400/an en France.
• Le taux de guérison est de l'ordre de 80 %.
• Les tumeurs les plus fréquentes sont hématologiques et cérébrales.
2. Facteurs étiologiques
• L'étiologie de la plupart des cancers de l'enfant reste encore mal connue.
2. 1. Rôle de l'environnement
• À la différence de l'adulte, le rôle des facteurs d'environnement apparaît minime dans la genèse des cancers de
l'enfant (qui peuvent également survenir chez l'adulte jeune).
• On peut citer cependant:
- le rôle des radiations ionisantes : certains enfants présentent une radiosensibilité individuelle élevée de
manière constitutionnelle pouvant se manifester par une augmentation du risque de cancer après de faibles
doses d'irradiation dans un contexte diagnostique ou thérapeutique;
- le rôle de certains agents chimiques: l'exposition in utero au di-éthylstilbestrol entraîne un risque important
d'adénocarcinome à cellules claires du vagin;
- le rôle de certains agents infectieux, en particulier viraux: Epstein-Barr virus et lymphome de Burkitt africain
et carcinome indifférencié du nasopharynx, virus de l'hépatite B et hépatocarcinome, virus HIV et lymphome;
- le rôle de certains agents de chimiothérapie (alkylants) dans le développement de leucémies secondaires.
2.2. Facteurs génétiques
• Dans la majorité des cas, les cancers de l'enfant surviennent de façon sporadique, sans histoire familiale de
cancer, ni maladie génétique associée. De ce fait, le risque de cancer chez les apparentés n'est que peu différent
de celui de la population générale.
• Cependant, un faible pourcentage ( < 10 %) des cancers de l'enfant est associé à des facteurs génétiques:
- prédisposition héréditaire au cancer transmise sur un mode autosomique dominant, lié dans la majorité des
cas à une mutation germinale du gène p53 : syndrome de Li Fraumeni. Le risque de développer un cancer chez
les individus porteurs de cette mutation est d'environ 50 % avant l'âge de 30 ans : sarcome des tissus mous,
ostéosarcome, cancer du sein, tumeur cérébrale, corticosurrénalome, leucémie;
- cancer héréditaire transmis sur un mode autosomique dominant : rétinoblastome ;
- phacomatose et neurodermatose : la maladie de Recklinghausen expose à un risque accru de tumeurs du
système nerveux ou de la crête neurale, neurofibromatose de type 2;
- instabilité chromosomique : maladie de Fanconi, ataxie télangiectasie;
- aberrations chromosomiques : syndrome de Wiedeman-Beckwith (risque accru de néphroblastome et
hépatoblastome), trisomie 21 ;
- déficit immunitaire : risque accru de lymphome.
► 122 CANCERS DE L'ENFANT LJE 1 Ü - ITEM 294
UE10 Item 294
...... .. ................. .. .
• Ainsi, la constatation de certaines malformations congénitales doit alerter sur le risque accru de cancer
spécifique :
- aniridie congénitale et néphroblastome;
- cryptorchidie et tumeurs germinales;
- hémi-hypertrophie corporelle et néphroblastome.
.---------------.--------.
SYNTHÈSE
• La grande majorité des cancers de l'enfant survient de façon sporadique.
• Le rôle de l'environnement et des facteurs génétiques est faible.
• Il n'y a pas de place pour le dépistage, sauf dans les syndromes de prédisposition.
3. Particularités diagnostiques
3.1. La clinique
• Deux particularités fréquentes propres aux tumeurs de l'enfant, en particulier celles de typ e embryonnaire,
doivent être soulignées
- la rapidité souvent extrême de leur croissance, parfois en quelques jours, qui n'est pas synonyme de gravité
spécifique et qui peut laisser présager au contraire d'une grande sensibilité à la chimiothérapie. En corollaire,
l'affection peut être révélée par des signes d'appel de gravité amenant à une consultation en urgence: dyspnée
aiguë, syndrome hémorragique, CIVD, hyp ercalcémie, HTIC d'installation rapide, compression médullaire,
syndrome cave supérieur;
- la conservation d'un bon état général apparent, en dehors du cas des leucémies et de certains cancers à
l'origine d'une atteinte de la moelle osseuse.
• Les signes d'appel dépendent de la taille de la tumeur et de sa localisation.L'attention doit être attirée lorsqu'ils
persistent plus de 15 jours.
- palpation d'une masse périphérique même de petite taille (membres, cou), ou profonde et souvent volumineuse
(abdomen, pelvis); grosse bourse;
- adénopathies persistantes fixées, non inflammatoires, en dehors d'un contexte infectieux loco-régional surtout
si association à un prurit;
- reflet blanc pupillaire imposant la réalisation d'un fond d'œil;
- exophtalmie, strabisme, diplopie.
- douleurs persistantes, en particulier osseuses, dont le caractère insomniant doit être particulièrement alarmant
et dont il faut savoir déceler la traduction chez le nourrisson (diminution de l'activité, atonie psycho-motrice...);
- boiterie, troubles de la marche, gestes maladroits;
- signes neurologiques dont la nature dépend de la localisation des lésions (hypertension intracrânienne, déficits
moteurs et/ou sensitifs, troubles de la déglutition, modification du comportement, perte de l'acquisition
[langage, propreté]), augmentation du périmètre crânien;
- symptomatologie compressive (voies respiratoires, axe digestif) ;
- syndrome hémorragique: hématurie, méléna, rectorragies, saignement vaginal;
- syndromes paranéoplasiques qui sont exceptionnels dans les cancers de l'enfant (syndrome opso-myoclonique
des neuroblastomes);
UE 1 Ü - ITEM 294 (ANCERS DE L'ENFANT 123 ◄
- cachexie: syndrome de Russel (ou « cachexie diencéphalique ») lié à la présence d'une tumeur dans la région
hypothalamique, responsable d'une cassure des courbes staturo-pondérales, avec perte du panicule adipeux.
- puberté précoce révélatrice de certaines tumeurs hyp othalamohyp ophysaires, ovariennes ou surrénaliennes.
• Fréquemment, la présentation clinique se révèle latente, trompeuse, peu symptomatique, aboutissant à un
délai diagnostique vécu difficilement par les parents, pendant lequel la maladie évolue.
3.2. Les examens complémentaires
imagerie, du diagnostic cytologique et/ou anatomo-pathologique et de 1
ncers permettent habituellement d'arriver rapidement au diagnostic. Cepe
meurs, l'enfant doit être impérativement adressé dès la suspicion diagno
3.2. 1. Imagerie
• Il faut souligner l'importance de la qualité de l'imagerie initiale qui permet une évaluation de l'extension loco
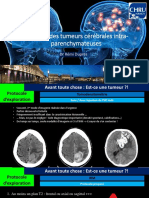
régionale et un bilan d'opérabilité (Figure 1).
• Le choix de l'examen le plus judicieux va dépendre de la localisation tumorale; à titre d'exemple:
- échographie abdominale pour une tumeur abdomino-pelvienne;
- radiographies osseuses simples pour les tumeurs osseuses;
- imagerie par résonance magnétique pour les tumeurs cérébrales et osseuses;
- scanner pour la recherche de localisations secondaires pulmonaires ...
• Certaines explorations isotopiques permettent d'affirmer le diagnostic et/ou de participer au bilan d'exten
sion: scintigraphie à la méthyliodobenzylguanidine spécifique des tumeurs sympathiques et carcinoïdes, scinti
graphie osseuse au technetium 99 pour les métastases osseuses et les tumeurs osseuses primitives.
• La tomographie par émission de positons (ou TEP-TDM) est un examen scintigraphique, réalisé après l'injec
tion intraveineuse d'un traceur faiblement radioactif (généralement le 18F-fluorodéoxyglucose, analogue du glu
cose) qui permet d'obtenir des renseignements sur le fonctionnement et l'activité des organes. Le TEP-TD M, bien
que non spécifique d'une pathologie, est devenu un examen important dans le bilan d'extension et la surveillance
de certains cancers de l'enfant (lymphomes, sarcomes...).
Figure 1. Coupe coronale d'un néphroblastome droit chez un enfant de 5 ans
► 124 CANCERS DE L'ENFANT LJE 1 Ü - ITEM 294
UE10 ltem294
3.2.2. Examens biologiques
• Il existe peu de marqueurs tumoraux en oncologie pédiatrique. Cependant, dans certains cancers de l'enfant,
l'identification d'un marqueur tumoral spécifique permet d'affirmer le diagnostic, d'évaluer l'efficacité du traite
ment, et de surveiller l'enfant une fois la rémission obtenue:
- Catécholamines urinaires et leurs métabolites: neuroblastomes ;
- Alfa-foetoprotéine: hépatoblastomes et certaines tumeurs germinales malignes (tumeurs du sac vitellin) ;
- Beta hCG: certaines tumeurs germinales malignes (choriocarcinome).
• Certaines molécules, non spécifiques, représentent un indice de volume et/ou d'activité tumorale, parfois
corrélées au pronostic: LDH (lactates déshydrogénases): neuroblastomes, lymphomes.
• Une place particulière revient actuellement à l'analyse du génome des cellules cancéreuses, réalisée au moyen
de techniques variées: cytogénétique conventionnelle et/ou moléculaire (hybridation fluorescente in situ), biolo
gie moléculaire... Historiquement développée dans les proliférations hématologiques malignes, où cette analyse
est essentielle dans le diagnostic et l'élaboration de la stratégie thérapeutique, son intérêt s'affirme également dans
la prise en charge des tumeurs solides (valeur pronostique de l'amplification de l'oncogène N-Myc dans les neuro
blastomes). De plus, la caractérisation des anomalies génomiques tumorales permet d'envisager la mise au point
de traitements plus spécifiques de la prolifération maligne, ciblés sur l'anomalie moléculaire identifiée.
3.2.3. Examen anatomo-patho/ogique
• Il permet avant tout d'affirmer le diagnostic, mais également dans certains cas d'établir un histopronostic à
partir de certains critères propres à chaque tumeur (histopronostic défavorable de certains néphroblastomes com
portant des territoires anaplasiques...) et d'évaluer pour certaines tumeurs la réponse au traitement, élément
fondamental du pronostic (pourcentage de nécrose de la tumeur après traitement par chimiothérapie dans les
ostéosarcomes, les sarcomes d'Ewing... ).
• De manière très schématique, on peut distinguer chez l'enfant 6 grands groupes de proliférations malignes:
- les proliférations d'origine hématologique;
- les proliférations originaires du système nerveux central ;
- les tumeurs de blastème d'organe, dont la cellule tumorale apparaît caractéristique des tumeurs pédiatriques:
cellule de taille petite ou moyenne au cytoplasme basophile avec un noyau rond et une chromatine souvent
très fine ou délavée. Selon l'organe d'origine, on parlera de: néphroblastome (tumeur rénale), hépatoblastome
(tumeur du foie), pneumoblastome (tumeur du poumon), rétinoblastome... ;
- les tumeurs malignes conjonctives, principalement représentées par les rhabdomyosarcomes, développées à
partir des cellules mésenchymateuses primitives ;
- les tumeurs germinales malignes, gonadiques ou extra-gonadiques, développées à partir des cellules
germinales primitives qui migrent entre la quatrième et la sixième semaine de la vie intra-utérine depuis
l'endoderme du sac vitellin vers la crête génitale de l'embryon. Les sites extragonadiques de ces tumeurs
(région sacrococcygienne, rétropéritonéale, médiastinale, intracrânienne) s'expliquent par une migration
anormale de ces cellules à proximité de la ligne médiane. Leur classification est très complexe et les formes
mixtes fréquentes. On peut citer les tumeurs du sac vitellin, les choriocarcinomes, les tératomes, matures ou
immatures, les séminomes... ;
- les tumeurs neuroectodermiques, ou tumeurs de la famille du sarcome d'Ewing. Elles appartiennent au
groupe morphologique des tumeurs à petites cellules rondes, caractérisées par l'existence d'un marqueur
génétique pathognomonique sous la forme d'une translocation spécifique responsable de la formation d'un
transcrit de fusion chimérique (ex: t(ll; 22)(q24; ql2) dans le sarcome d'Ewing).
• Dans tous les cas, la décision d'une exérèse chirurgicale, d'une biopsie chirurgicale ou trans-cutanée doit être
prise en concertation multidisciplinaire entre les spécialistes qui prendront en charge l'enfant.
LJE 10 - ITEM 294 (ANCERS DE L'ENFANT 125 ◄
SYNTHÈSE
• Les particularités diagnostiques des cancers de l'enfant sont:
- leur croissance rapide;
- l'habituelle conservation de l'état général;
- la multiplicité et le caractère souvent « banal » des signes d'appel cliniques dont la persistance/fixité
au-delà de 15 jours doit alerter;
l'importance de doser des marqueurs spécifiques en plus des examens d'imagerie et de l'histologie;
- l'importance de l'analyse du génome des cellules cancéreuses pour le diagnostic, le pronostic et le
traitement;
- les 6 grands groupes de tumeurs malignes chez l'enfant sont : hématologiques, du système nerveux
central, de blastème d'organes, conjonctives, germinales, neuroectodermiques;
l'importance de la prise en charge précoce en milieu spécialisé pluridisciplinaire de cancérologie
pédiatrique.
4. Particularités thérapeutiques
• La prise en charge des cancers de l'enfant fait appel aux mêmes moyens thérapeutiques que chez l'adulte
(chimiothérapie, chirurgie, radiothérapie, immunothérapie, thérapie ciblée...). Après analyse soigneuse des
facteurs pronostiques, la stratégie thérapeutique est élaborée de façon pluridisciplinaire selon des protocoles
(inter)nationaux. Les tumeurs pédiatriques doivent être considérées comme des urgences thérapeutiques, sans
pour autant négliger la qualité du bilan pré-thérapeutique.
• La prise en charge des enfants et adolescents atteints de cancer doit s'effectuer uniquement au sein des centres
spécialisés en cancérologie pédiatrique. Ceux-ci doivent disposer d'un environnement spécifique adapté inté
grant les dimensions familiale, psychologique, sociale et scolaire spécifiques à cette population. Le parcours du
patient doit être coordonné du centre spécialisé aux centres hospitaliers généraux et avec les professionnels inter
venant au domicile. La radiothérapie des patients de moins de 16 ans doit s'effectuer au sein de centres spécialisés.
• Dans la majorité des cas, même en cas maladie métastatique, le contrôle local est fondamental. Globalement,
les cancers pédiatriques s'opèrent rarement en première intention, à l'exception des tumeurs cérébrales.
• Il faut insister chez l'enfant sur le rôle majeur de la chimiothérapie, particulièrement efficace sur les tumeurs
embryonnaires, et dont les avancées ont complètement modifié la place des autres modalités thérapeutiques.
L'amélioration des résultats, liée en grande partie à la pratique d'essais cliniques contrôlés satisfaisant aux exi
gences de l'éthique médicale, permet d'obtenir globalement des taux de guérison de l'ordre de 80 %.
• D'une manière générale, les facteurs pronostiques sont le stade de la maladie au diagnostic, mais aussi et parfois
plus importants, l'âge de l'enfant, le profil immuno-histochimique et génétique, le contrôle local, la réponse aux
traitements néo-adjuvants et la qualité de la prise en charge initiale.
• Il est capital de toujours penser aux séquelles dans l'élaboration de la stratégie thérapeutique qui, par ailleurs,
a tendance à globalement s'alléger pour les stades localisés avec un affinement des classifications pronostiques.
4.1. La chimiothérapie
• La chimiothérapie est adaptée au poids et à l'âge de l'enfant (posologies réduites chez le nourrisson de moins
de 1 an, en particulier).
• Il s'agit souvent, chez l'enfant, dans les tumeurs solides, d'une chimiothérapie néo-adjuvante dont l'objectif
principal est la réduction du volume tumoral permettant un traitement local ultérieur moins dangereux et carci
nologiquement satisfaisant (neuroblastome, néphroblastome...). La chimiothérapie première permet également
d'apprécier la réponse tumorale au traitement, dont l'importance pronostique va conditionner la stratégie théra
peutique ultérieure (sarcomes d'Ewing, ostéosarcomes). La chimiothérapie adjuvante, délivrée chez un enfant
sans maladie résiduelle apparente après un traitement local ou loco-régional, a pour but de prévenir la survenue
et/ou de traiter d'éventuelles localisations secondaires. Dans certains cas, la chimiothérapie résumera le traite
ment : leucémies, lymphomes. Elle peut également être réalisée de façon concomitante à la radiothérapie, princi
palement dans les sarcomes, en adjuvant dans ces cas-là.
► 126 CANCERS DE L'ENFANT LJE 1 Ü - ITEM 294
UE10 ltem294
• Basé sur le concept de dose-intensité (corrélation entre l'efficacité de la chimiothérapie et la quantité de drogue
administrée), le traitement de certaines tumeurs malignes à très haut risque pourra comporter des chimiothé
rapies à hautes doses, sous couvert d'autotransfusion de cellules souches hématopoïétiques.
• Chez l'enfant, les effets secondaires précoces de la chimiothérapie sont:
- les complications hématologiques: aplasie, anémie, thrombopénie ;
- les complications digestives: vomissements, dénutrition, mucite ;
- les complications infectieuses: bactériennes, fongiques, parasitaires ou virales, dont la prise en charge répond
aux mêmes principes que chez l'adulte. Elles doivent être surveillées d'autant plus attentivement que l'enfant
est jeune.
• Certaines complications peuvent se manifester avec des délais variables : maladies cardiovasculaires, cérébro
vasculaires, troubles neurocognitifs, troubles endocriniens (croissance, fonction thyroïdienne), troubles de la
fertilité et des seconds cancers. Le suivi doit être personnalisé, adapté à chaque patient et dépend du type de la
tumeur primitive, des traitements anticancéreux administrés, mais aussi des facteurs génétiques associés éven
tuels. Le risque de développer des complications à long terme augmente avec le temps et peut être exacerbé par les
comorbidités liées à l'âge et aux facteurs environnementaux (tabac, alcool, obésité, sédentarité).
4.2. La radiothérapie
• Même si ses indications diminuent, la radiothérapie, qui est une modalité thérapeutique loco-régionale, s'in
tègre dans la stratégie thérapeutique des cancers de l'enfant dans près de 1/3 des cas, et dans 80 % des tumeurs
cérébrales. La radiothérapie pédiatrique se caractérise d'emblée par l'importance de la mise en condition psycho
logique afin d'obtenir une bonne coopération de l'enfant, indispensable au bon déroulement du traitement et au
respect d'une stricte immobilité. Les méthodes d'irradiation comportent, comme chez l'adulte, la radiothérapie
externe, la plus utilisée, et de façon beaucoup plus exceptionnelle, la curiethérapie. Si la détermination du volume
tumoral se fait de la même façon que chez l'adulte, elle diffère en fonction de l'âge de l'enfant, du type de tumeur
et de la dose à délivrer. Certaines complications de la radiothérapie sont particulières à l'enfant; le développement
de nouvelles techniques, et tout particulièrement la protonthérapie, vise à limiter au maximum les conséquences
à moyen et long terme.
• Les effets secondaires de la radiothérapie dépendent surtout des facteurs suivants: volume à traiter, topographie
de la région à traiter, dose totale à délivrer, dose par séance (fractionnement).
• Tout comme chez l'adulte, on distingue des effets secondaires précoces qui surviennent dans les 3 mois qui
suivent l'initiation du traitement et guérissent généralement intégralement sous soins de support et les toxicités
tardives qui peuvent aboutir à des séquelles d'autant plus invalidantes que l'enfant est jeune au moment de son
traitement. Leur dépistage et leur prise en charge s'avèrent fondamentaux, y compris lorsque l'enfant devien
dra adulte.
Ainsi faut-il citer:
- le ralentissement de la croissance lié à l'irradiation des cartilages de conjugaison à l'origine de troubles de la
statique vertébrale (irradiation du rachis) et/ou d'un raccourcissement des os longs, inesthétique et responsable
d'un handicap fonctionnel ;
- l'existence de séquelles intellectuelles, après irradiation cérébrale. D'apparition retardée et progressive, dose
dépendante, elles sont d'autant plus sévères que l'irradiation survient tôt (particulièrement avant l'âge de 4
ans). Elles se traduisent par un retard du quotient intellectuel, un ralentissement des acquisitions motrices...
- les séquelles endocriniennes : insuffisance hyp ophysaire, à l'origine d'une cassure de la courbe staturale,
insuffisance thyroïdienne, insuffisance gonadique ;
- les seconds cancers dont, hors les proliférations malignes hématologiques, plus de 60 % se développent en
territoire antérieurement irradié.
LJE 1 Ü - ITEM 294 CANCERS DE L'ENFANT 12 7 ◄
4.3. La chirurgie
• L'expertise chirurgicale, qui doit être partie intégrante du projet multidisciplinaire, peut intervenir à dif
férentes étapes de ce projet : diagnostic, lors du traitement local et/ou loco-régional, après le traitement pour
vérifier l'existence d'un résidu tumoral...
Le geste chirurgical ne peut être qu'un geste technique ou thérapeutique isolé.
• Initialement, pour déterminer la nature d'une tumeur solide, une biopsie chirurgicale est, sauf exception,
indispensable. Elle peut parfois être avantageusement remplacée par une aspiration biopsie à l'aiguille fine, réali
sée sous repérage radiologique, moins invasive. Le matériel prélevé doit être cependant suffisant pour permettre,
en sus de l'examen anatomo-pathologique qui affirmera le diagnostic, une analyse complète de la biologie tumo
rale (cytogénétique conventionnelle, analyses de biologie moléculaire...) qui peut constituer un facteur pronos
tique déterminant dans le choix du protocole thérapeutique (neuroblastome...).
• Lors de l'exérèse tumorale, le geste chirurgical intervient après concertation entre l'oncologue médical, l'onco
logue radiothérapeute et l'opérateur pour déterminer le moment de la chirurgie au sein du protocole de trai
tement, décider de l'opérabilité de la tumeur et prévoir les complications post-opératoires et/ou les séquelles
fonctionnelles. L'exérèse tumorale doit être, autant que faire se peut, complète et conservatrice. Elle est parfois
mutilante, parfois impossible.
SYNTHÈSE
• Les traitements principaux des cancers de l'enfant sont la chimiothérapie, la chirurgie et la radiothérapie.
• Chaque traitement comporte des risques de complications aiguës et tardives.
• Les modalités thérapeutiques et leur chronologie doivent être déterminées en réunion de concertation pluri
disciplinaire.
4.4. Les soins palliatifs
• La phase palliative concerne 20 % des enfants atteints de cancer. Elle correspond à la période précédant le décès,
pendant laquelle aucun traitement efficace en terme de guérison ou de rémission ne peut être proposé. La décision
d'arrêt de tout traitement à visée curative doit être multidisciplinaire, associant les équipes hospitalières et de
ville. Elle doit être clairement expliquée au patient et à sa famille de façon à maintenir une relation de confiance.
La durée de la phase palliative est très variable d'un patient à l'autre et les décisions et modalités des traitements
doivent être adaptées à l'évolution des symptômes, en prenant en compte la dîmension humaine et en restant dans
le domaine du raisonnable, sans tomber dans l'acharnement thérapeutique. L'échange sur la mort et la prépara
tion au deuil font partie intégrante de la prise en charge palliative et ne doivent pas être omis.
• Les principaux symptômes à rechercher et à prendre en charge sont les suivants :
- douleurs;
- phénomènes compressifs (déficit neurologique d'origine centrale, compression médullaire, crise comitiale,
dyspnée, ictère, occlusion intestinale);
- syndrome hémorragique : saignement tumoral, CIVD ;
- anxiété, dépression;
- troubles de la conscience.
• Les traitements disponibles sont médicamenteux (antalgiques, anxiolytiques...), chirurgicaux et la radiothérapie.
► 128 CANCERS DE L'ENFANT UE 10 - ITEM 294
l, UE 10
.... ____________
ltem294
-M • • •
-
1
SYNTHÈSE
• La phase palliative concerne 20 % des enfants atteints de cancer.
• Les traitements réalisés doivent rester raisonnables, sans tomber dans l'acharnement thérapeutique.
• Les principaux symptômes pris en charge sont la douleur, les phénomènes compressifs, les phénomènes
hémorragiques et l'anxiété.
5. Les conséquences à long terme
• Une préoccupation majeure des équipes spécialisées en cancérologie pédiatrique a été très rapidement l'éva
luation des conséquences à long terme des traitements. La totalité des stratégies thérapeutiques proposées chez
les enfants sont ainsi marquées par le double souci de« guérir plus», et guérir« mieux», à un« prix» acceptable
obérant le moins possible le développement et l'épanouissement ultérieur de l'être en devenir qu'est l'enfant. Les
résultats remarquables obtenus dans certaines maladies par les traitements combinés actuels permettent dès à
présent d'envisager dans ces maladies (certaines leucémies et certains lymphomes en particulier) des stratégies de
désescalade thérapeutique.
• La toxicité à long terme peut toucher tous les organes et toutes les fonctions : cardiaque, pulmonaire, rénale,
endocrinienne, auditive, système nerveux central, fertilité...
• La survenue de deuxièmes cancers, par définition différents d'une récidive ou d'une métastase du cancer primitif,
représente un réel problème avec un risque cumulatif évalué entre 3,7 et 12 % après un délai de 25 ans après le
traitement de la maladie initiale.
Le type histologique de ces seconds cancers apparaît comme la résultante de plusieurs facteurs :
- les modalités de traitement utilisées initialement (sarcome survenant en territoire irradié, carcinome de la
thyroïde après irradiation même à faibles doses, leucémies après chimiothérapies incluant alkylants et/ou
épipodophyllotoxines ... );
- le type du cancer primitif (cancer du sein et maladie de Hodgkin...);
- l'existence d'un terrain prédisposant: syndrome de Li Fraumeini, rétinoblastome héréditaire...
• Des programmes de suivi à long terme sont mis en place depuis quelques années dans les centres d'oncologie
pédiatrique afin de diagnostiquer et prendre en charge les séquelles des traitements, notamment lors du passage
au monde adulte.
SYNTHÈSE
• Le risque de séquelles est d'autant plus important que les enfants sont jeunes au moment du traitement.
• La toxicité à long terme peut toucher tous les organes et fonctions.
• Un programme de suivi à long terme a été mis en place au niveau national.
► Références
• Les cancers de l'enfant, édition 2015,www.e-cancer.fr
• Campus de pédiatrie. Collège National des Pédiatres Universitaires, chapitres 44, 139,294,http://campus.cerimes.fr/pediatrie
• A. Laprie, L. Podovani, V. Bernier et al. Radiothérapie des cancers de l'enfant, Cancer Radiother, 2016,20: 5 216-226.
LJE 10 - ITEM 294 1 CANCERS DE L'ENFANT 129 ◄
POINTS CLÉS
1. L'incidence des cancers de l'enfant et de l'adolescent est de 2 400/an en France. Le taux de gué
rison est de l'ordre de 80 %, et les tumeurs les plus fréquentes sont hématologiques et cérébrales.
2. Les cancers de l'enfant se caractérisent par leur croissance rapide, l'habituelle conservation de
l'état général, la multiplicité et le caractère souvent« banal» des signes d'appel cliniques, dont la
persistance/fixité au-delà de 15 jours doit alerter.
3. Les 6 grands groupes de tumeurs malignes chez l'enfant sont: hématologiques, du système
nerveux central, de blastème d'orgànes, conjonctives, germinales, neuroectodermiques. Les traite
ments principaux des cancers de l'enfant sont, comme chez l'adulte, la chimiothérapie, la chirurgie
et la radiothérapie. La chimiothérapie joue un rôle essentiel, particulièrement dans les tumeurs
embryonnaires et les maladies hématologiques (leucémies et lymphomes).
4. Le risque de séquelles, pouvant intéresser tous les organes, est d'autant plus important que les
enfants sont jeunes au moment du traitement, et nécessite un suivi à long terme.
LE COUP DE POUCE DE L'ENSEIGNANT
1. Tout symptôme dit« banal» qui dure doit attirer l'attention.
2. L'examen clinique est primordial pour le diagnostic précoce.
3. Les tumeurs cérébrales ont un plus mauvais pronostic que les autres cancers de l'enfant.
4. Un suivi à long terme est indispensable chez un enfant guéri, afin de dépister et prendre en
charge les séquelles éventuelles.
► 130 CANCERS DE L'ENFANT LJE 10 - ITEM 294
Vous aimerez peut-être aussi
- EMC 2005. Cancers de La Cavité Buccale. Préambule, Épidémiologie, Étude CliniqueDocument18 pagesEMC 2005. Cancers de La Cavité Buccale. Préambule, Épidémiologie, Étude CliniqueMarouaBOUFLIJAPas encore d'évaluation
- Oncologie FasciculesDocument168 pagesOncologie Fasciculespanchoss2001Pas encore d'évaluation
- 12 Item 299 Tumeurs Cutanées Épithéliales Et Mélaniques - Medline Cancéro 20Document18 pages12 Item 299 Tumeurs Cutanées Épithéliales Et Mélaniques - Medline Cancéro 20DAVID THYPas encore d'évaluation
- 09 Item 296 Tumeurs Intracrâniennes - Medline Cancéro 20Document16 pages09 Item 296 Tumeurs Intracrâniennes - Medline Cancéro 20DAVID THYPas encore d'évaluation
- C1. Le Cancer Chez L'enfantDocument26 pagesC1. Le Cancer Chez L'enfantSandra LouPas encore d'évaluation
- Cancer de L'enfantDocument7 pagesCancer de L'enfantRani SunamPas encore d'évaluation
- 17 Item 304 Tumeurs Des Os Primitives Et Secondaires - Medline Cancéro 20Document18 pages17 Item 304 Tumeurs Des Os Primitives Et Secondaires - Medline Cancéro 20DAVID THYPas encore d'évaluation
- Cancer Du Col de L'uterus - R4Document97 pagesCancer Du Col de L'uterus - R4djihane4Pas encore d'évaluation
- 15 Item 302 Tumeurs de L - Oesophage - Medline Cancéro 20Document20 pages15 Item 302 Tumeurs de L - Oesophage - Medline Cancéro 20DAVID THYPas encore d'évaluation
- Medecine Nucleaire-2Document9 pagesMedecine Nucleaire-2Donatien MukazPas encore d'évaluation
- 11 Item 298 Tumeurs Du Côlon Et Du Rectum - Medline Cancéro 20Document14 pages11 Item 298 Tumeurs Du Côlon Et Du Rectum - Medline Cancéro 20DAVID THYPas encore d'évaluation
- Cancers de La Thyroïde - OrganiséDocument4 pagesCancers de La Thyroïde - OrganiséEl-Hirech NesrinePas encore d'évaluation
- Cancers de L'enfantDocument11 pagesCancers de L'enfantAdrianah OlyPas encore d'évaluation
- Cancers de La ThyroideDocument7 pagesCancers de La ThyroideAnfel KeraghelPas encore d'évaluation
- 10 Item 297 Tumeurs Du Col Utérin, Tumeurs Du Corps Utérin - Medline Cancéro 20Document22 pages10 Item 297 Tumeurs Du Col Utérin, Tumeurs Du Corps Utérin - Medline Cancéro 20DAVID THYPas encore d'évaluation
- Cancer de L'enfantDocument20 pagesCancer de L'enfantIbtissam AdamPas encore d'évaluation
- Introdu Patho TM Maligne 5ème PR BOUADAM.FDocument6 pagesIntrodu Patho TM Maligne 5ème PR BOUADAM.FWafa GuerPas encore d'évaluation
- Article06 27 PDFDocument11 pagesArticle06 27 PDFHachemPas encore d'évaluation
- Cancers de L'enfant Et La 22-23Document54 pagesCancers de L'enfant Et La 22-23blackshady728Pas encore d'évaluation
- MédulloblastomesDocument15 pagesMédulloblastomesyaalaPas encore d'évaluation
- 16 - Les Tumeurs IntracrâniennesDocument24 pages16 - Les Tumeurs Intracrâniennesouma.maziPas encore d'évaluation
- HistiocytoseDocument43 pagesHistiocytoseHenry TraoréPas encore d'évaluation
- 16 Item 303 Tumeurs de L - Ovaire - Medline Cancéro 20Document16 pages16 Item 303 Tumeurs de L - Ovaire - Medline Cancéro 20DAVID THYPas encore d'évaluation
- Cancers de La Thyroide 2Document4 pagesCancers de La Thyroide 2NDAYIRAGIJE RévérienPas encore d'évaluation
- Tumeurs Cérébrales RD 2018 DIU ONODocument236 pagesTumeurs Cérébrales RD 2018 DIU ONODiyenPas encore d'évaluation
- Carcinomes Des Maxillaires CoursDocument14 pagesCarcinomes Des Maxillaires Coursmpwpmjbg5tPas encore d'évaluation
- Fiche Cancer Enfant AdolescentDocument3 pagesFiche Cancer Enfant AdolescentbouhounhadjerPas encore d'évaluation
- 2014 Cancer Du Sein D Hudry 1 - 4Document36 pages2014 Cancer Du Sein D Hudry 1 - 4IdrissaDiarraPas encore d'évaluation
- 08 Item 295 Tumeurs de La Cavité Buccale, Naso-Sinusiennes Et VADS - Medline Cancéro 20Document12 pages08 Item 295 Tumeurs de La Cavité Buccale, Naso-Sinusiennes Et VADS - Medline Cancéro 20DAVID THYPas encore d'évaluation
- 19-Cancer de La ThyroïdeDocument66 pages19-Cancer de La ThyroïdeMoussa ChadliPas encore d'évaluation
- Les Cancers Broncho Pulmonaires Primitifs 2023Document85 pagesLes Cancers Broncho Pulmonaires Primitifs 2023Youssouf OuedraogoPas encore d'évaluation
- Tumeurs Du Sein PR MOULAY Elhadj Cours Gynéco - Obst 5ème Année Médecine 2021Document62 pagesTumeurs Du Sein PR MOULAY Elhadj Cours Gynéco - Obst 5ème Année Médecine 2021Kawthar EL AdiliPas encore d'évaluation
- Cavum 2020Document10 pagesCavum 2020choayb bahloul100% (1)
- Item 306 Tumeurs Du Poumon Primitives Et Secondaires - iKB CanceÌ Ro 20Document24 pagesItem 306 Tumeurs Du Poumon Primitives Et Secondaires - iKB CanceÌ Ro 20basmaafifiproPas encore d'évaluation
- Faculté de Médecine de Béjaia: DR Benchallal JUIN 202ODocument70 pagesFaculté de Médecine de Béjaia: DR Benchallal JUIN 202OThizmaith LionaPas encore d'évaluation
- 98 875Document5 pages98 875hizballah27Pas encore d'évaluation
- 19 Item 306 Tumeurs Du Poumon, Primitives Et Secondaires - Medline CanceÌ Ro 20Document26 pages19 Item 306 Tumeurs Du Poumon, Primitives Et Secondaires - Medline CanceÌ Ro 20basmaafifiproPas encore d'évaluation
- 10-Cancers de La Thyroïde - DR - BENZIANDocument31 pages10-Cancers de La Thyroïde - DR - BENZIANAmine SakerPas encore d'évaluation
- Valeurs MedicDocument15 pagesValeurs MedicVolanirina Rasoamiadana RasolofomamonjyPas encore d'évaluation
- Item 294 - Cancer Enfant - V3Document6 pagesItem 294 - Cancer Enfant - V3Fanny NicolasPas encore d'évaluation
- 1-Epidemiologie Prevention Et Depistage - Des CancersDocument37 pages1-Epidemiologie Prevention Et Depistage - Des CancersFarah B. BtoushPas encore d'évaluation
- Mélanomes Cutanés Cervico-FaciauxDocument9 pagesMélanomes Cutanés Cervico-FaciauxZineb BelmejdoubPas encore d'évaluation
- Tumeurs de L'ovaireDocument58 pagesTumeurs de L'ovaireMohamedPas encore d'évaluation
- Guide D'apprentissage 2.9S5 2023Document10 pagesGuide D'apprentissage 2.9S5 2023Hugo VincentPas encore d'évaluation
- Item 311 Tumeur Du ReinDocument18 pagesItem 311 Tumeur Du Reinjibli.ccPas encore d'évaluation
- DIU Maladies Du SeinDocument4 pagesDIU Maladies Du SeinGoGoPenguinVALPas encore d'évaluation
- Ref Thyroide 2015 VdéfDocument28 pagesRef Thyroide 2015 VdéfACEEE AssistPas encore d'évaluation
- Oncologie Pediatrique DR DesozaDocument55 pagesOncologie Pediatrique DR Desozachrys desoza elidadPas encore d'évaluation
- Pfe 1Document24 pagesPfe 1RaQi SalmaPas encore d'évaluation
- MelanomeDocument28 pagesMelanomeKhaled Ben AyedPas encore d'évaluation
- Neoplasies Endocriniennes MultiplesDocument37 pagesNeoplasies Endocriniennes MultiplesIngrid BalemakenPas encore d'évaluation
- 1 - Cours Neuropathologie Introduction Et Gliomes FMPR Anapath SpecialeDocument82 pages1 - Cours Neuropathologie Introduction Et Gliomes FMPR Anapath SpecialeMunir GuirouanPas encore d'évaluation
- TUMEURS TESTICULAIRES PR BENRABAHDocument18 pagesTUMEURS TESTICULAIRES PR BENRABAHjoe roséPas encore d'évaluation
- Cancers de La Thyroide TraitementDocument55 pagesCancers de La Thyroide Traitementdiego diarraPas encore d'évaluation
- GYO-Cancer Du Sein (Anapath)Document47 pagesGYO-Cancer Du Sein (Anapath)Wilfried AboPas encore d'évaluation
- Cancer EndometreDocument53 pagesCancer EndometreMohamedPas encore d'évaluation
- MéningitesDocument27 pagesMéningitesiri NaPas encore d'évaluation
- Cancérologie: Préparation IECNDocument75 pagesCancérologie: Préparation IECNChloéPas encore d'évaluation
- Fiche Neoplasie Endocrinienne Multiple de Type 2Document2 pagesFiche Neoplasie Endocrinienne Multiple de Type 2ouiamPas encore d'évaluation
- Les cancers de l'utérus: Une brochure de la Fondation contre le CancerD'EverandLes cancers de l'utérus: Une brochure de la Fondation contre le CancerPas encore d'évaluation
- 13 Item 300 Tumeurs de L - Estomac - Medline Cancéro 20Document16 pages13 Item 300 Tumeurs de L - Estomac - Medline Cancéro 20DAVID THYPas encore d'évaluation
- 17 Item 304 Tumeurs Des Os Primitives Et Secondaires - Medline Cancéro 20Document18 pages17 Item 304 Tumeurs Des Os Primitives Et Secondaires - Medline Cancéro 20DAVID THYPas encore d'évaluation
- 11 Item 298 Tumeurs Du Côlon Et Du Rectum - Medline Cancéro 20Document14 pages11 Item 298 Tumeurs Du Côlon Et Du Rectum - Medline Cancéro 20DAVID THYPas encore d'évaluation
- 04 Item 290 Médecin Préleveur de Cellules - Medline Cancéro 20Document14 pages04 Item 290 Médecin Préleveur de Cellules - Medline Cancéro 20DAVID THYPas encore d'évaluation
- QCM ConvulsionsDocument2 pagesQCM Convulsionsamédée junior wawa100% (1)
- DelaPsychoseàlaNévrose PersoDocument5 pagesDelaPsychoseàlaNévrose PersoAdam MissiouxPas encore d'évaluation
- DEPRESIONDocument13 pagesDEPRESIONJean FendjuPas encore d'évaluation
- DFGSM3 S2 HgeDocument1 pageDFGSM3 S2 Hgenicolas.ferraz3434Pas encore d'évaluation
- Eliquis AODDocument1 pageEliquis AODmarie christine cheuzevillePas encore d'évaluation
- I-11-200-Etat de Choc FICHEDocument1 pageI-11-200-Etat de Choc FICHENemo LuPas encore d'évaluation
- Universite Royale D'haiti (Urh) Anti Convulsivant-5Document21 pagesUniversite Royale D'haiti (Urh) Anti Convulsivant-5m7wfcj9bpvPas encore d'évaluation
- Exo Le CaféDocument1 pageExo Le CaféjanyPas encore d'évaluation
- 106 Confusion, Démences - 0Document4 pages106 Confusion, Démences - 0Aboubacar SomparePas encore d'évaluation
- TsaDocument246 pagesTsaSandy KOLBASIPas encore d'évaluation
- Accidents Cerebraux Ischemiques Transitoires PDFDocument3 pagesAccidents Cerebraux Ischemiques Transitoires PDFanis anis0% (1)
- PSYCOM Psycho Psychotherapies WEBDocument12 pagesPSYCOM Psycho Psychotherapies WEBElena VasilachiPas encore d'évaluation
- Item 263 - Polykystose RenaleDocument3 pagesItem 263 - Polykystose Renaleashar.dadamPas encore d'évaluation
- Malformations Cardiaques Causes Et CaracteristiquesDocument3 pagesMalformations Cardiaques Causes Et Caracteristiqueswooden latexPas encore d'évaluation
- Troubles SomatoformesDocument4 pagesTroubles SomatoformesNGUEYONG PASCALEPas encore d'évaluation
- PDF Dias PPT Webinaire Tdah 29 09 20 AppeaDocument41 pagesPDF Dias PPT Webinaire Tdah 29 09 20 AppeaEccoPas encore d'évaluation
- 19 04 ChoriocarcinomeDocument27 pages19 04 Choriocarcinomematthieu kabeyaPas encore d'évaluation
- CAT Épistaxis Omar Document de OurzikDocument23 pagesCAT Épistaxis Omar Document de Ourzikali sadikiPas encore d'évaluation
- 327 Arre - T Cardio-CirculatoireDocument2 pages327 Arre - T Cardio-CirculatoireMaria RamosPas encore d'évaluation
- La DiarrheeDocument3 pagesLa DiarrheeCheff AlexPas encore d'évaluation
- CAT Devant Une Crise D'asthmeDocument4 pagesCAT Devant Une Crise D'asthmeNouhaila MsPas encore d'évaluation
- Autisme Et Schizophrenie - These 2012Document498 pagesAutisme Et Schizophrenie - These 2012Bryan AdamsPas encore d'évaluation
- Avantages Trithérapie HTADocument47 pagesAvantages Trithérapie HTAAigle mahondiPas encore d'évaluation
- Tumeurs VésicalesDocument3 pagesTumeurs VésicalesAndry RijaPas encore d'évaluation
- 186 Fièvre Prolongée OK 2Document1 page186 Fièvre Prolongée OK 2kgtdPas encore d'évaluation
- Capsulite RetractileDocument3 pagesCapsulite RetractileMehdi AyachPas encore d'évaluation
- 4 - Les MéningitesDocument31 pages4 - Les MéningitesSaîda SalahPas encore d'évaluation