Académique Documents
Professionnel Documents
Culture Documents
Mines MP 99 - Preuve de Chimie Quelques Propriétés Des Composés de L'arsenic. A-Aspects Structuraux: 1 - 2 - 3 - 4
Transféré par
Mihnea GamanTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Mines MP 99 - Preuve de Chimie Quelques Propriétés Des Composés de L'arsenic. A-Aspects Structuraux: 1 - 2 - 3 - 4
Transféré par
Mihnea GamanDroits d'auteur :
Formats disponibles
Mines MP 99 - preuve de chimie Quelques proprits des composs de larsenic. A- Aspects structuraux : 1N, P et As ont tous 5 lectrons de valence...
23 liaisons covalentes. 3Lnergie dionisation de latome E est lnergie ncessaire pour arracher un lectron + latome pris ltat gazeux Egaz = E gaz + e . 4 Le rayon de Bohr tant a0, les rayons atomiques r varient en fonction de la charge effective Z* ressentie par llectron le plus externe et du numro atomique effectif n* de lorbitale associe 2 n* selon r = a0 (thorie de Bohr prolonge aux atomes hydrognodes puis aux atomes Z* polylectroniques). Dans une colonne, Z* garde une mme valeur (effets dcran similaires) et la dpendance est donc dfinie par n* qui augmente avec n : le rayon atomique crot quand on descend la colonne. Lnergie de premire ionisation est lnergie fournir pour arracher un lectron latome gazeux. On peut lidentifier loppos de lnergie orbitalaire de Slater de llectron qui est arrach (ou mieux, la diffrence des nergies de Slater de latome Z lectrons et de lion Z *2 et, lintrieur dune mme Z-1 lectrons). Les nergies orbitalaires varient selon n *2 colonne, Z* reste invariable, tandis que n* crot : lnergie dionisation diminue donc quand on descend la colonne. 5-
Mmes bromures avec P ; mais avec N il nexiste pas de compos pentavalent (pas dexceptions la rgle de loctet). 6AsBr3 : Pyramide base triangulaire de sommet As drive dun ttradre de centre As AsBr5 : Bipyramide base triangulaire centre sur As. 7-
8- Dans AsO33-, trois liaisons quivalentes simples ; dans AsO43-, les quatre liaisons sont quivalentes (par msomrie) mais plus courtes que les prcdentes (liaisons partiellement doubles). 93 Na+, AsO333 Ca2+ , 2 AsO33Al3+ AsO3316/08/2006 1
10- Polarit de la molcule NH3 lie la forte lectrongativit de lazote (P est nettement moins lectrongatif). Existence de liaisons hydrogne entre les molcules NH3 et H2O. B- Oxydo-rduction B-1 Diagramme potentiel-pH 11-
12- Acide arsnieux : degr 3 Acide arsnique : degr 5 13- Les espces sont directement identifies celles figurant sur lchelle de pH ci-dessus (formes oxydes au-dessus des frontires redox et formes rduites en-dessous, forme acide gauche et forme basique droite de chaque frontire dquation pH = pKa). 14H2AsO4- + 3 H3O+ + 2 e - H3AsO3 + 4 H2O 150,06 [H2 AsO4 ] H + 3 E = E ( H 2 AsO4 / H3 AsO3 ) = E 0 ( H2 AsO4 / H3 AsO3 ) + log 2 [H3 AsO3 ] La pente est donc -0,09 V/unit de pH. Lordonne lorigine se calcule par identification avec le couple ( H3AsO4 / H3AsO3 ) : 0,06 [H AsO4 ] H + 2 K E = E 0 ( H2 AsO4 / H 3 AsO3 ) + log 3 a1 2 [H3 AsO3 ]
[ ]
[ ]
E = E 0 ( H2 AsO4 / H 3 AsO3 ) 0,03 pKa1 + E = E 0 ( H3 AsO4 / H3 AsO3 ) + 0,06 2 log
[H3 AsO4 ] H + 2 [H3 AsO3 ][ ]
[H AsO4 ] H+ 0,06 log 3 2 [H3 AsO3 ]
[ ]
On en dduit / H3 AsO3 ) = E 0 ( H3 AsO4 / H3 AsO3 ) + 0,03 pKa1 = 0,56 + 0,06 = 0,62V E 0 ( H2 AsO4
B-2 Dplacement dune raction redox 16- Si pH diminue, [H+] augmente et lquilibre est dplac dans le sens (la rduction de Ox1 par Red2 est davantage favorise). 17- pH = 8, le diagramme potentiel-pH auquel on superpose le diagramme du couple I2/Iindique que le diiode est rduit ltat dion iodure par lacide arsnieux H3AsO3 qui soxyde en hydrognoarsniate HAsO42- selon : (Raction A) I2 + 5 H2O + H3AsO3 2 I- + HAsO42- + 4 H3O+ 18- pH = 0, le diagramme potentiel-pH indique que larsenic au degr doxydation 5 ne peut plus coexister avec les ions iodure. La raction qui se droule scrit : 2 H30 + + H3AsO4 + 2 I- H3AsO3 + I2 + 3 H2O
16/08/2006
On peut aussi raisonner en considrant que la raction A est dplace dans le sens par le milieu acide ; en outre, ce nest pas HAsO42- qui est consomm, mais plutt H3AsO4 qui constitue en ralit la forme de larsenic au degr doxydation 5 pH = 0. 193 I2 + 9 H2O 5 I- + IO3- + 6 H3O+ 20- Par un mlange tampon ou plus simplement un excs de lampholyte hydrognocarbonate qui pK1 + pK2 maintient le pH la valeur pH = 8. 2
B-3 Dosage dun insecticide 21- La raction du dosage est est celle de la question 17 (raction A qui ncessite la mme quantit de diiode et dacide arsnieux). La quantit de matire de H3AsO3 est donc : n( H3 AsO3 ) = n( I2 ) = 0,025 0, 020 = 0,50 mmol 1 soit encore n( As2O3 ) = n( H3 AsO3 ) = 0,25mmol 2 ce qui correspond un pourcentage massique en As2O3 (de masse molaire M = 198 g.mol-1) 198 3 Pourcentage = 100 0,25 10 = 0,6% 8,25 C- Cintique de loxydation de As(III) par H2O2 22- Il y a dgnrescence de lordre par rapport au peroxyde dhydrogne. Les vitesses initiales sont les opposs des pentes des tangentes lorigine chacune des courbes reprsentatives de la concentration en As(III). 0,2 = 6,67.10 3 mol.. L 1.min 1 v0 A = 30 0,1 v0 = 3,33.10 3 mol.. L1.min 1 B = 30
C0 v0 A . On en dduit = 1 . Si lordre partiel par rapport As(III) est , on a : A = 0 v0 CB B 23- En notant C la concentration instantane en As(III) ou en peroxyde dhydrogne et k la constante de vitesse, la loi cintique scrit : dC v= = kC1+ qui sintgre en C Ci = kt do lon dduit dt 2 1 2 1 soit encore A= ln( t1 / 2 ) = ln( Ci ) + ln k k 24- La constante de vitesse k dpend de la temprature (frquence des collisions efficaces). Elle ne dpend a priori pas de la pression et ceci dautant plus quon a affaire une raction en phase condense.
16/08/2006
Vous aimerez peut-être aussi
- DS6 PSI Corrige PDFDocument8 pagesDS6 PSI Corrige PDFHafidi AhmedPas encore d'évaluation
- Exercices Chimie Des MatériauxDocument14 pagesExercices Chimie Des Matériaux7box.bePas encore d'évaluation
- Solution TD 3Document6 pagesSolution TD 3Rhm GamingPas encore d'évaluation
- Corrigé CNC Chimie 2012 MPDocument6 pagesCorrigé CNC Chimie 2012 MPzazazaz2000100% (1)
- Cours SolubiliteDocument9 pagesCours SolubilitePatru Cristina100% (1)
- 5351 Entrainement TSDocument6 pages5351 Entrainement TSmohammed laadili100% (1)
- AsbrDocument4 pagesAsbrotmnsatPas encore d'évaluation
- Architecture Moléculaire Et StéréochimieDocument5 pagesArchitecture Moléculaire Et StéréochimielucatelliPas encore d'évaluation
- DS 06 Filtrage Champs E Et B Cristallographie PDFDocument9 pagesDS 06 Filtrage Champs E Et B Cristallographie PDFAchillePas encore d'évaluation
- 2013 BCPST Agro Veto A Chimie - CorrigéDocument7 pages2013 BCPST Agro Veto A Chimie - CorrigéLarbi BadrourPas encore d'évaluation
- Recueil Chimie 3Document8 pagesRecueil Chimie 3Safae RezzoukPas encore d'évaluation
- TD ElectrochimieDocument8 pagesTD ElectrochimieRAMDEPas encore d'évaluation
- TD Electrochimie Et Applications, L3 Chimie Et M1 SC Phys 2018-2019Document4 pagesTD Electrochimie Et Applications, L3 Chimie Et M1 SC Phys 2018-2019fernandPas encore d'évaluation
- 2013 MP Mines Chimie - CorrigéDocument4 pages2013 MP Mines Chimie - CorrigéLarbi BadrourPas encore d'évaluation
- Concours 2012 (+sol.) Proposition EPST23Document19 pagesConcours 2012 (+sol.) Proposition EPST23Nidal BestPas encore d'évaluation
- MP CHIMIE CCP 1 2008.extrait PDFDocument4 pagesMP CHIMIE CCP 1 2008.extrait PDFkmeriemPas encore d'évaluation
- Concept Donneur-Accepteur-ResumeCours ProfDocument6 pagesConcept Donneur-Accepteur-ResumeCours ProfAnt ManPas encore d'évaluation
- Equilibres Chimiques, Corrigés Des ExercicesDocument33 pagesEquilibres Chimiques, Corrigés Des ExercicesAbdou WahidPas encore d'évaluation
- Sem 2 BghyuDocument3 pagesSem 2 BghyuAnonymous FikOnlapPas encore d'évaluation
- Chimie GeneraleDocument52 pagesChimie GeneralePap BlingPas encore d'évaluation
- Chimie 4 Probleme Resolu 4 ADocument8 pagesChimie 4 Probleme Resolu 4 Agzqg9cp7mtPas encore d'évaluation
- Chapitre 3 Chimie ÉlectrolyseDocument50 pagesChapitre 3 Chimie Électrolyseyoussefinter61Pas encore d'évaluation
- TD - Electrochimie - IUT Bobo Mai 2022Document5 pagesTD - Electrochimie - IUT Bobo Mai 2022Abdoul Kader OUATTARAPas encore d'évaluation
- TRAVAUX DIRIGES N°4 OXYDO - REDUCTION Et DIAGRAME E-pHDocument4 pagesTRAVAUX DIRIGES N°4 OXYDO - REDUCTION Et DIAGRAME E-pHAlex N'zuePas encore d'évaluation
- $RP0QVILDocument7 pages$RP0QVILAudrey KuatePas encore d'évaluation
- Fascicule de Révision Chimie PDFDocument26 pagesFascicule de Révision Chimie PDFmoane8Pas encore d'évaluation
- Ds 3 CorrigeDocument18 pagesDs 3 Corrigeazizaziz21212121212121Pas encore d'évaluation
- Série Courbe Intensité PotentielDocument9 pagesSérie Courbe Intensité PotentielWael Zid100% (2)
- TD I-EDocument6 pagesTD I-EmugiPas encore d'évaluation
- Corrigé Examen 2017-2018Document4 pagesCorrigé Examen 2017-2018Leo Martinez100% (1)
- Corrigé Du CC1-2022-2023Document8 pagesCorrigé Du CC1-2022-2023jonasserfaty12Pas encore d'évaluation
- Correction TD Série 4-20-21Document13 pagesCorrection TD Série 4-20-21ZouikrPas encore d'évaluation
- Diagrammes - E PH ExosDocument5 pagesDiagrammes - E PH Exossamim19710% (1)
- 1 ConductimetrieDocument10 pages1 Conductimetrieqal123Pas encore d'évaluation
- Oxydoréduction PBDocument12 pagesOxydoréduction PBRajaa BousmaraPas encore d'évaluation
- Calcul Pour Gaz Naturel PDFDocument10 pagesCalcul Pour Gaz Naturel PDFMallouli KeremPas encore d'évaluation
- 3 - Chap3 - Réactions Acide-Base - Mode de Compatibilité PDFDocument53 pages3 - Chap3 - Réactions Acide-Base - Mode de Compatibilité PDFoulai100% (1)
- 1 Le Molécule de D Corrigé 1Document14 pages1 Le Molécule de D Corrigé 1Alami AbdouPas encore d'évaluation
- ChloreDocument18 pagesChloreDarel NadjieraPas encore d'évaluation
- Solutionaqueusechap 5Document13 pagesSolutionaqueusechap 5sylvie jacklinePas encore d'évaluation
- Partie B Chap IIDocument18 pagesPartie B Chap IIMahran BchatniaPas encore d'évaluation
- EXO4Document6 pagesEXO4Arthur Franck Patrick BledouPas encore d'évaluation
- Cours Equilibre OX-REDDocument14 pagesCours Equilibre OX-REDSabeur KhemakhemPas encore d'évaluation
- Correction Concours UE1 2017 2018Document13 pagesCorrection Concours UE1 2017 2018Jean LafittePas encore d'évaluation
- Chapitre 5Document18 pagesChapitre 5Ny Aina AndriamaroPas encore d'évaluation
- Chapitre2 Lois de Faraday PDFDocument13 pagesChapitre2 Lois de Faraday PDFOussama El BouadiPas encore d'évaluation
- 2008 Examen Chimie Mai SolveDocument3 pages2008 Examen Chimie Mai SolvekarimovPas encore d'évaluation
- Cnc-Chimie-Mp-19999a CorrigéDocument7 pagesCnc-Chimie-Mp-19999a CorrigéAz-eddine KaibaPas encore d'évaluation
- 03 OxydoréductionDocument11 pages03 OxydoréductionIbrahim Labhar100% (1)
- Cours Chimie OrganiqueDocument60 pagesCours Chimie OrganiqueFarah BahriPas encore d'évaluation
- CORRECTUM - Exo Chimie Du SolideDocument8 pagesCORRECTUM - Exo Chimie Du SolideLenz Daniel Jean PaulPas encore d'évaluation
- TD Courbes Intensité-Potentiel + Sol Exo 6Document3 pagesTD Courbes Intensité-Potentiel + Sol Exo 6Hamza Kaidi100% (5)
- 02 Équilibre Doxydo RéductionDocument15 pages02 Équilibre Doxydo Réductional mounir alaoui0% (1)
- Pcsi - DL 04Document3 pagesPcsi - DL 04jawahermohamed.maPas encore d'évaluation
- Comp1 Ex1Document4 pagesComp1 Ex1Céline LuttiPas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Stéréochimie organique: Les Grands Articles d'UniversalisD'EverandStéréochimie organique: Les Grands Articles d'UniversalisPas encore d'évaluation
- Glucides: Les Grands Articles d'UniversalisD'EverandGlucides: Les Grands Articles d'UniversalisPas encore d'évaluation
- P 05 PT 1 CDocument4 pagesP 05 PT 1 CMihnea GamanPas encore d'évaluation
- I - Equilibre D'une Particule Solide Dans Un FluideDocument10 pagesI - Equilibre D'une Particule Solide Dans Un FluideMihnea GamanPas encore d'évaluation
- P 05 CT 1 eDocument8 pagesP 05 CT 1 eMihnea GamanPas encore d'évaluation
- Centrale PC 2005 Les Bulles Du Champagne Partie I Formation de BullesDocument7 pagesCentrale PC 2005 Les Bulles Du Champagne Partie I Formation de BullesMihnea GamanPas encore d'évaluation
- Concours Essaim: Épreuve de Sciences Physiques Durée 3 Heures Classes Préparatoires ATS - TSIDocument7 pagesConcours Essaim: Épreuve de Sciences Physiques Durée 3 Heures Classes Préparatoires ATS - TSIMihnea GamanPas encore d'évaluation
- Corrigeschimie 2007Document171 pagesCorrigeschimie 2007Mihnea GamanPas encore d'évaluation
- Corrigeschimie 2006Document158 pagesCorrigeschimie 2006Mihnea GamanPas encore d'évaluation
- Chapitre1 Chimie 2Document8 pagesChapitre1 Chimie 2bachir bennaoumPas encore d'évaluation
- Préchauffage de BRADocument144 pagesPréchauffage de BRAHasni jilaliPas encore d'évaluation
- Application Note Spray CoatingsDocument6 pagesApplication Note Spray CoatingsElly PegPas encore d'évaluation
- Cours Réactions Précipitation Et Complexation-L1SVTE 2020-2021Document27 pagesCours Réactions Précipitation Et Complexation-L1SVTE 2020-2021Haroun moussa HarounPas encore d'évaluation
- 1bac Drs DRRDocument1 page1bac Drs DRRAsmae SamaPas encore d'évaluation
- Science Des Matériaux - GénéralitésDocument23 pagesScience Des Matériaux - GénéralitésBouallegue MounirPas encore d'évaluation
- Chapitre 5Document6 pagesChapitre 5deprado.leoPas encore d'évaluation
- 2022 CCINP Physique Chimie PSI Corrige Développement DurableDocument9 pages2022 CCINP Physique Chimie PSI Corrige Développement DurableMeriem El AbzazePas encore d'évaluation
- Chapitre 6Document28 pagesChapitre 6Mohamed SarmoukPas encore d'évaluation
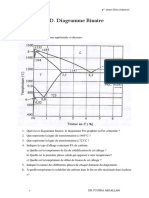
- TD - Diagramme BinaireDocument3 pagesTD - Diagramme BinaireOumeyma Hamlaui100% (2)
- Chimie Minerale 1Document16 pagesChimie Minerale 1HenockPas encore d'évaluation
- TD1 ThermodynamiqueDocument4 pagesTD1 ThermodynamiqueYunusPas encore d'évaluation
- Chap 4 - Effets ThermiquesDocument37 pagesChap 4 - Effets ThermiquesSamantha FarahPas encore d'évaluation
- CHIMIEDocument3 pagesCHIMIEMelvin LavironPas encore d'évaluation
- Master Academique: ThèmeDocument80 pagesMaster Academique: ThèmeCrocus AdelysePas encore d'évaluation
- Biophysique2an SolutionsDocument71 pagesBiophysique2an SolutionsMina RhmPas encore d'évaluation
- G1SPHCH02714 Sujet 030Document9 pagesG1SPHCH02714 Sujet 030kaanichesana29Pas encore d'évaluation
- TD Serie 1Document2 pagesTD Serie 1Snaptube 2022100% (1)
- TP 10 Representation Spatiale de Molecules BisDocument7 pagesTP 10 Representation Spatiale de Molecules BisHossain HamidounPas encore d'évaluation
- Cours IntroductionauRaffinageetlaPtrochimie LABSI Nov2021Document40 pagesCours IntroductionauRaffinageetlaPtrochimie LABSI Nov2021Loïc steve Nyamsi BefouraPas encore d'évaluation
- Canevas Poster L3 2022Document1 pageCanevas Poster L3 2022nourelhoudatebbanePas encore d'évaluation
- Cours 1Document48 pagesCours 1Faris Abd ElmajidPas encore d'évaluation
- TD Électrochimie de Chimie Analytique 2eme Année Pharmacie DR DJAOUDocument5 pagesTD Électrochimie de Chimie Analytique 2eme Année Pharmacie DR DJAOUmoh moh100% (1)
- TP SéchageDocument4 pagesTP SéchageManel 123Pas encore d'évaluation
- Chapitre II Mise en Oeuvre Des Capteurs SPR À Fibre Optique: Ii.1. Généralités Sur Les Fibres OptiquesDocument14 pagesChapitre II Mise en Oeuvre Des Capteurs SPR À Fibre Optique: Ii.1. Généralités Sur Les Fibres Optiquesthe xXx manPas encore d'évaluation
- Inter Sismique Reflexion M1 GGDocument12 pagesInter Sismique Reflexion M1 GGfrancoise xavierPas encore d'évaluation
- Guide DépannageDocument68 pagesGuide DépannageMariem DHOUIBPas encore d'évaluation
- Chimie 2016Document4 pagesChimie 2016Zahi AlkhaledPas encore d'évaluation
- Ade Compact 3020 Opellation ManualDocument29 pagesAde Compact 3020 Opellation ManualOmarAlirioSuarezCañaretePas encore d'évaluation
- Série 03 TCSFDocument3 pagesSérie 03 TCSFAliPas encore d'évaluation